制川乌配伍白芍对6 种乌头生物碱经皮吸收的影响
2015-01-13杨华生梁秉文黎晓丽罗永明
杨华生, 梁秉文, 黎晓丽, 罗永明, 吴 璐*
(1. 江西中医药大学,江西 南昌330004;2. 中国人民解放军第454 医院,江苏 南京210002)
制川乌为毛茛科植物乌头Aconitum carmchaeli Dex. 的母根的炮制加工品,味辛、苦,性热,有毒,主要含有双酯型乌头生物碱乌头碱(aconitine,AT)、次乌头碱(hypaconitine,HT)、新乌头碱(meaconitine,MT)及毒性较低的单酯型生物碱苯甲酰乌头原碱(benzoylaconine,BA)、苯甲酰次乌头原碱(benzoylhypaconine,BH)、苯甲酰新乌头原碱(benzoylmesaconine,BM),以及毒性更低的脂型生物碱等[1];白芍为毛茛科植物芍药Paeonia lactifloria pall. 的干燥根,主要含有芍药苷、芍药花苷等。制川乌与白芍常配伍使用,《中医方剂大辞典》记载有制川乌-白芍配伍的方剂就达208 首之多[2],为历代医家广为重用的药对,代表方剂有乌头汤,主要用于治疗类风湿性关节炎、腰椎间盘突出症、坐骨神经痛、膝关节积液等。
目前,制川乌白芍配伍机理的研究主要从体外、体内两个方面进行,体外从化学成分溶出量探讨“增效减毒”的物质基础,体内多采用口服等非外用给药途径研究配伍对药效的影响[3]。临床已证实,经皮给药等“中医外治”法是治疗疼痛、炎症等风湿痹证最常用、最有效的给药方式之一,制川乌白芍配伍经皮给药后,是否也可产生“增效减毒”效应,其机理如何,目前还没有针对这些问题的研究。本实验从经皮转运的角度探讨制川乌白芍配伍“增效减毒”的配伍机理,从现代经皮转运角度探讨并诠释传统外用中药配伍的合理性。
1 材料与仪器
Agilent 1260 高效液相色谱仪,Agilent 化学工作站(美国Agilent 公司);YB-P6 智能透皮试验仪(天津药典标准仪器厂);赛多利斯BS 110S 型电子分析天平(北京赛多利斯公司)。
制川乌饮片购自江油恒源药业集团有限公司,产地四川;白芍饮片购自亳州市长生中药饮片有限公司,产地安徽,经江西中医药大学付小梅副教授鉴定分别为毛茛科植物乌头Aconitum carmchaeli Dex. 母根的炮制加工品和毛茛科植物芍药Paeonia lactiflora Pall 的干燥根。白芍提取物(取白芍饮片,加70%乙醇回流提取,合并滤液,挥干乙醇,浓缩,D101 大孔树脂纯化,收集70% 乙醇洗脱液,挥干乙醇,真空干燥得白芍干浸膏,以芍药苷计263.49 mg/g,以芍药总苷计506.7 mg/g);制川乌提取物(取制川乌粗粉,加95%乙醇冷浸3次,分别提取5、3、2 d,合并滤液,常温下挥干乙醇,加水稀释到每3 mL 提取液中含有1 g 生药,D101 大孔树脂纯化,收集无水乙醇洗脱液,常温下挥干乙醇,真空干燥,得制川乌干浸膏[4-6],其中以单酯型生物碱计为30.43 mg/g,以双酯型乌头生物碱计为9.39 mg/g );苯甲酰新乌头原碱(批号111795-201102)、苯甲酰乌头原碱 (批号111794-201102)、苯甲酰次乌头原碱 (批号111796-201002)、 新 乌 头 碱 (批 号 110799-201106)、次乌头碱(批号110798-201307)、乌头碱(批号101720-201111)、芍药苷(批号110736-201337,纯度94.9%),购自中国药品生物制品检定所。乙腈为色谱纯(国药集团化学试剂有限公司);水为双蒸水;其他试剂均为分析纯。
昆明种清洁级小鼠,体质量18 ~22 g,由江西中医学院实验动物中心提供,许可证号SCXK(赣)2011-0001。
2 方法
2.1 接收液中6 种酯型乌头生物碱的测定
2.1.1 混合对照品溶液的制备 精密称取苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、新乌头碱、次乌头碱、乌头碱对照品适量,加0.01 mol/L 的盐酸制成质量浓度分别为苯甲酰新乌头原碱165.6 μg/mL、苯甲酰乌头原碱25.4 μg/mL、苯甲酰次乌头原碱24.6 μg/mL、新乌头碱67.2 μg/mL、次乌头碱 75.6 μg/mL、乌头碱 27.2 μg/mL混合对照品溶液,置4 ℃冰箱中保存备用。
2.1.2 供试品溶液的制备[7-10]取透皮接收液适量,加氨试液调节pH 为10 ~11,用三氯甲烷萃取5 次,每次10 mL,合并三氯甲烷液,低温蒸干,残渣加0.01 mol/L 盐酸溶液2 mL 溶解,过滤,即得。
2.1.3 色谱条件 Cromasil C18色谱柱(4.6 mm ×250 mm,5 μm );柱温30 ℃;流动相A 相为乙腈-四氢呋喃(25 ∶15),B 相为0.1 mol/L 醋酸铵溶液(每1 000 mL 加冰醋酸0.5 mL),梯度洗脱(0 ~48 min,15%→26%A;48 ~49 min,26%→35%A;49 ~58 min,35%A;58 ~65 min,35%→15% A);检测波长为235 nm;体积流量为1 mL/min。
2.2 离体透皮吸收实验
2.2.1 离体小鼠皮肤的制备 取清洁级小鼠,处死后用电动剃须刀剃毛。剥离腹部皮肤,仔细剔除皮下脂肪和黏连物, -20 ℃保存,使用前自然解冻,皮肤在30 d 内用完。
2.2.2 给药池溶液的制备 制川乌组:称取制川乌提取物适量,加纯化水溶解,即得供给池液,其中苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、新乌头碱、次乌头碱、乌头碱等6 种酯型生物碱的质量浓度分别为561.068、123.920、49.755、155.489、42.883、28.276 μg/mL;制川乌-白芍组:6 种酯型生物碱的质量浓度同制川乌组,芍药苷的质量浓度为8.593 mg/mL。
2.2.3 体外透皮实验 采用YB-P6 型智能透皮试验仪,水浴温度为(37 ±0.5)℃,搅拌速度转速为200 r/min,有效透过面积为1.76 cm2,接收池容积为15 mL,接受液为生理盐水。将皮肤平整铺于供给池和接受池中间,表皮层面向供给池,真皮层面向接受池。在供给池、接受池中分别加入供给液及接受液,在2、5、10、24、48 h 时,从接收池中取出全部接受液(同时补加同温的新鲜接受液),按“2.1.3”项下方法测定,计算累计透过量Q。
2.2.4 数据处理 单位面积累积经皮渗透量的计算公式Q= (ΣCi·Vi)/ A,以Q 对t 作曲线,并对曲线中的直线部分进行回归,求出直线斜率dQ/dt,即为药物的稳态渗透速率Jss(h·μg/cm2)。公式中Ci是第i 个取样点测得的药物浓度,i =1、2、3、4、5;V 为接收池的体积(15 mL);A 是扩散池的扩散面积 (A = 1.76 cm2)。用公式Papp=(dQ/dt)/C0计算表观渗透系数,C0是给药池中药物的浓度。数据以±s 表示,用t 检验进行差异显著性比较,P <0.05 认为具有统计学意义。
3 结果
3.1 接收液中6 种酯型乌头生物碱测定方法学考察 在“2.1.3”项色谱条件下,苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、新乌头碱、次乌头碱、乌头碱分别在82.8 ~2 484 ng、12.7 ~381 ng、12.3 ~369 ng、33.6 ~1 008 ng、37.8 ~1 134 ng、13.6 ~408 ng 范围内线性关系良好,最低检测限分别为16.56 ng、7.62 ng、7.38 ng、20.16 ng、22.68 ng、10.88 ng,精 密 度 的RSD 分别为0.39%、1.81%、0.87%、1.20%、0.70%、1.95%,样品溶液在16 h 内稳定,RSD分 别 为 0.30%、 1.65%、 1.79%、 0.48%、2.76%、2.30%,重复性试验的RSD 分别0.41%、1.65%、2.30%、2.61%、1.84%、3.92%。6 种酯型生物碱与皮肤浸出液中的组分及其他组分均能达到基线分离,且阴性无干扰,结果见图1。
3.2 配伍对制川乌中6 种酯型乌头生物碱经皮吸收的影响 制川乌组与制川乌配伍白芍组中6 种酯型生物碱苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、新乌头碱、次乌头碱、乌头碱的透皮速率、渗透系数见表1,透皮曲线见图2。
表1 6 种酯型乌头生物碱经皮渗透Q-t 回归方程、透皮速率、渗透系数(±s,n=3)Tab.1 Q-t regression equations,permeation rates and coefficients of six aconitine alkaloids through excised mice skin in vitro(±s,n=3)
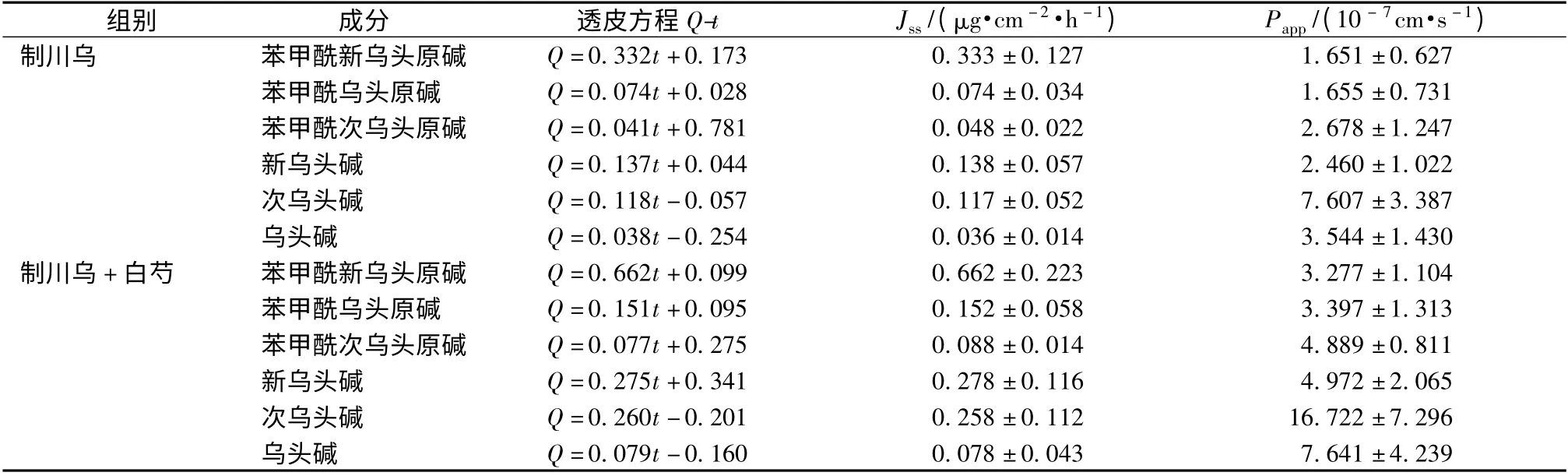
表1 6 种酯型乌头生物碱经皮渗透Q-t 回归方程、透皮速率、渗透系数(±s,n=3)Tab.1 Q-t regression equations,permeation rates and coefficients of six aconitine alkaloids through excised mice skin in vitro(±s,n=3)
组别 成分 透皮方程Q-t Jss/(μg·cm -2·h -1) Papp/(10 - 7cm·s -1)+0.173 0.333 ±0.127 1.651 ±0.627苯甲酰乌头原碱 Q=0.074t+0.028 0.074 ±0.034 1.655 ±0.731苯甲酰次乌头原碱 Q=0.041t+0.781 0.048 ±0.022 2.678 ±1.247新乌头碱 Q=0.137t+0.044 0.138 ±0.057 2.460 ±1.022次乌头碱 Q=0.118t-0.057 0.117 ±0.052 7.607 ±3.387乌头碱 Q=0.038t-0.254 0.036 ±0.014 3.544 ±1.430制川乌+白芍 苯甲酰新乌头原碱 Q=0.662t+0.099 0.662 ±0.223 3.277 ±1.104苯甲酰乌头原碱 Q=0.151t+0.095 0.152 ±0.058 3.397 ±1.313苯甲酰次乌头原碱 Q=0.077t+0.275 0.088 ±0.014 4.889 ±0.811新乌头碱 Q=0.275t+0.341 0.278 ±0.116 4.972 ±2.065次乌头碱 Q=0.260t-0.201 0.258 ±0.112 16.722 ±7.296乌头碱 Q=0.079t制川乌 苯甲酰新乌头原碱 Q=0.332t-0.160 0.078 ±0.043 7.641 ±4.239
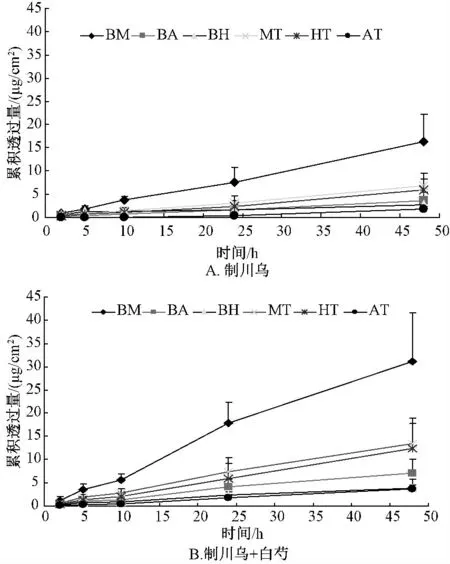
图2 制川乌体外累积渗透曲线(n=3)Fig.2 In vitro percutaneous absorption curves of prepared aconite (n=3)
从表1、图2 可以看出,制川乌白芍配伍后制川乌中单酯型乌头生物碱苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的表观渗透系数明显增加 (P <0.05),分别为未配伍组的1.99、2.05、1.83 倍;而双酯型乌头生物碱新乌头碱、次乌头碱、乌头碱的的表观渗透系数未见明显升高(P >0.05)。
4 讨论
制川乌中酯型乌头生物碱,特别是双酯型生物碱在高温下不稳定,容易水解成单酯型生物碱,常用的回流提取法提取到的双酯型生物碱含有量极低,故本实验采用95% 的乙醇冷浸,低温 (<30 ℃)浓缩干燥,提高了生物碱的稳定性。
以上研究证实,制川乌白芍配伍对单酯型生物碱和双酯型生物碱的经皮吸收存在明显差异,这种差异可能与制川乌中酯型生物碱与芍药苷之间结合形成的“离子对”(ion pair,IP)有关。在中药成分之间形成“离子对”,已有文献报道,如乌头碱和甘草酸可以形成“离子对”而增加生物碱的脂溶性[11],黄芩苷-血根碱也可以形成离子对化合物[12],在研究“离子对”对脂溶性有机酸酮洛芬对经皮渗透的影响时发现,有机胺(乙醇胺、二乙醇胺、二乙胺、三乙胺、三乙醇胺、N- (2-羟乙基)哌啶对酮洛芬有经皮促进作用[13]。故本实验基于以上实验现象,推测芍药苷与制川乌生物碱也可能形成“离子对”而促进相关成分的吸收,但有待实验进一步证实。
制川乌中主要含有6 种酯型乌头生物碱,双酯型乌头碱新乌头碱、次乌头碱、乌头碱有大毒,使用不当易引起中毒,炮制后,双醋型生物碱水解后,转化成单酯型乌头碱,毒性大大降低,而仍能发挥疗效[14]。本实验结果表明,制川乌白芍配伍后促进了制川乌中单酯型生物碱苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的经皮吸收。本研究从经皮转运的角度阐释了制川乌白芍配伍“增效”的可能配伍机理。
[1] Wu H,Wei W,Song L,et al. Paeoniflorin induced immune tolerance of mesenteric lymph node lymphocytes via enhancing beta 2-adrenergic receptor desensitization in rats with adjuvant arthritis[J]. Int Immunopharmacol,2007,7(5):662-673.
[2] 李晋奇,彭 成. 制川乌配伍白芍的增效作用及其作用机理[J]. 华西药学杂志,2007,22(2):144-148.
[3] 何 伟,王 宁,秦 林,等. 川乌与白芍配伍前后乌头碱和芍药苷煎出量的测定[J]. 中国药学杂志,2002,37(9):40-43.
[4] 杨 桦,邓晓静,易 红. 大孔吸附树脂用于川草乌中总生物碱的分离提取[J]. 中成药,2000,22(8):7-10.
[5] 涂瑶生,全智慧,孙冬梅,等. 近红外光谱法快速测定制川乌提取浓缩过程中单酯型生物碱[J]. 中草药,2013,44(7):839-844.
[6] 张 言. 乌头汤抗炎的药效物质基础与提取工艺研究[D].广州:广州中医药大学,2013.
[7] 邓广海,林 华,龚又明. 草乌及其炮制品中6 种生物碱类成分的含量测定[J]. 中国实验方剂学杂志,2013,19(7):35-38.
[8] 刘 敏,张 海,蔡亚梅,等. 附子总生物碱提取物中3 个双酯型和3 个单酯型乌头碱成分的含量测定[J]. 药学实践杂志,2013,31(3):181-184.
[9] 赵翡翠,姜 林,刘淑敏,等. 新疆乌头属植物中双酯型生物碱的含量测定[J]. 中国医院药学杂志,2012,32(20):1603-1606.
[10] 黄志芳,易进海,陈东安,等. 制川乌HPLC 特征图谱研究和6 种酯型生物碱的含量测定[J]. 药物分析杂志,2011,31(2):217-221.
[11] 徐 丽,曾建国,程 辟,等. 血根碱-黄芩苷、白屈菜红碱-黄芩苷离子对化合物体外抗菌活性和急性毒性研究[J]. 中南药学,2012,10(1):10-13.
[12] 苏孝礼,刘成基,胡衔军. 乌头碱和甘草酸相互作用的研究[J]. 中国中药杂志,1993,18(12):726-728.
[13] 牛喜草,赵利刚,蒋宇轩,等. 乙醇-肉豆蔻酸异丙酯系统中有机胺对酮洛芬经皮渗透的促进作用[J]. 沈阳药科大学学报,2008,25(11):860-865.
[14] 于永军,李俊松,蔡 晧,等. 川乌炮制前后高效液相色谱指纹图谱比较研究[J]. 中华中医药学刊,2009,27(11):2456-2458.
