参地颗粒对慢性肾炎脾肾亏虚证患者NF-κB 信号通路的干预作用
2015-01-13王亿平朋红霞刘家生任克军王立媛
王亿平, 朋红霞, 王 东, 金 华, 刘家生, 任克军, 魏 玲, 王立媛
(安徽中医药大学第一附属医院,安徽 合肥230031)
慢性肾炎 (chronic glomerulonephritis,CGN)在我国引起终末期肾病仍居病因之首,蛋白尿是其病情进展的独立危险因素,积极减少蛋白尿可阻止或延缓CGN 的病程进展[1-2]。CGN 的发病机制与免疫炎症因素和非免疫非炎症因素都有密切关系,一般认为免疫炎症因素为起始因素。研究表明[3]NF-κB 在很多肾小球疾病中起关键作用,特别是免疫介导的肾小球疾病。氧化应激能够介导NF-κB信号活化[4],启动免疫炎症反应,导致肾脏损害。本研究检测CGN 脾肾亏虚证患者血清活性氧(ROS)、超氧化物歧化酶 (SOD)、丙二醛(MDA)水平和核因子-κB p65 (NF-κB p65)、单核细胞趋化蛋白-1 (MCP-1)、纤维连接蛋白(FN)的含有量,并观察参地颗粒的干预作用。
1 材料与方法
1.1 病例选择标准
1.1.1 西医诊断标准 参照陆再英,钟南山主编的第7 版内科学的诊断标准[5]。
1.1.2 中医辨证标准 参照《中药新药治疗慢性肾炎临床研究指导原则》[6]制定。主症:神疲乏力,腰背酸痛,纳差,水肿,胃脘部不适;次症:大便溏薄,小便频数,夜尿增多,舌淡有齿痕,脉沉细。具备主症3 项,或主症2 项、次症2 项以上者,即可诊断。
1.1.3 中医症状量化评分标准 参照《中药新药治疗慢性肾炎临床研究指导原则》[6]制定,按轻、中、重度,分别计2、4、6 分。
1.1.4 病例纳入标准 ①符合CGN 西医诊断标准和中医辨证标准;②肾小球滤过率>60 mL/min;③24 h 尿蛋白定量在3 g 以下;④年龄在18 岁以上,65 岁以下;⑤自愿参加本试验,并在知情同意书上签字。
1.1.5 病例排除标准 ①不符合病例纳入标准;②不按规定服药或口服糖皮质激素等药物,影响疗效判定;③妊娠或哺乳期的妇女;④有严重肝、心、脑等疾病,影响疗效判定者。
1.2 研究对象及分组 选取我科2012 年6 月~2013 年6 月符合纳入标准的50 例住院患者,按其入院先后顺序随机分为治疗组25 例和对照组25例,治疗过程中治疗组失访3 例,对照组失访1例,最终完成46 例。治疗组22 例中男10 例,女12 例,年龄22 ~59 岁,病程3 个月~7 年,合并血压升高13 例。对照组24 例中男14 例,女10例,年龄19 ~62 岁,病程6 个月~8 年,合并血压升高15 例。两组患者性别、年龄、病程等比较无统计学差异(P >0.05),具有可比性。另选取20 例同期来我院体检正常者作为正常组。
1.3 治疗方法 治疗组口服参地颗粒(院内制剂,安徽中医药大学第一附属医院研制,皖药制字BZ20080025),每次1 袋(10 g),每日3 次,温水冲服。对照组服用贝那普利片(北京诺华制药有限公司生产,国药准字H20030514),每次10 mg,每日1 次,疗程均为12 周。
1.4 观察指标 治疗前后患者中医证候积分值的变化,24 h 尿蛋白定量及血清ROS、SOD、MDA、NF-κB p65、MCP-1、FN 水平变化,并与正常组比较。采用酶联免疫吸附(ELISA)法,主要试剂ROS、SOD、MDA、NF-κB p65 及FN 均来源于上海源叶生物技术有限公司,批号分别为H34376、H32667、H10256、H32538、H30145;MCP-1 来源于上海科兴生物科技有限公司,批号为Kx10136。
1.5 疗效判定标准 依据《中药新药治疗慢性肾炎临床研究指导原则》制定[6]。临床疗效分临床控制、显效、有效和无效。中医证候疗效分临床痊愈、显效、有效和无效。
1.6 统计学处理 采用SPSS 17.0 统计软件进行数据处理。计量资料用均数±标准差(±s)表示,采用t 检验和单因素方差分析,等级资料采用Ridit 分析,P <0.05 为有统计学差异。
2 结果
2.1 两组患者临床疾病疗效比较 治疗组临床疾病总有效率为81.82%,高于对照组66.67%,两组有统计学差异(P <0.05)。见表1。
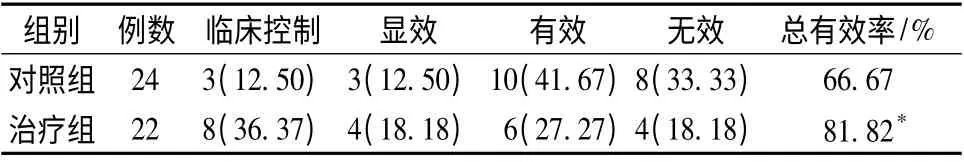
表1 两组患者临床疗效比较[例(%)]Tab.1 Comparison of clinical efficiency between two groups [n (%)]
2.2 两组患者中医证候疗效比较 治疗组中医证候总有效率77.27%,高于对照组37.50%,两组有统计学差异(P <0.01)。见表2。
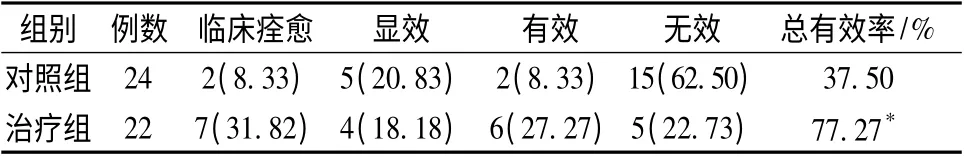
表2 两组患者中医证候疗效比较[例(%)]Tab.2 Comparison between two groups on clinical efficiency according to traditional Chinese medicine standards[n (%)]
2.3 两组患者治疗前后24 h 尿蛋白定量比较 与治疗前相比,两组24 h 尿蛋白定量治疗8 周后显著降低,12 周后降低更为显著,优于对照组(P <0.05)。见表3。
表3 两组患者治疗前后24 h 尿蛋白定量比较(±s,g/24 h)Tab.3 Quantitative comparison between two groups on 24 h urinary protein before and after treatment (±s,g/24 h)
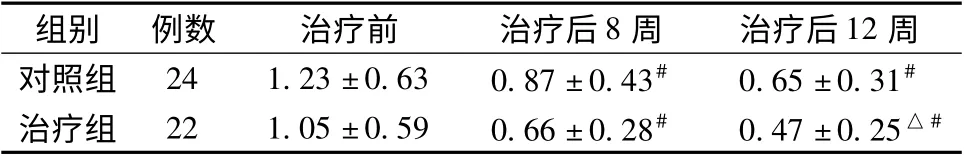
表3 两组患者治疗前后24 h 尿蛋白定量比较(±s,g/24 h)Tab.3 Quantitative comparison between two groups on 24 h urinary protein before and after treatment (±s,g/24 h)
注:与同期对照组比较,△P <0.05;与本组治疗前比较,#P <0.05
组别 例数 治疗前 治疗后8 周 治疗后12周对照组 24 1.23 ±0.63 0.87 ±0.43# 0.65 ±0.31#治疗组 22 1.05 ±0.59 0.66 ±0.28# 0.47 ±0.25△#
2.4 各组患者治疗前后血清ROS、SOD、MDA 水平比较 两组患者治疗前血清ROS、MDA 水平均高于正常组,血清SOD 水平低于正常组(P <0.05),治疗后两组血清ROS、MDA 水平均较治疗前降低,而血清SOD 水平均较治疗前升高(P <0.05),治疗组优于对照组(P <0.05)。见表4。
表4 各组患者治疗前后血清ROS、SOD、MDA 水平变化(±s)Tab.4 Changes in levels of ROS,SOD and MDA before and after treatment(±s)
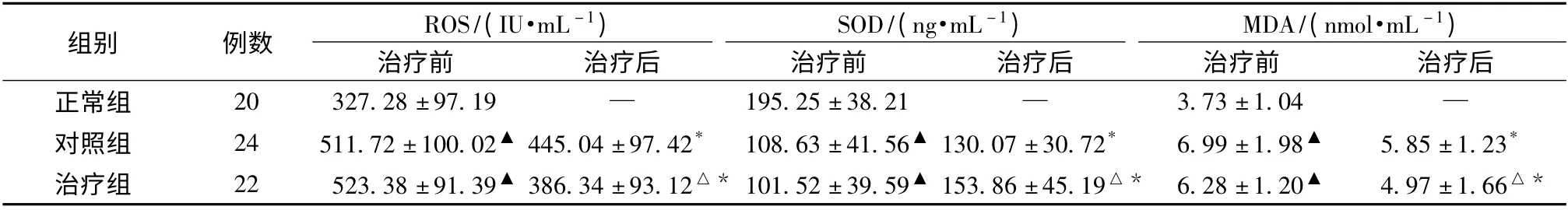
表4 各组患者治疗前后血清ROS、SOD、MDA 水平变化(±s)Tab.4 Changes in levels of ROS,SOD and MDA before and after treatment(±s)
注:与正常组比较,▲P <0.05;与同期对照组比较,△P <0.05;与本组治疗前比较,* P <0.05
组别 例数 ROS/(IU·mL -1)SOD/(ng·mL -1)MDA/(nmol·mL -1)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后正常组 20 327.28 ±97.19 — 195.25 ±38.21 — 3.73 ±1.04—对照组 24 511.72 ±100.02▲445.04 ±97.42* 108.63 ±41.56▲130.07 ±30.72* 6.99 ±1.98▲ 5.85 ±1.23*治疗组 22 523.38 ±91.39▲386.34 ±93.12△* 101.52 ±39.59▲153.86 ±45.19△* 6.28 ±1.20▲ 4.97 ±1.66△*
2.5 各组患者治疗前后血清NF-κB p65、MCP-1、FN 水平比较 治疗组和对照组患者治疗前血清NF-κB p65、MCP-1 水平均高于正常组,而血清FN水平低于正常组(P <0.05)。治疗后两组血清NF-κB p65、MCP-1 水平均较治疗前降低,而血清FN 水平均较治疗前升高(P <0.05),治疗组优于对照组(P <0.05)。见表5。
表5 各组患者治疗前后血清NF-κB p65、MCP-1、FN 水平变化(±s)Tab.5 Changes in levels of NF-κB p65,MCP-1 and FN before and after treatment (±s)
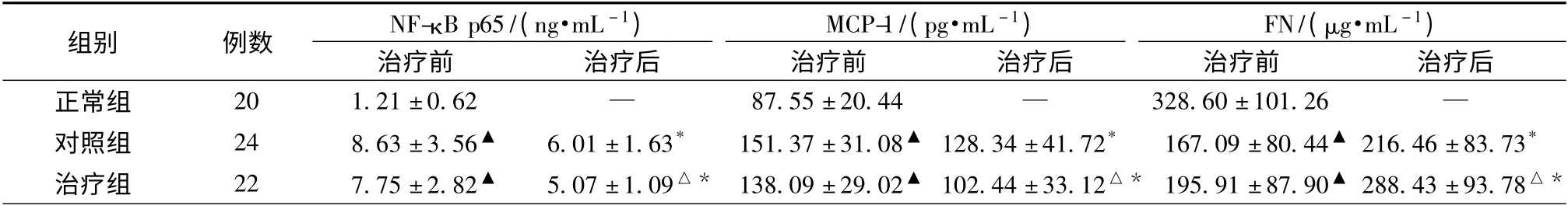
表5 各组患者治疗前后血清NF-κB p65、MCP-1、FN 水平变化(±s)Tab.5 Changes in levels of NF-κB p65,MCP-1 and FN before and after treatment (±s)
注:与正常组比较,▲P <0.05;与同期对照组比较,△P <0.05;与本组治疗前比较,* P <0.05
组别 例数 NF-κB p65/(ng·mL -1)MCP-1/(pg·mL -1)FN/(μg·mL -1)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后正常组 20 1.21 ±0.62 — 87.55 ±20.44 — 328.60 ±101.26—对照组 24 8.63 ±3.56▲ 6.01 ±1.63* 151.37 ±31.08▲ 128.34 ±41.72* 167.09 ±80.44▲216.46 ±83.73*治疗组 22 7.75 ±2.82▲ 5.07 ±1.09△* 138.09 ±29.02▲ 102.44 ±33.12△* 195.91 ±87.90▲288.43 ±93.78△*
3 讨论
CGN 的病变部位主要在脾肾两脏,基本病机为脾肾亏虚、精微下注。 《素问》中“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺,通调水道,下输膀胱,水精四布,五经并行”、“肾者,封藏之本,精之处也”,概括了脾肾两脏的功能:脾气散精,灌注全身,肾主藏精,使体内的精微物质正常分布与代谢。当脾肾两脏虚损时,则会发生精微物质的分布、代谢异常,蛋白质和血液均为人体精微物质,脾虚不能统摄血液,血不循经则外泄,肾虚封藏功能失职,则精微下泄,而成蛋白尿和血尿。反过来蛋白质、血液遗泄日久,又可造成脾肾亏虚更甚,如此形成恶性循环。且血不循经,离经之血形成瘀血,参与疾病的发生发展。脾肾为先后天之本,两者相互为用,相互依存,故治疗CGN 脾肾亏虚证,应以补益脾肾为主,兼能固摄精微。前期研究[7-9]表明参地颗粒治疗CGN 脾肾亏虚证患者,取得良好的临床疗效。参地颗粒以人参为君药,大补元气、固摄精微;茯苓、熟地为臣药,健脾益肾;佐以五味子、桑螵蛸,以加强固摄精微之力;病久必夹瘀,故使以川芎活血化瘀。诸药合用,共凑健脾益肾、固摄精微之功。
氧化应激造成肾脏损伤的过程包括以下两个方面:一方面,ROS 对肾脏有直接损伤作用,主要是ROS 使脂质、蛋白质和核酸等细胞分子过氧化,从而使细胞的结构和功能遭到破坏[10]。另一方面,也是更重要的,ROS 还可促进细胞内信号传导(如NF-κB、TGF-β1/Smads、P38MAPK、JNK/SAPK 等通路[11]),通过ROS 对转录因子的活化引起免疫炎症细胞黏附、聚积,促进疾病的发展。在以上几个信号通路中,目前比较认可的是NF-κB 信号通路[12]。NF-κB 调控多种下游细胞因子和趋化因子(如TNF-α,IL-1β,IL-6,IL-8 和MCP-1 等)及黏附分子(如VCAM-1 和ICAM-1)的表达,这些因子在免疫炎症反应中起调控作用,参与免疫和炎症细胞的趋化、浸润、增殖、分化等,同时,这些因子又可以反过来刺激NF-κB 的活化,这种正反馈效应导致炎症反应信号不断放大,从而加重组织损伤[13]。MCP-1 属于趋化因子家族中C-C 亚家族,单核细胞、巨噬细胞、内皮细胞、成纤维细胞、肾小球系膜细胞等都可表达MCP-1,在肾脏主要是由肾小管上皮细胞和肾小球系膜细胞产生,MCP-1 调控单核巨噬细胞的迁移和浸润,募集至炎症部位,参与炎症的发生,单核巨噬细胞浸润及其引起的炎症反应在各种肾脏疾病过程中都有参与[14]。纤维连接蛋白(FN)是一种高分子非胶原糖蛋白,在肾脏主要是系膜细胞外基质的主要成分。研究表明FN 是在损伤组织中最早出现的基质蛋白成分[15],在炎症或免疫损伤过程中,FN 生成增多,导致细胞外基质在肾脏局部堆积,过度聚积的细胞外基质。因此,FN 的表达程度可反应细胞外基质聚积的程度。
本研究结果显示,CGN 脾肾亏虚证患者血清ROS、MDA 水平和NF-κB p65、MCP-1 水平高于正常组,血清SOD 活力和FN 水平低于正常组(P <0.05),说明氧化应激介导NF-κB 信号活化,产生炎症介质MCP-1,参与了CGN 脾肾亏虚证的发生发展。参地颗粒能改善患者临床症状,降低24 h尿蛋白定量,其机理与通过抑制CGN 脾肾亏虚证患者的氧化应激,增强机体的抗氧化能力,抑制NF-κB 信号活化,下调MCP-1 表达有关。
[1] 丁世永,郑平东,何立群,等. 小柴胡汤改善慢性肾小球肾炎患者炎症及减轻蛋白尿的作用研究[J]. 中国中西医结合杂志,2013,33(1):21-26.
[2] Qiu H,Fu P,Fan W,et al. Treatment of primary chronic glomerulonephritis with Rehmannia glutinosa acteosides in combination with the Angiotensin receptor blocker irbesartan:a randomized controlled trial[J]. Phytother Res,2014,28(1):132-136.
[3] Danilewicz M,Wagrowska-Danilewicz M. The immunoexpression of glomerular NF-κB in proteinuric patients with proliferative and non-proliferative glomerulopathies[J]. Pol J Pathol,2013,64(2):78-83.
[4] Huang W,Xu L,Zhou X,et al. High glucose induces activation of NF-κB inflammatory signaling through IκBa sumoylation in rat mesangial cells[J]. Biochem Biophys Res Commun,2013,438(3):568-574.
[5] 陆再英,钟南山. 内科学[M]. 7 版. 北京:人民卫生出版社,2007:508-511.
[6] 郑筱萸. 中药新药临床研究指导原则(试行)[M]. 北京:中国医药科技出版社,2002:157-160.
[7] 茅燕萍,王亿平,牛 婧,等. 参地颗粒对慢性肾炎脾肾亏虚证患者血清肝细胞生长因子和转化生长因子-β1的影响[J]. 新中医,2012,5(44):46-48.
[8] 王亿平,史良平,王 东,等. 参地颗粒治疗慢性肾炎脾肾亏虚证临床研究[J]. 安徽中医学院学报,2011,4(30):17-20.
[9] 王亿平,王 东,吕 勇,等. 人参汤治疗慢性肾炎脾肾亏虚证临床研究[J]. 新中医,2008,40(12):38-39.
[10] Toyokuni S,Tanaka T,Kawaguchi W,et al. Effects of the phenolic contents of Mauritian endemic plant extracts on promoter activities of antioxidant enzymes[J]. Free Radic Res,2003,37(11):1215-1224.
[11] Wardle E N. Cellular oxidative processes in relation to renal disease[J]. Am J Nephrol,2005,25(1):13-22.
[12] Bhatt S R,Lokhandwala M F,Banday A A. Vascular oxidative stress upregulates angiotensin II type I receptors via mechanisms involving nuclear factor kappa B[J]. Clin Exp Hypertens,2014,36(6):367-373.
[13] Brasier A R. The NF-kappa B regulatory network[J]. Cardiovasc Toxicol,2006,6(2):111-130.
[14] Chen P,Shi Q,Xu X,et al. Quercetin suppresses NF-κB and MCP-1 expression in a high glucose-induced human mesangial cell proliferation model[J]. Int J Mol Med,2012,30(1):119-125.
[15] Pavan M V,Ghini B,Castro M,et al. Prevention of hypertension attenuates albuminuria and renal expression of fibronectin in diabetic spontaneously hypertensive rats[J]. Am J Nephrol,2003,23(6):422-428.
