直肠及左半结肠癌中枢方向高站别淋巴结微转移的研究
2015-01-08黄毅捷王天翔袁建明胡世雄黄炽明
黄毅捷 王天翔 袁建明 彭 林 胡世雄 赵 刚 黄炽明
(1广东省人民医院普外二区,广东广州510080;2上海交通大学医学院附属瑞金医院卢湾分院外科,上海200020)
结直肠癌是欧美国家最常见的恶性肿瘤,位居全球恶性肿瘤死因第三位,全球每年新增病例94万,每年致死约50万人。随着饮食方式的逐渐西化,我国结直肠癌发病率及死亡率呈逐年增长趋势。淋巴结转移是其最主要的转移途径,因局部解剖条件不同,结肠癌与直肠癌、不同部位直肠癌的淋巴回流方式迥异,但中枢方向转移为其主要途径却是其共性。N4站淋巴结转移一直以来被视为远处转移,无清扫意义。清扫N3站淋巴结对于直肠癌是否有意义长期以来则一直存在争议,常规术后病理检测对这种争论始终没能给出一个令人满意的答案。本研究针对有相同中枢方向淋巴回流的直肠及左半结肠癌的肿瘤淋巴结转移及微转移状况进行探讨,以期论证中枢方向D3术式的必要性。
1 资料与方法
1.1 一般资料
收集上海交通大学医学院附属瑞金医院卢湾分院2007-2008年收治的结肠脾曲远端结直肠癌患者39例作为研究对象。前瞻性地于根部结扎切断肠系膜下动脉(inferior mesenteric artery,IMA),清扫中枢方向第三站淋巴结,并手工区分:肠旁淋巴结(N1);直肠上动脉、乙状结肠动脉、左结肠动脉周围淋巴结(N2);IMA周围及根部淋巴结(N3);并将N2、N3组并称为高站别淋巴结。
统计常规病理淋巴结转移、CK20为靶点的淋巴结微转移状况并分析与下列因素的关系:性别、年龄、有无结直肠癌家族史、术前有无合并结直肠息肉或腺瘤、有无合并胆囊结石、术前血清CEA水平、术前血清CA50水平、血型、肿瘤发生部位、肿瘤病理类型、肿瘤最大直径、局部浸润深度、局部浸润表观状况、肿瘤大体类型、有无合并肿瘤旁脉管瘤栓、有无合并原发灶外癌结节;17、肿瘤原发灶 Ki-67、Dukes分期、新分期、预后。术后随访至2010年8月,以生存与死亡作为界定。
1.2 方法
免疫组化染色:所有淋巴结标本经中性福尔马林固定,常规石蜡包埋,并连续切片4张,片厚4 μm。将所选切片脱蜡、水化后以CK20为靶点进行免疫组化染色,用大肠癌组织作为阳性对照,以磷酸盐缓冲溶液代替一抗作阴性对照,依据淋巴结内是否有胞核呈紫蓝色,胞质呈棕黄色的肿瘤细胞判断是否存在淋巴结微转移。
免疫组化染色采用LSAB法,CK20一抗购自美国Neomarkers公司,二抗及染色试剂盒购自美国Zymed公司。每次染色均以PBS代替一抗作阴性对照;大肠癌组织作为阳性对照。若光镜下细胞,胞质染为棕黄色,胞核染为紫蓝色为CK20显色阳性;胞质及胞核均为紫蓝色细胞为阴性。由于淋巴结内无CK20染色阳性细胞,而90%以上结直肠癌细胞CK20染色阳性,因此判断淋巴结内出现胞质棕黄,胞核紫蓝色细胞即为非正常细胞,光镜下呈现为:单个散在或数个成簇分布,直径≤2 mm的CK20表达阳性细胞即定义为微转移细胞。
1.3 统计学分析
应用SPSS 15.0统计软件进行分析,计数资料比较采用卡方(χ2)检验;计量资料用非参数秩和检验;采用 Kaplan-Meier检验进行生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 病理结果
本次入组的39例结肠脾曲远端结直肠癌患者中,男 22例,女 17例;年龄26~87岁,平均年龄(61.0±2.3)岁;均为术前肠镜病理确诊癌肿,肿瘤最大直径1~8 cm,平均3.9 cm;中分化腺癌31例、低分化腺癌6例、黏液腺癌1例、印戒细胞癌1例;14例为缩窄型、25例为非缩窄型;7例浸润肠腔1/3周、10例浸润肠腔>1/3周但<2/3周、22例浸润肠腔>2/3周;26例未侵及浆膜外组织、13例侵及浆膜外组织;术前合并CEA升高者10例、CA50升高者13例;术前合并结直肠腺瘤者7例、胆囊结石者8例、便秘者26例;直肠癌家族史者10例;血型分布:O型16例、A型8例、B型12例、AB型3例。依据Dukes病理分期:A期5例、B期11例、C1期11例、C2期12例。肿瘤旁脉管存在癌栓者17例。存在原发灶外癌结节者11例。原发灶标本其他免疫组化结果:Ki-67≤60%者27例、>60%者 12例;bcl-2均“-”;nm23“-”15 例,“+”24 例;P53“-”2 例、“+”20例、“++”17例;pS2“-”10例、“+”20例、“++”9例;TopoⅡ“-”7例、“+”20例、“++”12例。
均于根部结扎切断IMA,清扫N3站淋巴结,分站别解剖区分N1、N2、N3站淋巴结,并由专一病理科医师行HE染色阅片,所有标本经CK20免疫组化染色后,再由专人阅片鉴定。苏木精-伊红(hematoxylineosin,HE)染色;细胞角蛋白 20(cytokeratin-20,CK20)免疫组化染色淋巴观察结微转移;N2及N3站淋巴结转移与微转移。
2.2 阳性淋巴结检出状况
2.2.1 依淋巴结个数的转移率分析 ①淋巴结转移率:总体:15.40%(91/591)、N1 站:20.41%(60/294)、N2站:10.18%(17/167)、N3站:10.77%(14/130)、Dukes C2期患者高站别淋巴结中N3转移率45.16%(14/31)。②淋巴结微转移率:总体:25.55%(151/591)、N1站:34.69%(102/294)、N2站:17.37%(29/167)、N3站:15.38%(20/130)、Dukes C2期患者中高站别淋巴结N3微转移率40.82%(20/49)。
2.2.2 依阳性病例数的转移度分析 ①淋巴结转移度:总体:58.97%(23/39)、N1 站:48.72%(19/39)、N2站:28.21%(11/39)、N3 站:10.26%(4/39)、Dukes C2期患者中N3转移度36.36%(4/11)。②淋巴结微转移度:总体:61.54%(24/39)、N1 站:61.54%(24/39)、N2站:38.46%(15/39)、N3站:17.95%(7/39)、Dukes C2期患者中N3微转移度63.64%(7/11)。
常规病理检出率为0.161 5±0.226 1;微转移检出率为0.259 3±0.288 7,两者比较,差异有统计学意义(Z=-3.725,P=0.000)。常规 HE 染色病理淋巴结转移阳性标本CK20免疫组化染色均呈阳性表现。见图1。

图1 CK20免疫组化检测结直肠癌淋巴结微转移显示阳性细胞数个成团位于边缘,直径<2 mm,常规病理不易发现(Envision,×200)
2.3 高站别淋巴结微转移单因素分析
有结直肠癌家族史的10例患者中4例出现了N3站淋巴结微转移,而无结直肠癌家族史的29例患者中仅3例出现了N3站淋巴结微转移,两者比较差异有统计学意义(χ2=4.326,P=0.038)。此外,癌结节、Dukes分期、新分欺期、局部浸润、预后等均与高站别淋巴微转移相关(P<0.05),见表1。

表1 高站别淋巴结微转移单因素分析(例)
2.4 预后单因素分析
如表2,3所示,高站别淋巴结微转移、癌结节CA50,浸润深度是影响患者预后的因素(P<0.05);而高站别淋巴结微转移与预后无关(P<0.05)。

表2 预后单因素分析(例)
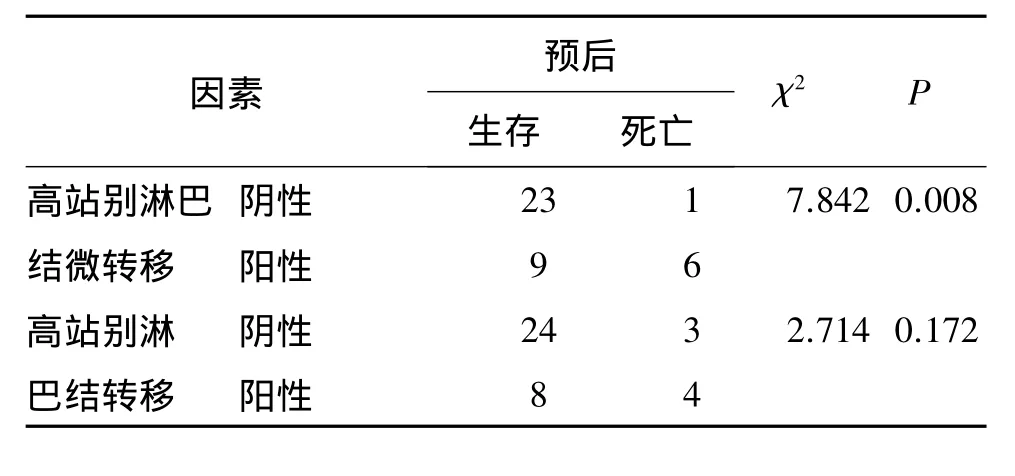
表3 预后与高站别淋巴结转移及高站别淋巴结微转移比较分析(例)
利用Kaplan-Meier检验进行CK20免疫组化染色高站别淋巴结微转生存分析,结果显示:患者均于术后随访至2010年8月,随访时间均超过30个月,死亡7例,死亡原因均系肿瘤因素,包括印戒细胞癌及黏液腺癌病例。高站别淋巴结微转移阴性组中位生存时间(33.7±0.3)个月,阳性组中位生存时间(18.6±1.7)个月。见图2。

图2 N2+N3微转移阳性阴性患者生存曲线
3 讨论
解剖学角度上结肠脾曲远端结直肠中枢方向淋巴回流途径为:肠壁内淋巴结—肠旁淋巴结(N1)—直肠上动脉、乙状结肠动脉、左结肠动脉周围淋巴结(N2)—IMA周围及根部淋巴结(N3)—腹主动脉周围淋巴结(N4)。
N4站淋巴结转移一直以来被视为远处转移,无清扫意义。清扫N3站淋巴结尤其对于直肠癌是否有意义长期以来则一直存在争议:曹志新等[1]研究499例直肠癌手术清扫IMA根部淋巴结(N3)病例,发现转移率为14.4%。Hida等[2]回顾性分析198例直肠癌,其 IMA根部淋巴结转移率为 8.6%。Slanetz等[3]发现IMA根部3 cm内有淋巴结转移明显影响患者生存率,Kanemitsu等[4]认为清扫这些淋巴结能明显改善术后5年生存率并降低复发率。然而也有许多学者认为该组淋巴结转移率低,临床清扫无意义,因此,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)及美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)指南并未强调直肠癌根治性切除术中于IMA根部结扎并清扫局部淋巴结。常规术后病理检测是乎对这种争论始终没能给出一个令人满意的答案。
值得指出的是,即便在接受了根治性手术的患者中仍有40%~50%死于术后肿瘤复发与转移[5];传统理念上HE染色病理检查未发现有淋巴结转移的Dukes A和Dukes B期患者中仍有10%~25%于术后5年内出现复发[6],这就提示了一部分潜在性肿瘤是常规手段不易发现的“微转移”。随着分子生物学、免疫学及相关实验技术的发展,这部分“微转移肿瘤”的检出逐渐成为可能。
1868年Asworth首次在外周血中发现肿瘤细胞以来,肿瘤微转移的概念在实践中逐步建立并引起重视。1971年由Huvos等在乳腺癌中首次正式提出“肿瘤微转移”的概念,其标准是直径≤2 mm的肿瘤转移灶。随着人们对肿瘤认识的进展,这一概念逐渐被标化为“非血液系统的恶性肿瘤在发展过程中播撒并存活于淋巴系统、血循环、骨髓、肝、肺等组织中的微小肿瘤细胞病灶,它可以是单个瘤细胞或独立的瘤细胞灶,无特殊血供,直径<2 mm,常无任何临床表现,具有逃脱免疫检视、侵犯血管和发展成为肉眼可见病变的能力,常规方法均很难发现其存在”。外周组织中淋巴结微转移是指通过常规组织学水平淋巴结切片的一个切面不能发现或很难发现的<2 mm的瘤转移灶或单个转移瘤细胞[7]。
细胞角蛋白是分布于外胚层起源细胞的中间纤维丝,为细胞骨架的组分之一,已知成员有20个。CK20是由 Moll等[8]于 1990年首次发现的,CK20属酸性细胞角蛋白,含有424个氨基酸残基,相对分子量48 553,尿素等电点为5.66,从人噬菌体基因文库中调出的CK20编码DNA总长度18Kb,含有8个外显子,7个内涵子。CK20与其他细胞角蛋白一样都由中间的螺旋结构及N端和C端组成,中间螺旋结构由10~350个氨基酸残基组成,但CK20不同于其他细胞角蛋白家族成员那样中间螺旋具有相对高度同源性,其中间螺旋的杆状部分与其它角蛋白仅具有58%同源性,其单克隆抗体与其它角蛋白无交叉反应性。CK20合成首先出现于第八周胚胎的黏膜上皮中,之后广泛分布于杯状细胞和绒毛细胞中。不同于其他细胞角蛋白,CK20具有更为严格的上皮细胞特异性,非上皮源性组织或细胞如血液、骨髓、淋巴组织中不表达CK20。正常组织中CK20见于肠黏膜细胞、胃黏膜细胞、幽门腺体细胞、十二指肠黏膜细胞、泌尿移行上皮细胞、表皮Merkel细胞、舌味蕾细胞[9]。CK20的表达在细胞发生化生、恶变、肿瘤转移、体外培养等改变时持续表达阳性,这些特点令其成为良好的肿瘤标志物,同时也可用于鉴别肿瘤细胞的组织来源。超过90%的结直肠癌表达CK20,表现为弥漫胞质膜型[10]。虽然有部分研究表明肠癌淋巴结转移灶中CK20的表达有低于原发灶的趋势[11],但目前中外学者中主流观点仍然十分肯定CK20在肿瘤微转移中的价值。Illert等[12]。的研究表明CK20的表达是一个独立的预后指标依据这种特性得以以CK20作为靶位检测淋巴结微转移指导临床诊疗。
3.1 CK20免疫组化敏感性及可行性
CK20免疫组化染色淋巴结微转移检出率明显高于常规病理淋巴结转移检出率;另外本组所有常规HE染色病理淋巴结转移阳性标本CK20免疫组化染色均呈阳性表现,进一步证实了免疫组化检测的敏感性。
CK20免疫组化染色简单易行、敏感性高、结果准确可信、监测费用低廉,有良好的临床运用价值。
3.2 高站别淋巴结微转移
赵旗等[13]分析80例DukesB期结肠直肠癌患者的580枚淋巴结,发现淋巴结微转移强度与肿瘤侵犯肠管周径呈正相关,本组实验进一步发现肿瘤局部浸润肠腔>1/3周、合并原发灶外癌结节、Dukes分期期别越高的患者易于出现高站别淋巴结微转移;发生常规HE染色病理高站别淋巴结转移者更易于发生高站别淋巴结微转移。出现高站别淋巴结微转移病例随访过程中2年生存率明显低于阴性组,考虑到本组随访时间未达5年,进一步延长随访时间将有望提高数据的可信度。
以性别差异、年龄差异、有否结直肠癌家族史、有无合并结直肠息肉或腺瘤、有无合并胆囊结石、血型差异、肿瘤病理分化差异、肿瘤发生部位差异、肿瘤最大直径差异、局部浸润深度差异、肿瘤大体类型差异、肿瘤原发灶 Ki-67、bcl-2、nm23、P53、TopoII表达状况差异比较患者淋巴结微转移总体及各站别转移率,差别无统计学意义。但印戒细胞癌及黏液腺癌病例均出现了高站别淋巴结微转移,并且随访发现死于肿瘤复发转移,考虑可能与该型肿瘤样本量少相关,扩大样本可能作出更为准确的推断。
分析N3站常规HE染色淋巴结阳性检出率及N3站CK20免疫组化染色淋巴结微转移阳性检出率,结果显示,>10%的该站淋巴结呈阳性检出表现。这与董新舒等[14]的研究结果相符。而特别针对Dukes C2期的患者,有1/3以上的高站别淋巴结出现了N3站淋巴结肿瘤微转移,60%以上患者合并N3站淋巴结微转移。所以中枢方向D3术式对于高度怀疑DukesC2期的患者有显著的临床意义,值得清扫。另外,有结直肠癌家族史的患者易于出现N3站淋巴结微转移,对于这类患者,我们也推荐进行上述术式治疗。
3.3 关于预后的论述
合并高站别淋巴结微转移、合并原发灶外癌结节、术前CA50升高、肿瘤侵及浆膜外组织的患者预后不良。
Clarke等[15]检查了100例施行了根治性手术的结直肠癌患者,发现有复发者淋巴结微转移率要高于无复发者(56%VS.11%,P<0.05),而且淋巴结微转移在单因素及多因素Cox回归分析中均与生存相关。但Noura等[16]检测了98例结直肠癌患者的878枚淋巴结,却得出了完全相反的结论;考虑到本组随访时间不足5年,期望延长随访时间能作出更为准确的推断。
CK20免疫组化染色高站别淋巴结微转移对患者预后判断有独立意义,而常规HE染色病理高站别淋巴结转移对患者预后判断意义较小,这可能和常规病理高站别淋巴结转移病例数量较少及随访时间不足5年相关,进一步的推断需要进一步扩大样本量和延长随访时间来完成。
结直肠癌淋巴清扫术式的合理化研究一直是外科医师争论的热点,尤其集中于中枢方向清扫第三站淋巴结是否具有肯定的临床价值,常规HE染色病理检查未能给出一个为诸派学者均较为认同的答案。现代医学注重肿瘤手术治疗的根治性效果,也同样注重减小手术创伤及保留脏器功能,以期在根治性与生存质量间找到平衡点。运用微转移相关检测技术检测这一特殊的肿瘤生物学行为,作为指导临床淋巴结清扫范围的参考依据不啻为一个良好的选择。
微转移的转归取决于癌细胞的生物学特性、机体的免疫状态及宿主细胞的微环境。动物实验表明,血循环中至少有10 000个肿瘤细胞才可形成显性转移,其中多数凋亡,少数处于浸润休眠期,仅极少数发生增殖。微转移的肿瘤细胞可长期处于G0期,其增殖与凋亡处于平衡状态,只有当机体遭受各种打击或免疫状态下降时休眠中的肿瘤细胞才得以摆脱抑制状态,进而持续增殖并发展成为临床显性转移。
微转移是一个状态或阶段,是否转化为对机体造成实质性打击的转移性病变还是未知数。机体与肿瘤病灶间是否有更精确的细胞量的平衡,而不仅仅是常规检测手段无法发现的病变。考虑到这一点,对于微转移更精确也更具临床意义的定义应为“常规检查手段无法发现,但实质上必然形成显性转移并具有原发瘤特性的转移灶”,而不确定能否形成有生存能力的转移灶的“微转移”则可划分为“亚微转移”。
综上所述,CK20免疫组化淋巴结微转移检测简便、易行,优于HE染色;该区域结直肠癌中枢方向行D3术式有临床意义,尤其针对临床高度怀疑Dukes C2期及合并结直肠癌家族史的患者有十分显著的临床意义。进一步扩大样本、完善研究手段,探讨结直肠癌淋巴结微转移的发生、发展、转归极具临床意义。
[1]曹志新,徐向上,杨传永,等.直肠癌术中从根部结扎肠系膜下动脉临床意义探讨[J].中国实用外科杂志,2006,26(12):942-944.
[2]Hida J,Yasutomi M,Mauyama T,et al.Indication for using highligation of the inferior mesenteric artery in rectal cancer surgery.Examination of nodal metastases by the clearing methods[J].Dis Colon Rectum,1998,41(8):984-987.
[3]Slanetz CA Jr,Grimson R.Effect of high and intermediate ligation on survival and recurrence rates following curative resection of colorectal cancer[J].Dis Colon Rectum,1997,40(10):1205-1218.
[4]Kanemitsu Y,Hirai T,Komori K,et al.Survival benefit of highligation of the inferior mesenteric artery in sigmoid colon or rectal cancer surgery[J].Br J Surg,2006,93(5):609-615.
[5]Spiliotis J,Datsis A.The surgical approach to locally recurrent rectal Cancer[J].Tech Coloproctol,2004,8(suppl 1):S33-S35.
[6]Bresalier RS.Malignant neoplasms of the large intestine.In:Feldman M,Friedman LS,Sleisenger MH,eds.Sleisenger and Fordtran′s gastrointestinal and liver disease[M].Philadelphia:W.B.Saunders company,2002:2215-2261.
[7]Hermanek P.Disseminated tumor cells versus micrometastasis:definitions and problems[J].Anticancer Res,1999,19(4A):2771-2774.
[8]Moll R,Loewe A,Lauffr J,et al.Cytokeratin 20 in human carcinomas:a new histodiagnostic market detected by monoclonal antibodies[J].Am JPatho1,1992,140(2):427.
[9]熊兵红,程 勇,王严庆.细胞角蛋白20检测在大肠癌微转移中的临床意义[J].世界华人消化杂志,2006,14(14):1394-1402.
[10]Chu PG,Weiss LM.Keratin expression in human tissues and neoplasms[J].Histopathology,2002,40(5):403-439.
[11]Frederiksen CM,Knudsen S,Laurberg S,et al.Classification of Dukes′B and C colorectal cancers using expression arrays[J].J Cancer Res Clin Oncol,2003,129(5):263-271.
[12]Illert B,Fein M,Otto C,et al.Desseminated tumor cells in the blood of patients with gastric cancer are an independent predictive marker of poor prognosis[J].Scand JGastroenterol,2005,40(7):843-849.
[13]赵 旗,载冬秋.Dukes B期结直肠癌淋巴结微转移与临床病理关系[J].世界华人消化杂志,2005,13(2):268-269.
[14]董新舒,高登群,赵家宏,等.直肠癌扩大根治术的临床病理学研究[J].肿瘤学杂志,2001,7(1):28-30.
[15]Clarke C,Ryan E,O′Keane JC,et al.The detection of cytokeratins in lymph nodes of Duke′Sb colorectal cancer subjects prdicts a poor outcome[J].Eur J Gastroenterol Hepatol,2000,12(5):549-552.
[16]Noura S,Yamamoto H,Miyake Y,et al.Immunohistoc hemical assessment of localization and frequency of micre metastasis in lymph nodes of colorectal cancer[J].Clin Cancer Res,2002,8(3):759-767.
