藏猪天然抗性相关巨噬细胞蛋白基因克隆及变异研究
2015-01-08郑王山赵生国
郑王山,程 箫,赵生国
(甘肃农业大学动物科学技术学院,甘肃 兰州730070)
作为NRAMP 基因家族的一员,NRAMP1(天然抗性相关巨噬细胞蛋白)在小鼠中首次发现,然后在其他物种如人类、鸡、牛和绵羊中被分离、测序并定位。小鼠对感染病原微生物抵抗性或易感性是通过在1号染色体显性基因控制,称为卡介苗、Ity 或LSH,因此这种控制基因被命名为NRAMP(天然抗性相关NRAMP1巨噬细胞蛋白)。NRAMP1编码一种膜内在蛋白,与原核和真核细胞运输结构具有同源性,表明巨噬细胞膜特异性转运功能。最近的研究表明,NRAMP1 编码一种具有运输和离子通道功能的糖蛋白。猪NRAMP1 基因位于15号染色体上的q23-26,和人类与小鼠的基因相似,猪NRAMP1基因全长15kb,包含15个外显子和14内含子,其cDNA 长1617bp,编码538 个氨基酸。基因主要在特定的细胞内表达,如巨噬细胞,嗜中性粒细胞和外周血细胞,编码100kDa的的多肽,包含10~12个跨膜区,一个糖基化的细胞外肽链以和一个具有运输功能的结构域,它可参与吞噬细胞的调节活动。
藏猪长期生活在低氧、低温度、高辐射、高海拔的独特生境中,并且在很长一段时间缺乏人力保障。在长期的自然选择过程中,在行为、生理和形态等方面形成许多独特之处,以适应独特的生境。藏猪有比其他猪种更好的抗病能力。我们推测,藏猪NRAMP1基因可能与其有关。因此,笔者决定在五类猪中克隆NRAMP1 基因,并期望找到基因在五种猪之间的差异。
1 材料与方法
1.1 材料
五种猪是藏香猪、甘肃黑猪、大白猪、约克夏猪、杜洛克。样品均来自甘肃省。
1.2 引物设计
根据猪NRAMP1(U55068)基因在Genebank中公布的mRNA 序列,利用Premier 5.0软件设计NRAMP1基因引物,详见表1。
1.3 聚合酶链反应(PCR)
PCR 反应总体系:25μL,其中预混酶12.5μL、上下游引物各1μL、模板DNA1μL,加双蒸水9.5 μL。扩增条件:94 ℃5min,94℃30s,72℃40s,72 ℃30s,72 ℃5min,将PCR 产物用1.5%琼脂糖凝胶电泳检测。

表1 NRAMP1基因引物参数
1.4 扩增片段的序列分析
将PCR产物用DNA纯化试剂盒(Takara)纯化,然后克隆到PMD-19T 载体,连接产物被转化到DH5α细胞中。含有阳性克隆产物的质粒用蓝白斑筛选、提取、PCR鉴定并由上海生工生物技术有限公司测序。扩增片段的序列用MEGA5软件对齐。
1.5 限制性内切酶位点分析
利用MB软件对NRAMP1 基因进行分析,分析其限制性内切位点。
2 结果与分析
2.1 猪NRAMP1基因的分子克隆
扩增克隆到PMD-19T 载体的NRAMP1 基因并且测序。利用MEGA5 软件对扩增产物的序列进行比对。NRAMP1基因碱基A、G、T、C 的含量分别是23%、28%、27%、22% 。DNA 测序结果表明NRAMP1 基因序列全长是12779bp,包括1 bp至570bp的5'非编码区和12459bp至12779bp的3'非编码区域,猪NRAMP1基因含有15个外显子和14个内含子,如图1所示。

图1 NRAMP1基因结构示意图
2.2 NRAMP1基因序列分析
五种猪之间的DNA 序列比较发现,这五种猪NRAMP1基因存在少数核苷酸突变。14个内含子有11个核苷酸的突变,5'端非编码区有2个核苷酸突变,3'非编码区有10个碱基的突变和一个碱基缺失,这些核苷酸的突变无法导致氨基酸的改变。15个外显子有18 个核苷酸突变,但有14个突变并没有造成氨基酸的变化,仅有4个有义突变,其分别位于外 显 子4(T2551G 和 A2552T)、外 显 子5(C4881A)和外显子14(T12113C),分别导致四个氨基酸(100(V→G)、137(P→T)、471(L→P))的改变。NRAMP1变异多态性序列如表2所示。
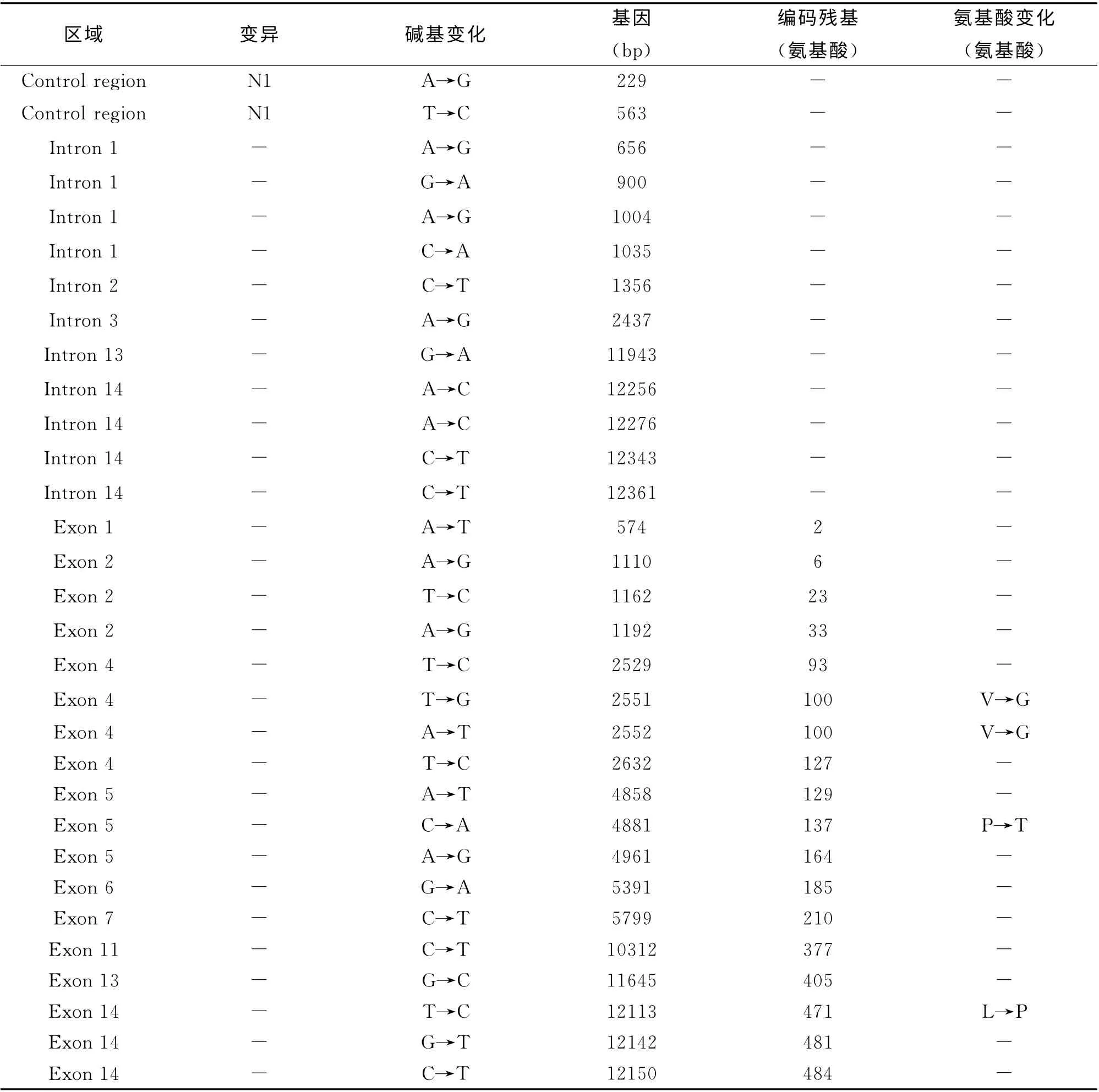
表2 NRAMP1的变异多态性序列
2.3 限制性位点分
猪NRAMP1基因有100个限制性位点,包含22个独特限制性位点(AccBSI AflII AspA2IAsuNHI AvaIII AvrII BseX3IBspLU11IBspTI BsrBI Bst98I BstZI EagI EclXI Eco32I Eco52I EcoRI EcoRV EcoT22IEge I EheI Zsp2I),42个非特异性限制位点(AatII AccIII Acc16IAclI Aor13HI AssI AsuII AviII BanIII Bsa29IBseCI BsiWI Bsp13IBsp68IBsp106I Bsp119I Bsp1407I BspCI BspDI BspEI BspT104I BspXI BsrGI BssHI Bst1107IBstAUI BstBI BstSNI BstZ17IBsu15IBsuTUI BtrI ClaI Csp45IEco105IZrmI),如图2所示:

图2 藏猪限制性位点示意图
3 讨论
尽管细胞对病原体所造成的感染性疾病的抵抗机制存在大量信号,但是这些信号和机制是未知的,也许其中NRAMP1 具有最重要的作用。作为NRAMP1基因家族的成员,NRAMP1基因是最早在近交系小鼠中公认的抗沙门氏菌(鼠伤寒沙门氏菌[卡介苗])和牛结核分枝杆菌的基因(结核杆菌鲍里斯[Ity])。使用基因敲除的方法敲除NRAMP1基因,小鼠失去了抵抗结核分枝杆菌、沙门氏菌和利什曼原虫能力。但是对藏猪NRAMP1的存在或功能的研究很少,所以笔者克隆了藏猪和其他四种猪的NRAMP1基因的全序,分析五种猪NRAMP1基因的序列和长度并且采用分析生物信息学的方法分析五种猪NRAMP1基因结构。
与相关报道人、小鼠、猪NRAMP1基因序列一致,猪NRAMP1基因的开放阅读框为1614bp,编码538 个氨基酸残基的蛋白质。本研究克隆了NRAMP1基因的全序,全长12779bp,5'非编码区域由1个bp至570bp,3'非编码区从12459bp至12779bp,具有15个外显子,被14个内含子隔开。藏猪NRAMP1基因外显子大小与文献报道的大白猪和杂种猪基本相符。对XiaolinDing等人对评估NRAMP1 基因对猪的免疫能力的影响进行了评估,表明NRAMP1 可视为生猪养殖过程中抗病力性状分子标记。应三成开展藏猪NRAMP1基因表达的研究,表明藏猪的NRAMP1 基因比其他猪种表达组织更广泛,藏猪可能是研究NRAMP1 基因对疾病抵抗性和感染性的珍贵基因资源库。而目前NRAMP1基因的研究多数在第六内含子的多态性和诱发该基因表达的机理其与抗病性的关系。李娟娟等人对合作藏猪第六内含子多态性进行研究,发现10 个突变位点。刘艳冬等人利用PCR- RFLP方法对贵州几个地方猪种的NRAMP1基因第6内含子NdeI酶切位点进行多态性分析,基因型频率在各猪种中的分布趋近一致,品种间无明显差异。本研究在第六内含子未发现变异,这可能与实验动物的样本量和测序的准确性有关,将进一步对其进行研究。
本研究还分析了NRAMP1基因的限制性内切位点,为该基因的载体构建和表达以及在生物工程上的应用奠定理论基础。Samantha Gruenheid 等人研究认为NRAMP1控制细胞内寄生虫或微生物吞噬体的环境,从而达到抵抗病原微生物的目的。GuoLong Zhang 等对猪NRAMP1基因mRNA 表达的细胞和组织特异性最高在巨噬细胞并且是通过激活MAPK 通路诱导NRAMP1 基因表达。本研究则是克隆NRAMP1 该基因的全序,分析其基因变异位点、数量和核苷酸突变后导致氨基酸变化来推测这几种猪在抗病性上表现出的差异,本研究发现4个核苷酸的突变导致氨基酸的变化,外显子4(T2551G 和A2552T)有两种突变,导致在100位密码子处单个氨基酸改变(V→G)。剩下的2个突变在外显子5(C4881A)和外显子14和(T12113C),导致改变137密码子单个氨基酸(P→T)和471密码子(L→P)。缬氨酸和脯氨酸这两种疏水性氨基酸改变为亲水性的甘氨酸和苏氨酸。笔者预测由于氨基酸的性质改变可能引起蛋白质的跨膜结构域、三级结构或更高级结构及其空间结构排布变化,从而使藏猪与其他猪种之间产生了对病原微生物抵抗力存在差异的原因。不过,引起猪的抗病性的因子很多,是由基因和生境共同决定的,所以藏猪NRAMP1 基因与其抗病力之间的关系以及NRAMP1基因的表达调控机制还需要在今后工作中进一步关注学习研究。
4 结论
本研究扩增NRAMP1 基因的全序,利用克隆和测序的方法分析了的结构、突变位点、限制性内切酶位点等,为更深入了解基因与动物疾病控制关系以及有效识别和控制,也为揭示NRAMP1 基因抗病性分子机理和其他物种NRAMP1基因的研究奠定了理论基础并提供科学借鉴。
[1] Hongmei Wu,Duxue Cheng,Lixian Wang.Association of polymorphisms of Nramp1gene with immune function and production performance of large white pig[J].J.Genet.Genomics,2008(2):91-95.
[2] Cellier M,Belouchi A,Gros P.Resistance to intracellular infections:comparative genomic analysis of Nramp[J].Trends Genet,1996,12(6):201-4.
[3] Cellier M,Govoni G,Vidal S,et al.Human natural resistance-associated macrophage protein:cDNA cloning,chromosomal mapping,genomicorganization,and tissue-specific expression[J].J Exp Med,1994,180(5):1741-52.
[4] Hu J,Bumstead N,Burke D,et al.Genetic and physical mapping of the natural disease resistance-associated macrophage protein 1(Nramp1)in chicken[J].Mamm Genome,1995,6(11):809-15.
[5] Feng J,Li Y,Hashand M,et al.Bovine natural resistance associated macrophage protein 1(Nramp1)gene[J].Genome Res,1996,6(10):956-64.
[6] Pitel F,Lantier I,Riquet,et al.Cloning,sequencing,and localization of an ovine fragment of the Nramp gene,a candicate for the ITY/LSH/BCG gene[J].Mammalian Genome,1994,5:834.
[7] Pitel F,Cribiu EP,Yerle M,et al.Regional localization of the ovine NRAMP gene to chromosome 2q41-->q42 by in situ hybridization[J].Cytogenet Cell Gene,1995,70(1-2):116-8.
[8] Skamene E,Pierrangeli C E.Genetics of the immune response to infectious pathogens[J].CurrOnin Immunol,1991,3:511-517.
[9] Barton CH,Whitehead SH,Blackwell JM.Nramp transfection transfers Ity/Lsh/Bcg-related pleiotropic effects on macrophage activation:influence on oxidative burst and nitric oxide pathways[J].Mol Med,1995,1(3):267-79.
[10] Vidal SM,Malo D,Vogan K,et al.Natural resistance to infection with intracellular parasites:isolation of a candidate for Bcg[J].Cell,1993,73(3):469-85.
[11] Vida S,Gros P,Skamene E.Natural resistance to infection with intracellular parasites:molecular genetics identifies Nramp1as the Bcg/Ity/Lsh locus[J].J Leukoc Biol,1995,58(4):382-90.
[12] Belouchi A,Cellier M,Kwan T,et al.The macrophage-specific membrane protein Nramp controlling natural resistance to infections in mice has homologues expressed in the root system of plants[J].Plant Mol Biol,1995,29(6):1181-96.
[13] Searle S,Bright NA,Roach TI,et al.Localisation of Nramp1in macrophages:modulation with activation and infection[J].J Cell Sci,1998,111:2855-66.
[14] Vidal SM,Pinner E,Lepage P,et al.Natural resistance to intracellular infections:Nramp1 encodes a membrane phosphoglycoprotein absent in macrophages from susceptible(Nramp1 D169)mouse strains[J].J Immunol,1996,157(8):3559-68.
[15] Supek F,Supekova L,Nelson H,et al.A yeast manganese transporter related to themacrophage protein involved in conferring resistance to mycobacteria[J].PNAS,1996,93:5105-5110.
[16] Tuggle C K,Schmitz C B,Gingerich Feil D.Rapid communication:cloing of a pig full length Nramp1 cDNA[J].Journal of Animal Science,1997,75:277.
[17] Sun HS,Wang L,Rothschild MF,et al.Mapping of the natural resistance-associated macrophage protein 1(NRAMP1)gene to pig chromosome 15[J].Anim Genet,1998,29(2):138-140.
[18] Govoni G,Vidal S,Cellier M,et al.Genomic structure,promoter sequence,and induction of expression of the mouse Nramp1gene in macrophages[J].Genomics,1995,27(1):9-19.
[19] Marquet S,Lepage P,Hudson TJ,et al.Complete nucleotide sequence and genomic structure of the human NRAMP1gene region on chromosome region 2q35[J].Mamm Genome,2000,11(9):755-62.
[20] Wu ZF,Luo WH,Yang GF,et al.Genomic organization and polymorphisms detected by denaturing highperformance liquid chromatography of porcine SLC11A1gene[J].DNA Seq,2007,18(5):327-33.
[21] Vidal S M,Malo D,Vogan K,et al.Natural resistance to infection with intracellular parasites:isolation of a candidate for Bcg[J].Cell,1993,73:469.
[22] Bairoch A.The Prosite dictionary of sites and patterns in proteins,its current status[J].Nucl Acids Res,1993,21:3097.
[23] Gros P,Skamene E,Forget A.Cellular mechanisms of genetically controlled host resistance to Mycobacterium bovis(BCG)[J].J Immun,1983,131:1966.
[24] Skamene E,Gros P,Forget A,et al.Genetic regulation of resistance to intracellularpathogens[J].Nature,1982,297:506.
[25] Skamene E,Schurr E,Gros P.Infection genomics:Nramp1as a major determinant of natural resistance to intracellular infections[J].Annu Rev Med,1998,49:275-87.
[26] Bueno R,Carvalho Neta AV,Xavier MN,et al.cDNA sequencing and expression of Nramp1 (Slc11a1)in dogs phenotypically resistant or susceptible to visceral leishmaniasis[J].Vet Immunol Immunopathol,2009,127(3-4):332-9.
[27] Cellier M,PrivéG,Belouchi A,et al.Nramp defines a family of membrane proteins[J].Proc Natl Acad Sci U S A,1995,92(22):10089-93.
[28] Vidal S,Tremblay ML,Govoni G,et al.The Ity/Lsh/Bcg locus:natural resistance to infection with intracellular parasites is abrogated by disruption of the Nramp1gene[J].J Exp Med,1995,182(3):655-66.
[29] Zhang G,Wu H,Ross CR,et al.Cloning of porcine NRAMP1 and its induction by lipopolysaccharide,tumor necrosis factor alpha,and interleukin-1beta:role of CD14and mitogen-activated protein kinases[J].Infect Immun,2000,68(3):1086-93.
[30] Ding X,Zhang X,Yang Y,et al.Polymorphism,Expression of Natural Resistance-associated Macrophage Protein 1Encoding Gene(NRAMP1)and Its Association with Immune Traits in Pigs[J].J Anim Sci,2014,27(8):1189-95.
[31] 应三成,张义正.藏猪NRAMP1基因的定量表达研究[J].四 川 大 学 学 报:自 然 科 学 版,2007(3):697-705.
[32] 李娟娟,马小军,等.合作猪Nramp1 基因第六内含子多态性分析[J].甘肃农业大学学报,2010(2):21-24.
[33] 刘艳冬,许厚强,林家栋,等.贵州地方猪NRAMP1基因多态性研究[J].贵州牧兽医,2009(2):1-2.
[34] Gruenheid S,Pinner E,Desjardins M,et al.Natural resistance to infection with intracellular pathogens:the Nramp1protein is recruited to the membrane of the phagosome[J].J Exp Med,1997,185(4):717-30.
[35] Zhang G,Wu H,Ross CR,et al.Cloning of porcine NRAMP1 and its induction by lipopolysaccharide,tumor necrosis factor alpha,and interleukin-1beta:role of CD14and mitogen-activated protein kinases[J].Infect Immun,2000,68(3):1086-93.
