固相萃取-液相色谱-电喷雾串联质谱法测定鲜枣中14种农药残留
2015-01-07钟冬莲刘毅华沈丹玉莫润宏汤富彬
钟冬莲, 刘毅华, 沈丹玉, 莫润宏, 丁 明, 汤富彬
(中国林科院 亚热带林业研究所/国家林业局 经济林产品质量检验检测中心(杭州),浙江 富阳311400)
固相萃取-液相色谱-电喷雾串联质谱法测定鲜枣中14种农药残留
钟冬莲, 刘毅华, 沈丹玉, 莫润宏, 丁 明, 汤富彬*
(中国林科院 亚热带林业研究所/国家林业局 经济林产品质量检验检测中心(杭州),浙江 富阳311400)
选择强疏水性硅胶基质tC18柱为固相萃取净化柱,以电喷雾(ESI)为离子源,正离子多级反应离子监测(MRM)模式,建立了固相萃取-液相色谱-串联质谱法(HPLC-MS/MS)测定鲜枣中14种农药(包括有机磷杀虫剂、杀菌剂,有机杂环类杀虫剂和新型烟碱类杀虫剂)残留的分析方法。研究比较了不同提取溶剂的提取效果和不同固相萃取小柱的净化效果,同时优化了色谱分离条件和质谱条件。14种农药在10~500 μg/L(或1~50 μg/L)范围内线性相关,相关系数为0.996 3~0.999 9,方法的定量限为0.10~9.50 μg/kg。14种农药在鲜枣中3个水平添加质量浓度的的回收率在67.4%~116.8%,RSD为0.8%~14.8%之间。该方法操作简便,灵敏度、准确度和精密度均符合农药多残留检测技术要求,适用于鲜枣中14种农药多残留的检测。
固相萃取;鲜枣;液相色谱-串联质谱法;农药残留
枣(Ziziphus jujuba Mill.),是鼠李科木本植物枣的果实。枣以其极优的品质,富含人体必需的营养物质而倍受消费者青睐。枣树由于适应性强、早果速丰、易管理,以及经济效益和生态效益显著等优点,是中国北方栽培的主要果树树种之一。由于栽培生态的变化和感病寄主的增加,致使枣子病害随之逐年加重。药物防治在目前枣子病虫害的防治中仍占主导地位[1]。近几年来,世界各国对枣子中农药残留指标和限量要求渐降低[3-5]。因此,枣中农药残留的检测已成为科研工作者关注的焦点,也成为枣产业的技术瓶颈之一。
作者根据国内外枣中常用农药及其限量要求,选择14种农药(包括有机磷杀虫剂、杀菌剂,有机杂环类杀虫剂和新型烟碱类杀虫剂),采用固相萃取-液相色谱-质谱联用技术,建立鲜枣中14种农药多残留的同时检测技术。该方法操作简便,选择性好,灵敏度高,可同时定性和定量检测鲜枣中多种农药残留,为枣的安全开发提供有力的保证。
1 材料与方法
1.1 仪器与试剂
Waters Quttro Premier高效液相色谱-串联质谱仪:美国Waters公司产品;IKAT18均质器:德国IKA公司产品;高速离心机:美国Thermo公司产品;涡旋振荡器:德国IKA公司产品。
14种农药标准品(除多菌灵、噻嗪酮为100 μ g/mL外,其余为1 000 μ g/mL):购于环境保护部标准样品研究所;乙腈、甲醇:HPLC级,德国Merck公司产品;氯化钠:分析纯,上海国药集团产品;甲酸,甲苯:色谱纯,美国Sigma公司产品;tC18柱(500mg)、Carbon NH3柱 (1 000 mg)、C18柱(500 mg):美国Waters公司产品;PSA柱:500 mg,美国安捷伦公司产品;实验用水均为高纯水,经Milli-Q超纯水器纯化。
1.2 标准溶液的配制
农药单标储备溶液:准确吸取1.00 mL农药母液于10 mL的容量瓶中,氮气将溶剂吹干,用甲醇溶解定容,配成质量浓度为100 μg/mL(多菌灵、噻嗪酮为10 μg/mL),贮存在-20℃冰箱中备用。
混合标准储备溶液:分别吸取1.00 mL农药标准储备液于10 mL容量瓶中,氮吹部分甲醇,以致14种农药最后用甲醇定容至10 mL,即配成10 μg/ mL(多菌灵、噻嗪酮为1 μg/mL)的混合标准储备液,于-4℃冰箱中保存。使用时用流动相作为溶剂,制备标准工作曲线溶液。
1.3 样品的提取
在英文中,“black list”始于剑桥大学和牛津等大学。起初,黑皮书是学校用于记录学生违规违纪的行为。学生的名字如果被记在了黑皮书上,就会丢失名誉。后来,这个方法也被商人用来规避那些没有信用的顾客。于是,黑名单由此被社会广泛运用。在汉语中,“黑名单”上都是那些应该被处罚的秘密名单。这句话里的“黑”意思是“秘密的”“暗地里地”。经过对比,这里的“黑”或“black”具有相似的隐含语义,故采取直译的方法。
准确称取10.0 g粉碎后的鲜枣样品于150 mL烧杯中,加入50.0 mL乙腈,均质提取2 min后过滤,滤液全部过滤到装有5~7 g NaCl的100 mL具塞量筒中,收集滤液40~50 mL,盖上塞子,振荡萃取2 min,在室温下静置20 min,待乙腈和水相分层。准确吸取5 mL乙腈提取液,置入100 mL的旋转蒸发瓶中,并在40℃水浴旋转蒸发至近干。
1.4 样品的净化
在100 mL旋蒸瓶中加入2 mL乙腈-甲苯溶液(体积比为3∶1)溶解样品,然后将样品全部转入预先用10 mL乙腈-甲苯溶液(体积比为3∶1)活化的Sep-pak Vac 6cc tC18柱中净化,待溶液到达柱上层吸附剂时,用10 mL乙腈-甲苯溶液(体积比为3∶1)洗脱,洗脱液收集于15 mL试管中,于40℃下氮气吹干,用2 mL甲醇-水(体积比为3∶2)溶解样品,以0.22 μm针式过滤头过滤,滤液待测定。
1.5 仪器工作条件
1.5.1 液相色谱条件 Atlantis T3(2.1 mm×100 mm,5 μm);柱温:35℃;进样量:10 μL;流动相A:体积分数0.05%甲酸水溶液;流动相B:甲醇;流量为0.3 mL/min;洗脱程序为:0~5 min,90%~50%A;5~8 min,50%~20%A;8~10 min,20%~5%A;10~18 min,5%A;18~22 min,5%~90%A;22~25 min,90% A。
1.5.2 质谱条件 电喷雾离子源正离子模式(ESI+);毛细管电压:3.0 kV;离子源温度:80℃;脱溶剂气温度为450℃;脱溶剂气流量:550 L/h;锥孔气流量:50 L/h;扫描方式:多反应监测MRM。其它参数见表1。

表1 测定14种农药质谱条件Table 1 Mass spectrometry detection conditions for 14 pesticides residues analysis
2 结果与讨论
2.1 提取溶剂的选择
在多种农药的残留分析中,提取溶剂已报道的有乙腈[9-14]、丙酮[15-16]、二氯甲烷[16],选择乙腈、丙酮、二氯甲烷3种提取溶剂对14种目标农药在鲜枣中的添加回收率进行对比实验,回收率数据见表2。对表2的结果进行分析,得出的结果列于见表3。结果表明,乙腈和丙酮的提取效率较高,且效果相当,但丙酮在水中溶解度比乙腈大,浓缩时,无法蒸干,需在浓缩前用无水硫酸钠脱水,操作步骤相对繁琐,故实验选择乙腈为提取溶剂。

表2 3种提取溶剂对鲜枣中14种农药回收率的影响Table 2 Effect of the recoveries of 14 spiked pesticides in fresh jujube by 3 different extraction solvents %
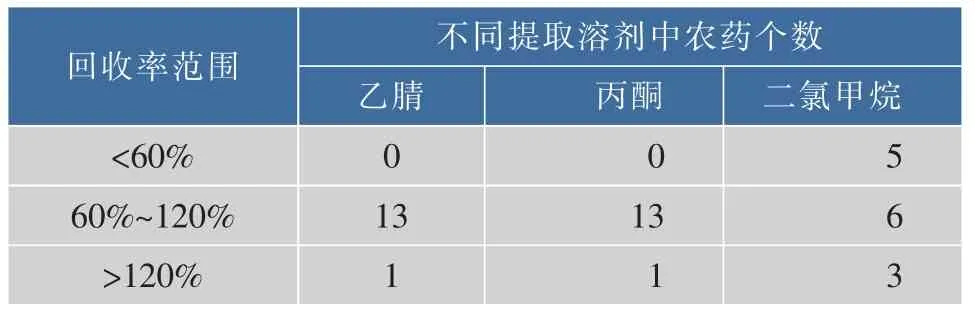
表3 14种农药在不同提取溶剂中的添加回收率结果(n=3)Table 3 Statisticsof spiked recoveries of 14 pesticides in different extraction solvents(n=3)
2.2 固相萃取净化柱的选择
农药多残留检测净化技术常采用液-液分配[17-18], 凝胶渗透色谱 (GPC)[16,19], 和固相萃取(SPE)[11,13-14,20-22]。液液分配净化耗时长、溶剂消耗量较大;凝胶渗透色谱净化成本相对较高。针对鲜枣中含糖量高、基质复杂的等点,对比了Sep-Pak Vac 6cc tC18柱、Sep-Pak Vac 6cc C18柱、Sep-Pak Vac 6cc CarbonNH3柱和 Bond Elut-PSA柱的净化效率,以乙腈-甲苯溶液(体积比为3∶1)混合溶液为洗脱液,Sep-Pak Vac 6cc tC18,Sep-Pak Vac 6cc C18,Sep-Pak Vac 6cc CarbonNH3和 Bond Elut-PSA柱的净化效果见图 1.结果表明,Sep-pak vac CarbonNH3在4种净化柱中对杂质的净化能力最强,净化后样品溶液颜色清亮透明,可对于多菌灵,敌百虫,敌敌畏和乙酰甲胺磷这4种农药,回收率低于20%。而对于PSA柱,敌百虫,敌敌畏和乙酰甲胺磷3种农药的回收率较低,也不能满足实验要求。Sep-pak vac tC18和Sep-pak vac C18柱相比,14种农药的回收率在60%~120%之间,但Sep-pak vac tC18柱是强疏水性硅胶基质,对杂质的键合采用三点键合方式,较Sep-pak vac C18柱单点键合能力强,所以Sep-pak vac tC18柱净化后的14种农药回收率比Sep-pak vac C18柱净化后回收率略高,故作者选用Sep-pak vac tC18柱为净化柱。
2.3 基质效应

图1 固相萃取柱的选择Fig.1 Selection of solid phase extraction columns
目标化合物中的共存杂质对目标化合物的测定必然带来基质效应,本方法中基质效应的评价是用空白基质配制标准曲线的斜率与用纯溶剂配制标准曲线的斜率之比的百分比来描述。实验结果见图2。结果显示,对于大部分的目标化合物,大约占78%的农药,基质效应强度为100%~150%,表现为基质增强效应。其余的农药表现为基质抑制效应。因此,作者中采用空白样品基质配制标准曲线来消除基质效应的影响。2.4 方法学评价

图2 农药不同基质效应强度的分布Fig.2 Distribution of matrix effects intensity on the response of pesticides
在最佳的测定条件下,以MRM定量离子色谱峰面积(Y)对质量浓度(X,μg/L)建立标准曲线。14种农药在表4列出的浓度范围内,相关系数在0.996 3~0.999 9之间。
为考察方法的回收率,分别在鲜枣中加入20,100和200 μg/kg(对线性范围为1.0~50 μg/L的农药,加入2.0,10.0和20.0 μg/kg)农药混合溶液,每个浓度重复6次(表4)。结果表明,鲜枣中14种农药的添标回收率在67.4%~116.8%,RSD在0.8%~14.8%范围内。
按照信噪比为10(S/N=10)计算定量限,鲜枣中14种农药的定量限为0.1~9.5 μg/kg。标准物质的总离子流色谱图和鲜枣中加标总离子流图见图3。

图3 标准物质(a)和鲜枣加标(b)的总离子流色谱图Fig.3 Total ion chromatogram of 14 pesticides residues standards(a)and spiked fresh jujube samples(b)
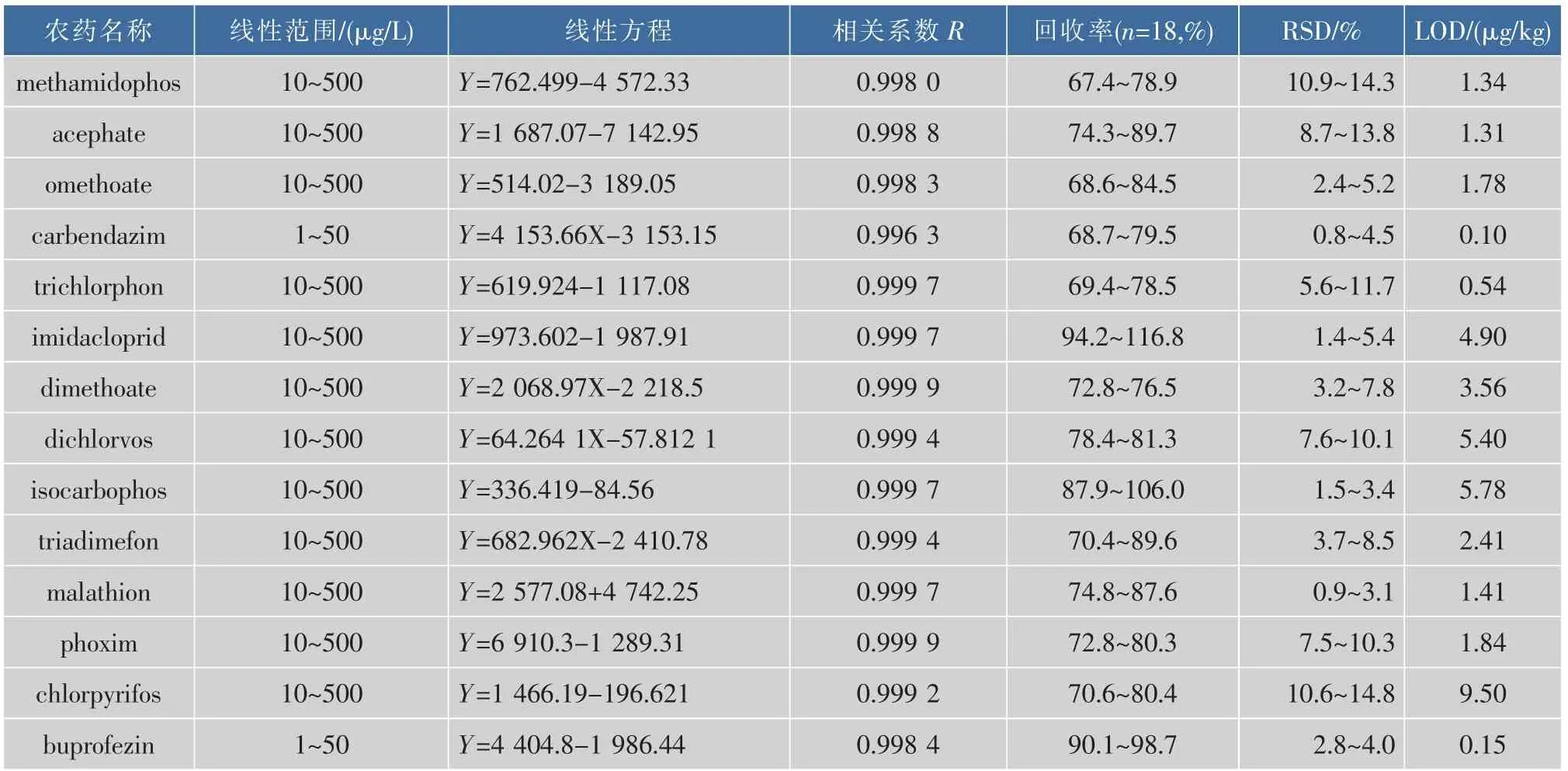
表4 测定14种农药的特性指标Table 4 Characteristic indexes for the determination of 14 pesticides residues
2.5 实际样品测定
在优化条件下进行鲜枣样品测定,共检测26份鲜枣样品,样品中农药的检出率为53.84%;26份样品中共检出2种农药残留,毒死蜱(9批)、马拉硫磷(10批),但均未超出国家标准[3]中规定的最大残留限量值。对于阳性样品,再一次采用标准方法NY/ T 761-2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》重新测定,结果表明,阳性样品仍有检出,且检出结果与本方法检测结果相当,无显著差异。
3 结语
作者根据鲜枣样品含糖量高的特点,采用乙腈溶液提取,Sep-Pak Vac tC18固相萃取柱净化,液相色谱分离,串联四极杆质谱检测,成功地建立了鲜枣中14种农药的快速检测方法。该方法操作简便,选择性好,灵敏度高,完全可以满足国内外限量标准中对鲜枣中农药残留的检测要求。
[1]靳增军,曹克强.冬枣、金丝小枣中氯氰菊酯、氰戊菊酯、三唑酮残留量测定[J].现代农药,2007,6(2):36-38. JIN Zengjun,CAO Keqiang.Determination of cypermethrin,fenvalerate and triadimefon pesticide residues in Jujube by GC[J]. Modern Agrochemicals,2007,6(2):36-38.(in Chinese)
[2]林维宣,王凤池.各国食品中农药兽药残留限量规定[M].大连:大连海事大学出版社,2002.
[3]GB 2763-2014.食品安全国家标准食品中农药最大残留限量[S].
[4]LY/T 1777-2008.森林食品质量安全通则[S].
[5]GB 18406.2-2001.农产品质量安全无公害水果安全要求[S].
[6]马庆华,续九如,王贵禧,等.冬枣百菌清、氯氰菊酯和氰戊菊酯残留的研究[J].中国农学通报,2009,25(15):51-54. MA Qinhua,XU Jiuru,WANG Guixi,et al.Determination of chlorothalonil,cypermethrin and fenvalerate pesticide residues in Dongzao[J].Chinese Agricultural Science Bulletin,2009,25(15):51.(in Chinese)
[7]赵笑天,史惠娟,原超,等.鲜枣干枣和裂果枣中9种真菌毒素及77种农药残留的分析与检测[J].农产品加工·学刊,2011,3(238):61-67.(in Chinese)ZHAO Xiaotian,SHI Huijuan,YUAN Chao,et al.Analysis and detection 9 mycotoxins and 77 pesticides residue in jujube dates [J].Academia Periodical of Farm Products Processing,2011,3(238):61.(in Chinese)
[8]钱宗耀,周晓龙,刘河疆,等.气质联用法测定红枣中苯醚甲环唑残留量[J].现代农药,2012,11(3):37-39. QIAN Zongyao,ZHOU Xiaolong,LIU Hejiang,et al.Determination of difenoconazole residue in red jujube by Gas chromatography-mass spectrometry[J].Mordern Agrochemicals,2012,11(3):37.(in Chinese)
[9]周利,罗逢健,张新忠,等.纳米竹炭分散固相萃取/超高效液相色谱-串联质谱法测定绿茶中的农药多残留[J].分析测试学报,2014,33(6):642-647. ZHOU Li,LUO Fengjiang,ZHANG Xinzhong,et al.Determination of multi-pesticide residues in green tea by nano bamboo charcoal-dSPE/ultra high performance lLiquid chromatography-tandem mass spectrometry [J].Journal of Instrumental Analysis,2014,33(6):642-647.(in Chinese)
[10]骆冲,万凯,丁晨红,等.RP-HPLC法测定蔬菜、水果及食用菌中9种农药残留的研究 [J].分析测试学报,2014,33(6):698-702. LUO Chong,WANG Kai,DING Chenhong,et al.Simultaneous determination of nine pesticide residues in vegetables,fruit and edible fungi by reverse phase high performance liquid chromatography[J].Journal of Instrumental Analysis,2014,3(6):698-702.(in Chinese)
[11]于彦彬,谭丕功,刘宗兴,等.基质校正固相萃取液相色谱-串联质谱法测定食用菌中22种农药残留[J].分析化学,2013,41(8):1259-1263. YU Yanbin,TAN Pigong,LIU Zongxing,et al.Determination of 22 pesticides residues in domestic fungus by solid phase extraction and LC/MS/MS with matrix correction[J].Chinese Journal of Analytical Chemistry,2013,41(8):1259-1263.(in Chinese)
[12]刘晓亮,李雪生,刘绍文,等.中草药中13种代表性农药多残留的分散固相净化与气相色谱-质谱法测定[J].分析化学,2013,41(4):553-558.LIU Xiaoliang,LI Xuesheng,LIU Shaowen,et al.Determination of 13 representative pesticides in chinese herbal medicine plants by dispersive solid-phase cleanup and Gas chromatography-tandem mass spetrometry[J].Chinese Journal of Analytical Chemistry,2013,41(4):553-558.(in Chinese)
[13]贾玮,黄峻榕,凌云,等.高效液相色谱-串联质谱法同时测定茶叶中290种农药残留组分[J].分析测试学,2013,32(1):9-22 JIA Wei,HUANG Junrong,LING Yun,et al.Determination of 290 pesticide residues in tea by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis,2013,32(1):9-22.(in Chinese)
[14]刘庆斌,张睿,王海涛,等.高效液相色谱串联质谱法对栀子中11种有机磷农药残留的检测[J].分析测试学,2010,29(1):73-76. LIU Qinbin,ZHANG Rui,WANG haitao,et al.Determation of multi-residues of organophosphorus pesticides in gardenia jasminoides ellis by HPLC tandem MS/MS[J].Journal of Instrumental Analysis,2010,29(1):73-76.(in Chinese)
[15]黄江锐,孔祥虹,姚秉华,等.气相色谱-三重四极杆串联质谱法测定蔓越橘提取物中的88种农药残留[J].色谱,2011,29(10):974-982. HUANG Jiangrui,KONG Xiang hong,YAO Binghua,et al.Detemination of 88 pesticide residues in cranberry plant extract by gas chromatography-triple quadrupole tandem mass spectrometry[J].Chinese Journal of Chromatography,2011,29(10):974-982.(in Chinese)
[16]欧阳运富,唐宏兵,吴英,等.加速溶剂萃取-在线凝胶渗透色谱-气相色谱-质谱联用法快速测定蔬菜和水果中多农药残留[J].色谱,2012,30(7):654-659. OUYANG Yunfu,TANG Hongbin,WU Ying,et al.Rapid determination of pesticide multiresidues in vegetables and fruits by accelerated solvent extraction coupled with online gel permeation chromatography-gas chromatography-mass spectrometry[J]. Chinese Journal of Chromatography,2012,30(7):654-659.(in Chinese)
[17]张琦,李达.气相色谱法测定姜中毒死蜱农药的残留量[J].化学工程师,2007(10):21-23. ZHANG Qi,LI Da.Determination of chlorpyrifos pesticide residues in ginger by GC[J].Chemical Engineer,2007(10):21-23.(in Chinese)
[18]潘玉香,董静,孙军,等.气相色谱法测定复杂基质蔬菜中11种农药的残留量 [J].理化检验-化学分册),2009,45(7):852-854. PAN Yuxiang,DONG Jing,XUN Jun,et al.GC determination of residual amounts of 11 pesticides in vegetable of complex matrixes[J].Physical Testing and Chemical analysis Part B:Chemical analysis,2009,45(7):852-854.(in Chinese)
[19]杨如箴,王金花,张蓉,等.凝胶渗透色谱净化超高效液相色谱-串联质谱法检测甘草及其提取物中11种氨基甲酸酯类农药残留[J].色谱,2010,28(8):769-775. YANG Ruzhen,WANG Jinhua,ZHANG Rong,et al.Determination of 11 carbamate pesticide residues in Glycyrrhizae radis et rhizama and its extracts using ultra performance liquid chromatography-tandem mass spectrometry with gel permeation chromatographic clean-up[J].Chinese Journal of Chromatography,2010,28(8):769-775.(in Chinese)
[20]丁明,钟冬莲,汤富彬,等.固相萃取-高效液相色谱-串联质谱联用测定竹笋中残留的7种杀虫剂农药[J].色谱,2013,31(2):117-121. DING Ming,ZHONG Donglian,TANG Fubin,et al.Determination of seven pesticide residues in bamboo shoots by high performance liquid chromatography-tandem mass spectrometry coupled with solid-phase extraction[J].Chinese Journal of Chromatography,2013,31(2):117-121.(in Chinese)
[21]王进,岳永德,汤锋,等.竹笋中40种农药残留的固相萃取气相色谱-质谱法同时测定 [J].分析测试学报,2011,30(2):161-166. WANG Jin,YUE Yongde,TANG feng,et al.Simultaneous Derterminatiion of 40 pesticides residue in Bamboo Shoots by GCMS method with solid Phase extracton[J].Journal of Instrumental Analysis,2011,30(2):161-166.(in Chinese)
[22]曹进,庞国芳,王明林,等.液相色谱-电喷雾串联质谱法测定生姜中的215种农药残留[J].色谱,2010,28(6):579-589. WANG Jin,PANG Guofang,WANG Minglin,et al.Determination of215 pesticide residues in ginger using liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J].Chinese Journal of Chromatography,28(6):579-589.(in Chinese)
Determination of 14 Pesticide Residues in Fresh Jujube Using Liquid Chromatography Coupled with
Electrospray Ionization Tandem Mass Spectrometry
ZHONG Donglian, LIU Yihua, SHEN Danyu, MO Runhong, DING Ming, TANG Fubin*
(Research Institute of Subtropial Foresty,Chinese Academy of Forestry/Quality Testing Center for Non-Wood Forest Products of State Forestry Administration,Fuyang 311400,China)
This study developed a method to identify 14 pesticides residues(including organic phosphorus insecticides,fungicides,organic heterocyclic pesticides and novel nicotine insecticide)in fresh jujube by solid-phase extraction and liquid chromatography coupled with electrospray ionization tandem (HPLC-MS/MS),in which a strong hydrophobic silica bonded tC18 column was selected as the solid-phase extraction,electrospray ionization(ESI)was used as the ion source and positive ion multiple reaction monitoring(MRM)was set as the detection mode.The effects of different extraction solvents and solid-phase extraction columns were compared for the determination of 14 pesticides residues,and at the meanwhile the separation and detection conditions for the multiresidue analysis by chromatography and mass spectrometry were also optimized.A good linearrelationship could be achieved for the detection of 14 pesticides in fresh jujube in the range of 10~500 μg/L(or 1~50 μg/L),with the correlation coefficients of 0.996 3~0.999 9,the quantitation limits of 0.10~9.50 μg/kg,the recoveries of 67.4%~116.8%for 14 pesticides of three different concentrations,and RSD of 0.8%~14.8%.The optimized method,which is applicable to determine 14 pesticide residues in fresh jujube,meets the requirements of the multiresidue analysis with simple operation,good sensitivity,and high accuracy.
solid phase extraction,fresh jujube,Liquid chromatography tandem mass spectrometry(LC-MS/MS),pesticides residues
O 657.63
A
1673—1689(2015)07—0731—07
2014-07-29
国家林业公益行业科研专项课题(201304705,201204414)。
钟冬莲(1985—),女,江西泰和人,实验师,主要从事林产品质量安全研究。E-mail:zhongdonglian215@163.com
*通信作者:汤富彬(1972—),男,浙江富阳人,副研究员,主要从事林产品质量安全研究。E-mail:yalinsuozjzx@163.com
