光强和二氧化碳浓度变化对浒苔幼苗生长及生理的影响
2015-01-05高秀秀李亚鹤段维军徐年军
高秀秀,李亚鹤,段维军,徐年军*
(1. 宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211; 2. 浙江省海洋生物工程重点实验室,浙江 宁波 315211; 3. 宁波出入境检验检疫局技术中心,浙江 宁波 315012)
光强和二氧化碳浓度变化对浒苔幼苗生长及生理的影响
高秀秀1,2,李亚鹤1,2,段维军3,徐年军1,2*
(1. 宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211; 2. 浙江省海洋生物工程重点实验室,浙江 宁波 315211; 3. 宁波出入境检验检疫局技术中心,浙江 宁波 315012)
大气CO2浓度升高引起的海洋酸化如何在光变环境下影响大型海藻固碳量的问题,关系到未来海洋初级生产力的变化趋势。为研究大型海藻对CO2浓度升高和光强变化的响应,本文选取浒苔(Ulvaprolifera)幼苗为实验材料,探讨其在不同光强下[80、260 μmol/(m2·s)]和两种CO2浓度(正常CO2浓度:400 μL/L和高CO2浓度:1 000 μL/L)下的生理变化。研究发现,在正常CO2浓度、高光条件下,浒苔幼苗的生长最快,超氧化物特化酶(SOD)活性最高,而过氧化氢酶(CAT)活性在低光、高CO2处理下有最大值。光合色素含量和光系统Ⅱ的光化学效率在不同处理间没有显著性差异,但叶绿素a与类胡萝卜素的比值在低光正常CO2处理下有最大值。同时,高光高CO2处理下,浒苔幼苗的可溶性蛋白含量最低。
CO2;光强;浒苔幼苗;叶绿素荧光效率;抗氧化活性
1 引言
化石燃料的燃烧和毁林的加剧导致大气中CO2浓度逐渐升高,到21世纪末可增至800~1 000 μL/L(IPCC预测模型A1F1)[1],其中约48%被海洋吸收,导致海水中CO2浓度增加,海水pH值降低[2]。关于海水pH值降低对海洋生态系统影响的研究多集中于浮游植物及远洋区域[3—4]。然而,有研究表明,对于近岸海域,尽管其pH值的变化较大,但由于富营养化及植物的呼吸作用,其酸化速率要快于大洋区域[5—6]。近年来,生活在近海海域的大型海藻,如褐藻门的巨藻[7]、毛孢藻[8]、绿藻门的石莼[9]以及红藻门的珊瑚藻[10]和龙须菜[11],对海水pH值降低的响应也得到了广泛关注。在已研究的大型海藻中,CO2浓度升高对其生长的影响呈现出增加、抑制和不受影响等特征,具有显著的种间差异。
海水pH值降低是海洋环境变化中的一个重要影响因子,同时由于季节、云层厚度、水体混合、层化、透明度及光周期的影响,再加上生活在潮间带的大型海藻,随着海水潮汐变化,经历着水生-干出-水生的循环,其所接受的光强也随之变化。已有的研究表明,海水pH值降低对浮游植物的影响受温度、光强的影响[12—14]。而作为重要经济海藻的浒苔,广泛分布在入海河口、海岸带的潮间带等的区域[15],其光合生理、生化特性是如何响应海水pH值降低的,又是如何受光变环境调控的,需要进一步的研究。
本研究选取浒苔(Ulvaprolifera)幼苗为材料,探讨其对海水pH值降低和光强的复合响应,并分析了其响应机制。
2 材料和方法
2.1 材料
浒苔幼苗充气培养于光照培养箱中,充气速率为600 mL/min,培养光强为80 μmol/(m2·s),培养温度为20℃,光周期为12 h∶12 h,培养基采用过滤灭菌的天然海水,并根据Provasoli培养基加富,每3 d更换一次在此环境条件下适应10 d,确保幼苗生长状态良好。
2.2 实验设计
适应状态良好的浒苔接种于新鲜培养基中,接种浓度为0.25 g/L(经预实验可知,该接种浓度可确保整个实验过程中充气状态下培养体系的pH基本稳定)。设置两个光强,分别为80、260 μmol/(m2·s),光周期为12 h∶12 h,培养温度为20°C。两个CO2浓度分别设置为400 μL/L(正常CO2浓度,记为LC)、1 000 μL/L(高CO2浓度,记为HC),LC、HC处理均在二氧化碳培养箱(RXZ-160B CO2培养箱、宁波江南仪器厂)中充气培养(LC:直接充室外空气;HC:CO2和空气的混合气体)。高光正常CO2、高光低CO2、低光高CO2和低光正常CO2处理分别记为HH、HL、LH和LL。
2.3 生长速率的测定
每2 d测定藻体的鲜质量,相对生长速率(RGR,单位:%·d-1)
RGR=100×(lnWn-lnW0)/(tn-t0)×100,
(1)
式中,Wn为tn天的藻体鲜质量。
2.4 色素的提取及测定
在光周期中期取0.02 g的藻体放入离心管中,加入100% 甲醇,4°C冰箱中过夜提取,之后离心,取上清液于酶标仪中进行全波段扫描(400~700 nm)。根据公式计算叶绿素a(Chla)、叶绿素b(Chlb)、类胡萝卜素(Car,cartenoids)的含量[16]:
CChla=15.65 A666-7.34 A653,
(2)
CChlb=27.05 A653-11.21 A666,
(3)
CCar=(1000 A470-2.86 CChla-129.2 CChlb)/221.
(4)
2.5 叶绿素荧光参数的测定
叶绿素荧光参数采用氙灯脉冲调制荧光仪(water-PAM)进行测定。
在光周期中期快速取样(1~2 min)进行快速光响应曲线和诱导曲线测定。样品暗处理15 min后测定叶绿素荧光诱导曲线,光化光强度设置为培养光强。
快速光响应曲线(RLC)的测定使用8个光强梯度[226、337、533、781、1 077、1 593、2 130和2 854 μmol/(m2·s)]的光化光,每个光强处理时长设定为10 s。 相对电子传递速率(rETR)通过以下的公式计算:
rETR=yield×0.5×PFD,
(5)
式中,yield代表光系统Ⅱ的有效光化学效率,系数0.5代表光系统Ⅱ吸收的光量子占总量的50%,PFD(photon flux density)代表光化光的强度[μmol/(m2·s)]。快速光响应曲线根据Webb 等[17]进行拟合,公式如下:
rETR=rETRmax×(1-eαx/rETRmax),
(6)
Ik=rETRmax/α.
(7)
2.6 抗氧化活性测定
SOD活性测定采用氮蓝四唑法[18],CAT的测定采用过氧化氢法(H2O2)。取0.1 g样品洗净后置于预冷的研钵中,加1.6 mL 50 mmol/L预冷的磷酸盐缓冲液(pH 7.8)在冰浴上研磨成匀浆。转入离心管在4℃、10 000 g下离心20 min,上清液即为酶液。SOD测定取3 mL反应混合液[甲硫氨酸溶液、EDTA-Na2、磷酸缓冲液(pH 7.8)和氮蓝四唑溶液]和30 μL酶液于试管中,将试管置于光照培养箱中在4 000 lx光照下反应20 min,测定OD560值,通过公式计算SOD活性;CAT的测定取3 mL反应液[磷酸缓冲液(pH 7.0)和30%的H2O2]加入0.1 mL酶液,测定OD240(紫外)值(测定40 s),通过公式计算CAT酶活。
2.7 可溶性蛋白含量测定
考马斯亮蓝G250法测定。处理方法同上,获得浒苔酶液提取液。取20 μL提取液加入80 μL,0.05 mol/L,pH 7.8磷酸缓冲液,再加入2.9 mL考马斯亮蓝G250溶液,充分混合,反应2 min后测定OD595,并通过标准曲线计算出蛋白质含量。可溶性蛋白的标准曲线:y=6.025x-0.023 5,R2=0.999 5。
2.8 可溶性糖的测定
蒽酮硫酸比色法测定。取0.1 g的新鲜浒苔,用纯水定容至10 mL,沸水浴1 h,过滤,残渣再沸水浴两次,每次30 min,合并滤液,取1 mL待测液,缓慢加入3 mL蒽酮试剂(2.0 g/L),立即沸水浴10 min,然后冷却至室温,检测其OD620值,并通过标准曲线计算可溶性糖的量。葡萄糖标准曲线:y=0.035 9x-0.005 8,R2=0.997 6(含量范围0~80 μg)。
2.9 数据分析
数据处理使用Origin 7.0软件,采用One-Way ANOVA,Turkey进行显著性分析,设显著水平为p<0.05,通过在图中或者表格中标注不同的小写字母来表示差异显著性。
3 结果和分析
3.1 不同处理下的生长和色素含量
正常CO2条件下,光强增加显著提高了浒苔幼苗的生长(p=0.008),表现为相对生长速率增加58%,但在高CO2条件下,光强对浒苔幼苗的生长影响不显著(p=0.809)。低光条件下,CO2浓度升高显著增加了浒苔幼苗的生长(p=0.006),增幅约为45%,而在高光条件下,CO2浓度升高抑制了浒苔幼苗的生长,约降低11%,但其差异性不显著(p=0.392)(图1)。

图1 不同CO2和光强处理对浒苔幼苗生长的影响Fig.1 Effects of different CO2 and light intensity on the growth of U. prolifera seedling数值为平均值±标准偏差,n=3;横坐标代表不同的处理,其中,HH、HL、LH和LL分别代表高光高CO2、高光正常CO2、低光高CO2和低光正常CO2处理,不同字母表示不同处理间差异显著(p < 0.05)Data=mean+SD,n=3;the X axis represents different treatments,HH,HL,LH,LL represent high light and high CO2,high light and normal CO2,low light and high CO2,low light and normal CO2 treatment respectively. Different letters indicated significant difference between treatments(p<0.05)
在整个实验过程中,浒苔幼苗的Chla、Chlb及类胡萝卜素的含量分别维持在988 μg/g、751 μg/g、174 μg/g,不同处理间差异不显著(见图2),相比于其他处理,低光正常CO2条件下,Chla与Chlb含量的比值(CChl a/CChl b)降低,而CChl a/CCar的值升高,同时,CChl b/CCar的值也略有增加(表1)。

表1 不同CO2和光强处理对浒苔幼苗Chl a、Chl b与Car含量比值的影响Tab.1 Effects of different CO2 and light intensity on the ratios of chlorophyll a、b and cartenoids of U. prolifera seedling
注:数值为平均值±标准偏差,n=3。
图2 不同CO2和光强处理对浒苔幼苗光合色素的影响Fig.2 Effects of different CO2 and light intensity on the photosynthesis pigments of U. prolifera seedling数值=平均值±标准偏差,n=3; HH、HL、LH和LL和不同字母表示的含义同图1Data=mean+SD,n=3; HH,HL,LH,LL and all letters showed the same meaning as that in Figure 1
3.2 不同处理下的光化学参数
相比于低光处理,高光处理下的浒苔幼苗最大光合效率略有增加,但差异不显著(p>0.06),而有效光化学效率在低光下的值显著高于高光处理(低CO2:p=0.012;高CO2:p=0.019 )。相比于光强变化,CO2浓度变化对浒苔幼苗光合效率的影响差异不显著(图3)。浒苔幼苗的相对电子传递速率在高光高CO2条件下较高(见图4)。根据图4计算出的相对电子传递速率、饱和光强、光能利用效率如表2所示。相对于低光处理,高光处理的浒苔幼苗在高、低CO2条件下相对电子传递速率(rETR)增强,但差异不显著;同时饱和光强(Ek)也增强;相比于正常CO2处理,高CO2条件下浒苔幼苗的rETRmax、Ek均升高,而表观光能利用效率(α)则呈现相反趋势。

图3 不同CO2和光强处理对浒苔幼苗叶绿素荧光效率的影响Fig.3 Effects of different CO2 and light intensity on the chlorophyll fluorescence efficiency of U. prolifera seedlingA为最大光合效率(Fv/Fm);B为有效光合效率(Fv′/Fm′);数值为平均值±标准偏差,n=3;HH、HL、LH和LL和不同字母表示的含义同图1A is Fv/Fm and B is Fv′/Fm′; data=mean+SD,n=3; HH,HL,LH,LL and all letters showed the same meaning as that in Figure 1
3.3 不同处理下的抗氧化活性
相比于高光处理,浒苔幼苗的超氧化物歧化酶(SOD)的活性在低光条件下显著增加,高、正常CO2处理下,增幅约为57%、42%。相比于正常CO2浓度处理,低光下,高CO2处理的浒苔幼苗具有略高的活性,但差异不显著(p=0.502)(见图5A)。过氧化氢酶(CAT)的活性在不同处理间差异显著,低光条件下,CO2浓度升高,其活性显著提高(p=0.008)。而高光条件下,尽管差异不显著(p=0.124),但CO2浓度升高提高了CAT的活性。总体来讲,其活性随着CO2浓度的增加而升高(图5B)。

表2 浒苔幼苗正常CO2和高CO2及不同光强下的光合作用速率(rETR)与光强关系的最佳拟合参数Tab.2 The fitted parameters derived from rapid light curves of U. prolifera seedling grown under both normal,high CO2and different light intensities
注:Ek为饱和光强 [μmol/(m2·s)],rETRmax为最大相对电子传递速率,α为表观光能利用效率;数据为平均值±标准偏差,n=3;HH、HL、LH和LL表示的含义同图1。

图4 不同CO2和光强处理对浒苔幼苗相对电子传递速率的影响Fig.4 Effects of different CO2 and light intensity on the rETR of U. prolifera seedling数值为平均值±标准偏差,n=3; HH、HL、LH和LL表示的含义同图1Data=mean+SD,n=3; HH,HL,LH,LL showed the same meaning as that in Figure 1

图5 不同CO2和光强处理对浒苔幼苗SOD (A) 和CAT (B) 活性的影响Fig.5 Effects of different CO2 and light intensity on the SOD (A) and CAT (B) of U. prolifera seedling数值为平均值±标准偏差,n=3;HH、HL、LH和LL和不同字母表示的含义同图1Data=mean+SD,n=3;HH,HL,LH,LL and all letters showed the same meaning as that in Figure 1
3.4 不同处理下的可溶性糖、可溶性蛋白等含量
相比于高光处理,低光条件下浒苔可溶性蛋白含量显著增加,在高、正常CO2条件下,增长幅度分别为:47%、13%。相比于高CO2处理,高光下正常CO2浒苔的可溶性蛋白含量增加显著,而低光下含量变化较小(p=0.108)(见图6A)。相比之下,可溶性糖的含量在各处理条件下基本保持稳定,各组之间并无显著差异。
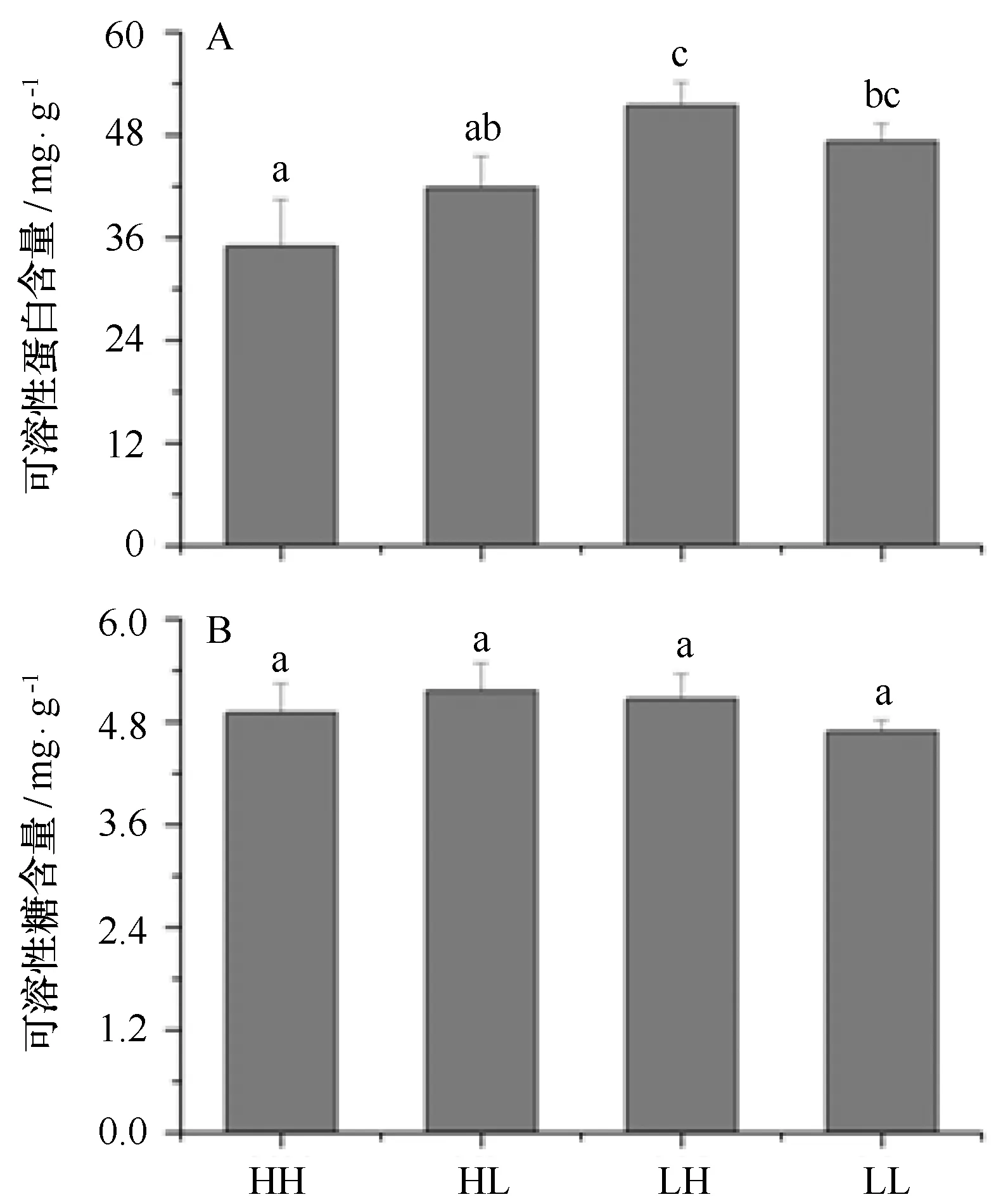
图6 不同CO2和光强处理对浒苔幼苗可溶性蛋白 (A) 和可溶性糖 (B) 含量的影响Fig.6 Effects of different CO2 and light intensity on the dissolved protein (A) and carbohydrate (B) of U. prolifera seedling数值为平均值±标准偏差,n=3;HH、HL、LH和LL和不同字母表示的含义同图1Data=mean+SD,n=3;HH,HL,LH,LL and all letters showed the same meaning as that in Figure 1
4 讨论
生长状况是体现藻类的最直观指标,每一种藻都有适宜的光强范围,当光照超过光补偿点时,藻体积累有机物才会生长[19—20]。叶绿素含量与藻类光合参数的变化是判断藻类是否正常生长的重要指标,决定着藻类吸收和转化光能的高低,在一定程度上反映了对光强的耐受能力[21]。光强提高在一定程度上为藻体的光合作用提供更多的光能,从而促进藻体生长。CO2浓度升高能促进大型海藻光合作用,这在过去的研究中多有体现[22—25]。其原因主要是,CO2浓度的升高,能够提高培养水体中的无机碳浓度,促进光合固碳作用,同时下调了藻体的无机碳浓缩机制,节省了能量[26],从而更利于藻体的生长。这与本研究中低光强处理的结果一致。而在高光条件下,高CO2浓度抑制了浒苔幼苗的生长。该现象在微藻中已有报道[12,27—28],然而在大型藻类中鲜有研究。本研究的结果显示,光强增加并未降低浒苔幼苗的Chla含量,其原因可能是光强处理的时间较短,对藻体叶绿素含量的响应没有得到及时的体现,也正因为如此,相比于低光强处理,CO2浓度增加为高光生长的浒苔幼苗提供了过多的能量。同时,SOD和CAT参与组成植物体内重要的抗氧化酶系统,起到减弱或清除自由基和过氧化物的毒害作用,可提高逆境胁迫下藻体对环境的耐受能力。本研究中,高光条件下,SOD和CAT活性较低,即表明适当提高光强,可增强藻体对光能的利用效率,促进藻体的生长[29],此时,CO2浓度升高,藻体无机碳浓缩机制下调,节省的部分能量加速了高光下的光抑制,进而在一定程度上抑制了浒苔幼苗的生长。
可溶性蛋白和可溶性糖含量的改变是植物感应所受胁迫环境的指标,在逆境胁迫环境下,通过改变糖和蛋白的含量水平来感应外界环境变化或提供必要的信号传导,调节植物的渗透压[29]。而碳水化合物含量的变化也可能直接或间接的影响光合作用器中的有关组分[30—31],并有可能阻碍CO2扩散进入叶绿体[32],进而影响光合作用。本研究结果显示,可溶性糖的变化趋势不明显,其含量维持在相对稳定的水平,主要是因为可溶性糖变化与渗透压调节有关,光照和CO2对浒苔渗透压影响较小,且处理时间较短,并未引起可溶性糖的变化。而可溶性蛋白含量的变化趋势在高光条件下降低,表明适当提高光强可提高浒苔的光合作用速率,在一定程度上进一步导致其可溶性蛋白的降低。
目前,世界范围内对海洋酸化的研究还处于起步阶段,尽管已经评估的物种约有100种[33],但有关海洋酸化的长期效应和对渔业资源的全部影响还尚不清楚。同时,大型绿藻种类丰富,分布广泛,且不同地区的优势种和关键种差异显著,故尽可能的选择多地区多种类的大型绿藻优势种,研究其对包括海水pH值变化在内的环境变化的响应,只有系统全面地认识海洋酸化对海洋各区域海洋生物及生态系统所产生的影响,才能找到有效的解决办法,减少环境变化带给人类的巨大损失。
[1] Haines A. Climate change 2001: the scientific basis. contribution of working group 1 to the third assessment report of the intergovernmental panel on climate change[J]. International Journal of Epidemiology,2003,32(2): 321-321.
[2] Sabine C L,Feely R A,Gruber N,et al. The oceanic sink for anthropogenic CO2[J]. Science,2004,305(5682): 367-371.
[3] Beardall J,Stojkovic S,Gao Kunshan. Interactive effects of nutrient supply and other environmental factors on the sensitivity of marine primary producers to ultraviolet radiation: implications for the impacts of global change[J]. Aquat Biol,2014,22: 5-23.
[4] Häder D P,Villafae V E,Helbling E W. Productivity of aquatic primary producers under global climate change[J]. Photochemical & Photobiological Sciences,2014,13(10): 1370-1392.
[5] Cai Weijun,Hu Xinping,Huang Weijen,et al. Acidification of subsurface coastal waters enhanced by eutrophication[J]. Nature Geoscience,2011,4(11): 766-770.
[6] Zhai W D,Zheng N,Huo C,et al. Subsurface pH and carbonate saturation state of aragonite on the Chinese side of the North Yellow Sea: seasonal variations and controls[J]. Biogeosciences,2014,11(4): 1103-1123.
[7] Roleda M Y,Morris J N,McGraw C M,et al. Ocean acidification and seaweed reproduction: increased CO2ameliorates the negative effect of lowered pH on meiospore germination in the giant kelpMacrocystispyrifera(Laminariales,Phaeophyceae)[J]. Global Change Biology,2012,18(3): 854-864.
[8] Bender D,Diaz-Pulido G,Dove S. The impact of CO2emission scenarios and nutrient enrichment on a common coral reef macroalga is modified by temporal effects[J]. Journal of Phycology,2014,50(1): 203-215.
[9] Olischläger M,Bartsch I,Gutow L,et al. Effects of ocean acidification on growth and physiology ofUlvalactuca(Chlorophyta) in a rockpool-scenario[J]. Phycological Research,2013,61(3): 180-190.
[10] Hofmann L C,Straub S,Bischof K. Elevated CO2levels affect the activity of nitrate reductase and carbonic anhydrase in the calcifying rhodophyteCorallinaofficinalis[J]. Journal of Experimental Botany,2013,64(4): 899-908.
[11] 徐军田,高坤山. 二氧化碳和阳光紫外辐射对龙须菜生长和光合生理的影响[J]. 海洋学报,2010,32(5): 144-151.
Xu Juntian,Gao Kunshan. The influence of carbon dioxide and solar UVR on the growth,photosynthesis and pigments contents ofGracilarialemaneiformis[J]. Haiyang Xuebao,2010,32(5): 144-151.
[12] Gao Kunshan,Xu Juntian,Gao Guang,et al. Rising CO2and increased light exposure synergistically reduce marine primary productivity[J]. Nature Climate Change,2012,2(7): 519-523.
[13] Li Y,Gao K,Villafae V E,et al. Ocean acidification mediates photosynthetic response to UV radiation and temperature increase in the diatomPhaeodactylumtricornutum[J]. Biogeosciences,2012,9(10): 3931-3942.
[14] Xu Juntian,Gao Kunshan,Li Yahe,et al. Physiological and biochemical responses of diatoms to projected ocean changes[J]. Marine Ecology Progress Series,2014,515: 73-81.
[15] 吕永林,张永普,李凯,等. 浙江洞头大竹屿岛潮间带大型底栖生物多样性[J]. 生态学杂志,2011,30(4): 707-716.
Lv Yonglin,Zhang Yongpu,Li Kai,et al. Macrobenthos diversity in intertidal zone of Dazhuyu Island,Dongtou County of Zhejiang Province[J]. Chinese Journal of Ecology,2011,30(4): 707-716.
[16] Wellburn A R. The spectral determination of chlorophyllsaandb,as well as total carotenoids,using various solvents with spectrophotometers of different resolution[J]. Journal of Plant Physiology,1994,144(3): 307-313.
[17] Webb W L,Newton M,Starr D. Carbon dioxide exchange ofAlnusrubra[J]. Oecologia,1974,17(4): 281-291.
[18] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2000: 267-268.
Li Hesheng. Experimental principle and technology of plant physiology and biochemistry[M]. Beijing:Higher Education Press, 2000:267-268.
[19] Lapointe B E,Tenore K R,Dawes C J. Interactions between light and temperature on the physiological ecology ofGracilariatikvahiae(Gigartinales: Rhodophyta)[J]. Marine Biology,1984,80(2): 161-170.
[20] 刘雅萌,徐军田,李信书,等. 不同增殖方式来源的绿潮藻浒苔藻体生长及光合生理特性差异[J]. 水产学报,2014,38(5): 691-696.
Liu Yameng,Xu Juntian,Li Xinshu,et al. The effects of different proliferative ways for the green tide algaUlvaproliferaon their growth and photophysiological performances[J]. Journal of Fisheries of China,2014,38(5): 691-696.
[21] Havaux M,Tardy F. Thermostability and photostability of photosystem Ⅱ in leaves of theChlorina-f2 barley mutant deficient in light-harvesting chlorophylla/bprotein complexes[J]. Plant Physiology,1997,113(3): 913-923.
[22] Zou Dinghui. Effects of elevated atmospheric CO2on growth,photosynthesis and nitrogen metabolism in the economic brown seaweed,Hizikiafusiforme(Sargassaceae,Phaeophyta)[J]. Aquaculture,2005,250(3/4): 726-735.
[23] Wu Hongyan,Zou Dinghui,Gao Kunshan. Impacts of increased atmospheric CO2concentration on photosynthesis and growth of micro-and macro-algae[J]. Science in China Series C: Life Sciences,2008,51(12): 1144-1150.
[24] Xu Zhiguang,Zou Dinghui,Gao Kunshan. Effects of elevated CO2and phosphorus supply on growth,photosynthesis and nutrient uptake in the marine macroalgaGracilarialemaneiformis(Rhodophyta)[J]. Botanica Marina,2010,53(2): 123-129.
[25] 邹定辉,高坤山. 高CO2浓度对大型海藻光合作用及有关过程的影响[J]. 生态学报,2002,22(10): 1750-1757.
Zou Dinghui,Gao Kunshan. Effects of elevated CO2concentration on the photosynthesis and related physiological processes in marine macroalgae[J]. Acta Ecologica Sinica,2002,22(10): 1750-1757.
[26] 邓亚运,邹定辉. 大气CO2浓度升高对不同氮生长条件下的两种大型海藻光合作用的影响[J]. 生态学杂志,2014,33(6): 1520-1527.
Deng Yayun,Zou Dinghui. Effects of elevated atmospheric CO2on photosynthesis ofGracilarialemaneiformisandUlvaconglobatagrown at low and high N supplies[J]. Chinese Journal of Ecology,2014,33(6): 1520-1527.
[27] Li Yahe,Xu Juntian,Gao Kunshan. Light-modulated responses of growth and photosynthetic performance to ocean acidification in the model diatomPhaeodactylumtricornutum[J]. PLoS One,2014,9(5): e96173.
[28] Li Gang,Campbell D A. Rising CO2interacts with growth light and growth rate to alter photosystem Ⅱ photoinactivation of the coastal diatomThalassiosirapseudonana[J]. PLoS One,2013,8(1): e55562.
[29] 朱政,蒋家月,江昌俊,等. 低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J]. 安徽农业大学学报,2011,38(1): 24-26.
Zhu Zheng,Jiang Jiayue,Jiang Changjun,et al. Effects of low temperature stress on SOD activity,soluble protein content and soluble sugar content inCamelliasinensisleaves[J]. Journal of Anhui Agricultural University,2011,38(1): 24-26.
[30] Nie G,Hendrix D L,Webber A N,et al. Increased accumulation of carbohydrates and decreased photosynthetic gene transcript levels in wheat grown at an elevated CO2concentration in the field[J]. Plant Physiology,1995,108(3): 975-983.
[31] Gesch R W,Boote K J,Vu J C V,et al. Changes in growth CO2result in rapid adjustments of ribulose-1,5-bisphosphate carboxylase/oxygenase small subunit gene expression in expanding and mature leaves of rice[J]. Plant Physiology,1998,118(2): 521-529.
[32] Makino A,Mae T. Photosynthesis and plant growth at elevated levels of CO2[J]. Plant and Cell Physiology,1999,40(10): 999-1006.
[33] Kroeker K J,Kordas R L,Crim R,et al. Impacts of ocean acidification on marine organisms: quantifying sensitivities and interaction with warming[J]. Global Change Biology,2013,19(6): 1884-1896.
The effects of light and increased CO2on the growth and physiological performances in marine green algae Ulva prolifera seedling
Gao Xiuxiu1,2,Li Yahe1,2,Duan Weijun3,Xu Nianjun1,2
(1.KeyLaboratoryofAppliedMarineBiotechnologyofMinistryofEducation,NingboUniversity,Ningbo315211,China; 2.KeyLaboratoryofMarineBiotechnologyofZhejiangProvince,Ningbo315211,China; 3.NingboEntry-ExitInspectionandQuarantineBureauTechnologyCentre,Ningbo315012,China)
Ocean acidification due to increasing anthropogenic CO2is expected to influence marine primary productivity. In order to investigate the interactive effects of increased light and CO2changes on macroalgae,we grewUlvaproliferaseedling under the normal CO2level (400 μL/L) and elevated CO2level (1 000 μL/L) conditions,the light levels set as 80 and 260 μmol/(m2·s),and measured its physiological performance. Research finding that the specific growth rate and activity of SOD was highest under high light and normal CO2level . However,the activity of CAT showed the highest value under the high CO2and low light conditions. Under the different treatments,there was no significant effect on the chlorophyllaand maximal photochemical yield of PSⅡ (Fv/Fm),while the largest ratios of chlorophylla to carotenoid occurred at nomal CO2and low light conditions. Meanwhile,the content of soluble protein was decreased by high light and high CO2.
CO2; light;Ulvaproliferaseedling; chlorophyll fluorescence efficiency; Antioxidant activity
10.3969/j.issn.0253-4193.2015.10.008
2015-02-11;
2015-07-21。
国家自然科学基金项目(40876073, 41276122);国家教育部博士点基金博导基金(20123305110002); 宁波大学学科项目(XKL14D2085);宁波大学科研启动项目(F01259144702)。
高秀秀(1989—),女,山东省济南市人,主要研究藻类生理与分子生物学。E-mail:ggaoxiuxiu@163.com
*通信作者:徐年军(1973—),男,湖北省赤壁市人,博士,博士生导师,研究员,主要研究方向为海洋天然药物,海洋生物资源综合利用等。E-mail:xunianjun@nbu.edu.cn
S917.3
A
0253-4193(2015)10-0080-08
高秀秀,李亚鹤,段维军,等. 光强和二氧化碳浓度变化对浒苔幼苗生长及生理的影响[J].海洋学报,2015,37(10):80—87,
Gao Xiuxiu,Li Yahe,Duan Weijun,et al. The effects of light and increased CO2on the growth and physiological performances in marine green algaeUlvaproliferaseedling[J]. Haiyang Xuebao,2015,37(10):80—87,doi:10.3969/j.issn.0253-4193.2015.10.008
