食盐质量浓度对传统自然发酵圆白菜的菌系结构和代谢的影响
2015-01-04李军波关倩倩
熊 涛,李军波,彭 飞,关倩倩
食盐质量浓度对传统自然发酵圆白菜的菌系结构和代谢的影响
熊 涛,李军波,彭 飞,关倩倩
(南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047)
以2、5、8 g/100 mL食盐添加量的传统自然发酵泡菜为研究对象,比较了3种不同食盐质量浓度的传统自然发酵泡菜中优势菌系结构、卤水pH值和总酸、底物和代谢产物、亚硝酸盐含量的变化。结果表明:乳酸菌主导整个泡菜发酵过程,蔗糖一直被代谢利用,葡萄糖和果糖含量逐步增加,发酵结束时乳酸大量积累。食盐质量浓度对泡菜发酵前期有显著影响,2 g/100 mL食盐质量浓度的泡菜中乳酸菌的繁殖代谢最快,发酵结束时pH值最低,总酸含量最高;5 g/100 mL食盐质量浓度能较好地抑制有害微生物的繁殖,最快通过亚硝峰,产生的乙醇量最高;8 g/100 mL食盐质量浓度抑制了泡菜中乳酸菌的繁殖代谢,使泡菜的成熟期延迟,对蔗糖的利用率最低。
泡菜;食盐质量浓度;乳酸菌;发酵;代谢
我国传统四川泡菜以自然发酵为主,是利用原料表面自带的微生物在中低质量浓度盐水(2~10 g/100 mL)里厌氧或兼性厌氧泡渍发酵,具有益生功能的乳酸菌主导着泡菜发酵过程[1]。现有研究发现卤水盐质量浓度不仅影响泡菜的咸味,还影响泡菜发酵过程中微生物的结构,从而直接和间接地影响泡菜的风味[2]。尽管有研究表明卤水盐浓度的改变能引起泡菜发酵过程中微生物的结构变化[3-4],泡菜发酵过程中卤水pH值和总酸、还原糖以及亚硝酸盐的变化规律已有研究[5-6],然而尚缺少卤水盐质量浓度与泡菜发酵过程中微生物的消长、底物消耗、代谢产物合成的关联性研究。本实验结合四川泡菜的食盐质量浓度特点,研究3种不同食盐质量浓度(2、5、8 g/100 mL)泡菜中卤水的pH值及总酸、乳酸菌、酵母菌、多种糖类、有机酸、亚硝酸盐的变化。通过比较传统发酵泡菜在不同食盐质量浓度下优势微生物的消长规律、底物及代谢产物的变化,旨在揭示食盐质量浓度对泡菜发酵特性的影响,期望对传统自然发酵泡菜的工业化生产提供科学依据和理论指导。
1 材料与方法
1.1材料
圆白菜、食盐、冰糖、生姜、大蒜、干辣椒、花椒等购于当地市场。
1.2试剂与培养基
氢氧化钠、浓硫酸、无水对氨基苯磺酸、盐酸萘乙二胺、亚铁氰化钾、乙酸锌、硼砂、亚硝酸钠(均为分析纯)国药集团化学试剂有限公司;蔗糖、葡萄糖、果糖、乙醇、柠檬酸、乳酸、乙酸标准品(均为色谱纯)美国Sigma公司。
乳酸菌分离计数培养基:MRS培养基,参见GB 4789.35—2010《食品微生物学检验乳酸菌检验》;酵母菌分离计数培养基:虎红琼脂北京奥博星公司。
1.3仪器与设备
Agilent 1260型高效液相色谱美国安捷伦公司;Aminex-87H色谱柱美国Bio-Rad公司;PHS-25型pH计上海精密科学仪器有限公司;SP-725分光光度计上海普光仪器有限公司。
1.4 传统泡菜制作方法

配方:圆白菜1 000 g、冷却的开水2 000 mL、大蒜60 g、花椒30 g、辣椒80 g、生姜40 g、冰糖80 g、分别向冷却的开水中加入40、100、160 g食盐配制成2、5、8 g/100 mL的盐水溶液。
1.5 分析方法
1.5.1取样
制作好泡菜后每隔12 h在无菌条件下取样泡菜液(10 mL),取样前将泡菜液摇匀,取样时间为7 d。
1.5.2优势微生物的分离计数
取1 mL泡菜液加入到9 mL无菌生理盐水中,适当稀释后选择3个合适的梯度稀释液,分别取100μL涂布于MRS固体培养基和虎红固体培养基,每个梯度做2次平行涂布。将MRS固体培养基置于37 ℃培养箱培养48 h,虎红固体培养基置于30 ℃培养箱培养3~5 d后计数。
1.5.3 pH值和总酸含量的测定
用pH计测定卤水pH值。总酸含量测定按GB/T 12456—2008《食品中总酸的测定》的方法测定总酸含量(g/L,以乳酸计)。
1.5.4亚硝酸盐含量的测定
泡菜中亚硝酸盐含量按GB/T 5009.33—2010《食品中亚硝酸盐与硝酸盐的测定》中盐酸萘乙二胺法测定。
1.5.5发酵液中糖和有机酸含量的测定
将泡菜液在12 000 r/min条件下离心10 min,取上清液经0.22μm水系滤膜过滤,得到的滤液用于高效液相色谱分析。色谱条件:进样量20μL,流动相为6 mmol/L硫酸溶液,流速为0.5 mL/min,柱温45 ℃,紫外检测器检测波长205 nm[7]。选用示差折光检测器检测糖醇(蔗糖、葡萄糖、果糖、乙醇)含量,紫外检测器检测有机酸(柠檬酸、乳酸、乙酸)含量。
2 结果与分析
2.1 3 种食盐质量浓度泡菜发酵过程中pH值和总酸含量的变化
pH值和酸度会影响到泡菜的风味,当卤水pH值为3.5~3.8,即认为泡菜已成熟[8]。成品泡菜的pH值控制在3.0左右,乳酸控制在1%左右效果最佳[9]。有研究表明泡菜发酵过程的启动菌以代谢周期短、耐酸性差的肠膜明串珠菌为主,代谢中后期是由耐酸性较强的同型乳酸菌(如:植物乳杆菌)主导[10-11]。在发酵的前3 d,乳酸菌快速繁殖并产生有机酸使卤水pH值快速降低。
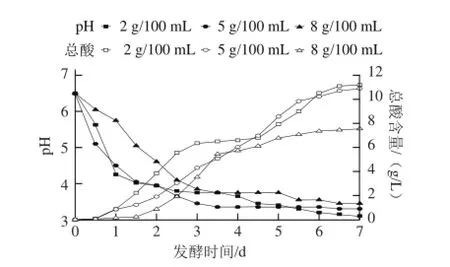
图1 3 种食盐质量浓度泡菜发酵过程中pH值和总酸含量的变化Fig.1 Changes in pH and total acid during the fermentation process ofpickled cabbage with three addition amounts of salt
如图1所示,3种食盐质量浓度的泡菜pH值在前1.5 d均急剧下降,然而5 g/100 mL食盐质量浓度泡菜pH值先于另外2种食盐质量浓度泡菜达到稳定(pH 3.3)。这可能是因卤水盐质量浓度不同产生的渗透压不同所导致,1 g/100 mL食盐溶液可以产生61.17 kN/m2的渗透压,而大多数微生物细胞的渗透压为30.17~61.15 kN/m2[12]。而2 g/100 mL食盐质量浓度泡菜中可能存在一些不耐盐的杂菌,与乳酸菌之间存在着一定的竞争关系,减缓了卤水pH值的下降;8 g/100 mL的食盐质量浓度产生的渗透压远高于乳酸菌的细胞液渗透压,可能抑制了乳酸菌的繁殖和代谢,从而减缓了卤水pH值的下降。发酵中后期卤水中的乳酸和H+大量积累,影响了菌体产酸[13];3种不同食盐质量浓度泡菜的pH值变化在发酵中后期下降缓慢。不同食盐质量浓度的pH值变化并不相同,2 g/100 mL和8 g/100 mL食盐质量浓度泡菜的pH值先出现短暂的稳定(pH 3.75)然后缓慢下降,而5 g/100 mL食盐质量浓度泡菜的pH值一直维持在3.3左右。发酵结束时,2 g/100 mL食盐质量浓度泡菜pH值最低(3.15),8 g/100 mL食盐质量浓度泡菜pH值最高(3.45)。发酵过程中,5 g/100 mL食盐质量浓度泡菜的酸度一直保持稳定的上升,最终总酸达到10.9 g/L;2 g/100 mL和8 g/100 mL食盐质量浓度泡菜的酸度前期会快速升高然后出现一个相对稳定的过程,之后又缓慢上升,最终总酸含量分别达到11.2 g/L和7.6 g/L。
2.2 3 种食盐质量浓度泡菜发酵过程中优势微生物的变化
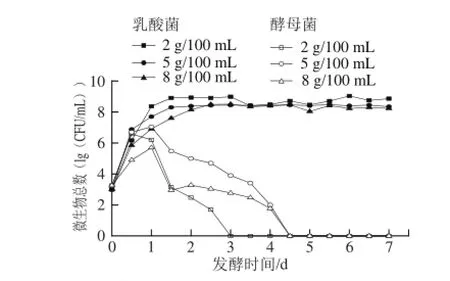
图2 3 种食盐质量浓度泡菜发酵过程中微生物总数的变化Fig.2 Changes in latic acid bacteria and yeast counts during the fermentation process of pickled cabbage with three addition amounts of salt
泡菜发酵初期不仅有有益微生物(如:乳酸菌、酵母菌和醋酸菌),还有有害微生物(如:丁酸菌、腐败细菌、霉菌等),其中乳酸菌和酵母菌占主要部分[8]。如图2所示,启动发酵时乳酸菌数在103CFU/mL,且在2 d内快速生长至108CFU/mL,发酵中后期乳酸菌数始终保持在108CFU/mL。然而,在发酵前期乳酸菌在不同食盐质量浓度下的生长情况存在较大差异,2、5、8 g/100 mL食盐质量浓度泡菜中的乳酸菌含量分别在第1、1.5、2天时达到108CFU/mL;其中2 g/100 mL食盐质量浓度泡菜在第1~3.5天均高于另外2种食盐质量浓度泡菜,可能是2 g/100 mL的食盐溶液产生的渗透压对乳酸菌的代谢繁殖抑制作用最弱所致。在3种食盐质量浓度泡菜发酵的中后期乳酸菌数始终保持在108CFU/mL,该结果与现有研究结果[8,14]一致。但发酵中后期5 g/100 mL食盐质量浓度泡菜中乳酸菌数量保持比较稳定,而2 g/100 mL和8 g/100 mL食盐质量浓度泡菜中乳酸菌数先升高后下降,可能是由卤水的pH值和食盐质量浓度的差异导致[13,15]。
泡菜发酵启动时酵母菌数量为103CFU/mL,在发酵的第1天内均出现快速增长期。酵母菌在不同食盐质量浓度的泡菜中繁殖速率有差异,2、5、8 g/100 mL食盐质量浓度泡菜中的酵母菌数量分别在第0.5、1、1天时达到106、107、105CFU/mL,然后逐渐减少,最后消亡。可能是随着异型乳酸菌和酵母菌代谢产生的二氧化碳造成了厌氧环境、卤水pH值降低、酸度增加使酵母菌逐渐消亡[16-17]。2 g/100 mL食盐质量浓度的泡菜中酵母在第3天消亡,而含盐量为5 g/100 mL和8 g/100 mL泡菜的卤水中酵母菌在第4.5天时才消亡,可能是在相对的高盐环境下产生了一些耐盐酵母[18-19]。这与曾骏等[20]研究认为“传统四川泡菜发酵过程中酵母菌数量会先增加后减少,5 d后消失”的结果一致。
2.3 3种食盐质量浓度泡菜发酵过程中底物含量的变化
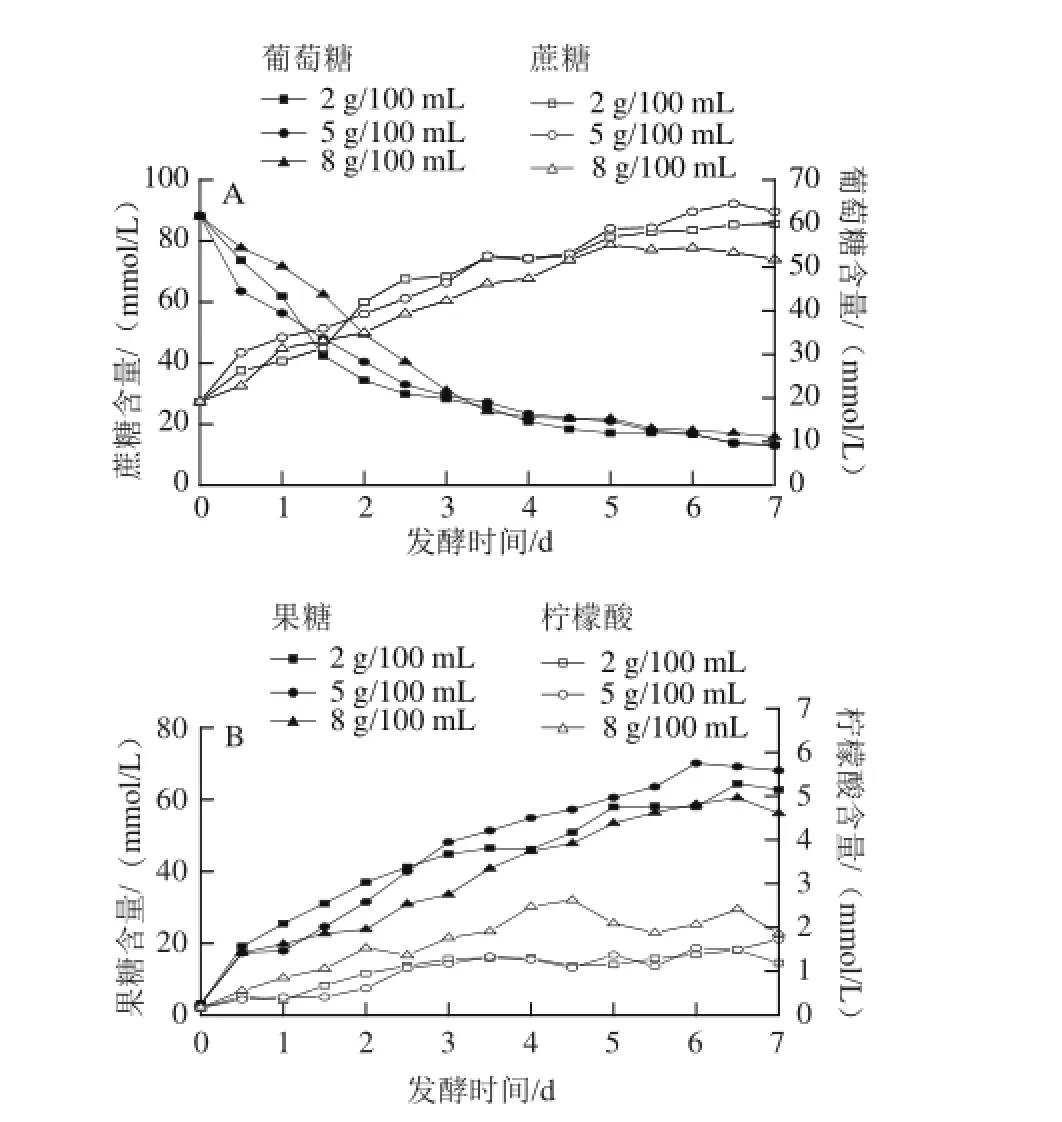
图3 3 种食盐质量浓度泡菜发酵过程中蔗糖、葡萄糖(A)、果糖、柠檬酸(B)含量的变化Fig.3 Changes in sucrose (A), glucose, fructose and citric acid (B) contents during the fermentation process of pickled cabbage with three addition amounts of salt
发酵过程中,蔗糖、葡萄糖、果糖为微生物提供碳源,其中的蔗糖主要源于发酵时加入的冰糖,蔗糖作为发酵的初始碳源,供给体系中微生物代谢。如图3A所示,3种不同食盐质量浓度泡菜卤水中蔗糖在发酵前期被快速代谢,泡菜在发酵中后期对蔗糖的利用趋于稳定。泡菜发酵前期由肠膜明串珠菌主导,其可以产生高效的葡萄糖蔗糖酶,葡萄糖蔗糖酶能将蔗糖转换化为葡萄糖和果糖[21];此外一些细菌(如:醋酸菌)和真菌(如:霉菌和酵母菌)的繁殖也会代谢蔗糖[21-22],导致了蔗糖前期被快速代谢。泡菜发酵中后期由同型乳酸发酵菌株(如:植物乳杆菌)主导,其对蔗糖的利用能力较异型发酵菌株弱[23];另一方面乳酸的大量积累、卤水pH值的降低等抑制了菌的代谢活动,使蔗糖的利用减慢。然而在发酵的前2.5 d,2 g/100 mL食盐质量浓度泡菜较另外2种泡菜蔗糖消耗量大,可能是在较低渗透压条件下细菌、霉菌、酵母菌代谢较强,从而蔗糖的消耗较快。在泡菜发酵的中后期,食盐质量浓度(2~8 g/100 mL)对菌株代谢蔗糖的影响较小,但发酵结束时,5 g/100 mL食盐质量浓度泡菜中蔗糖利用率最高,8 g/100 mL食盐质量浓度的最低。
卤水中葡萄糖和果糖一部分源于蔗糖的分解,另一部分是从原料中渗透出来。如图3所示,在整个发酵过程中葡萄糖和果糖的变化趋势相似,在发酵的前5 d稳步上升,之后趋于稳定,这可能是在整个发酵过程中微生物对葡萄糖和果糖的消耗量低于产生量所致。其中5 g/100 mL食盐质量浓度泡菜中葡萄糖和果糖的残留量最多,可能是该食盐质量浓度下的蔗糖利用率较高导致;8 g/100 mL食盐质量浓度泡菜中葡萄糖和果糖的残留量最少。柠檬酸是一种前体风味物质,对泡菜的风味存在重要的意义。3种食盐质量浓度泡菜中柠檬酸含量在前期均稳步升高,之后处于稳定状态。但不同食盐质量浓度泡菜中的柠檬酸最高含量并不相同,其中2、5、8 g/100 mL食盐质量浓度泡菜中柠檬酸的最高浓度分别为1.5、1.8、2.8 mmol/L,这可能是高渗透压有利于圆白菜中的柠檬酸渗入到卤水中导致。
2.4 3种食盐质量浓度泡菜发酵过程中代谢产物产量的变化
乳酸是泡菜中主要的有机酸,其含量直接影响泡菜中菌系的稳定性。泡菜在发酵初期乳酸菌含量相对较低,由产酸能力较差的异型乳酸菌(如:肠膜明串珠菌)主导,在泡菜发酵的中后期乳酸菌含量较高,由耐酸性较强、产酸能力强的同型乳酸菌(如:植物乳杆菌)主导[24]。
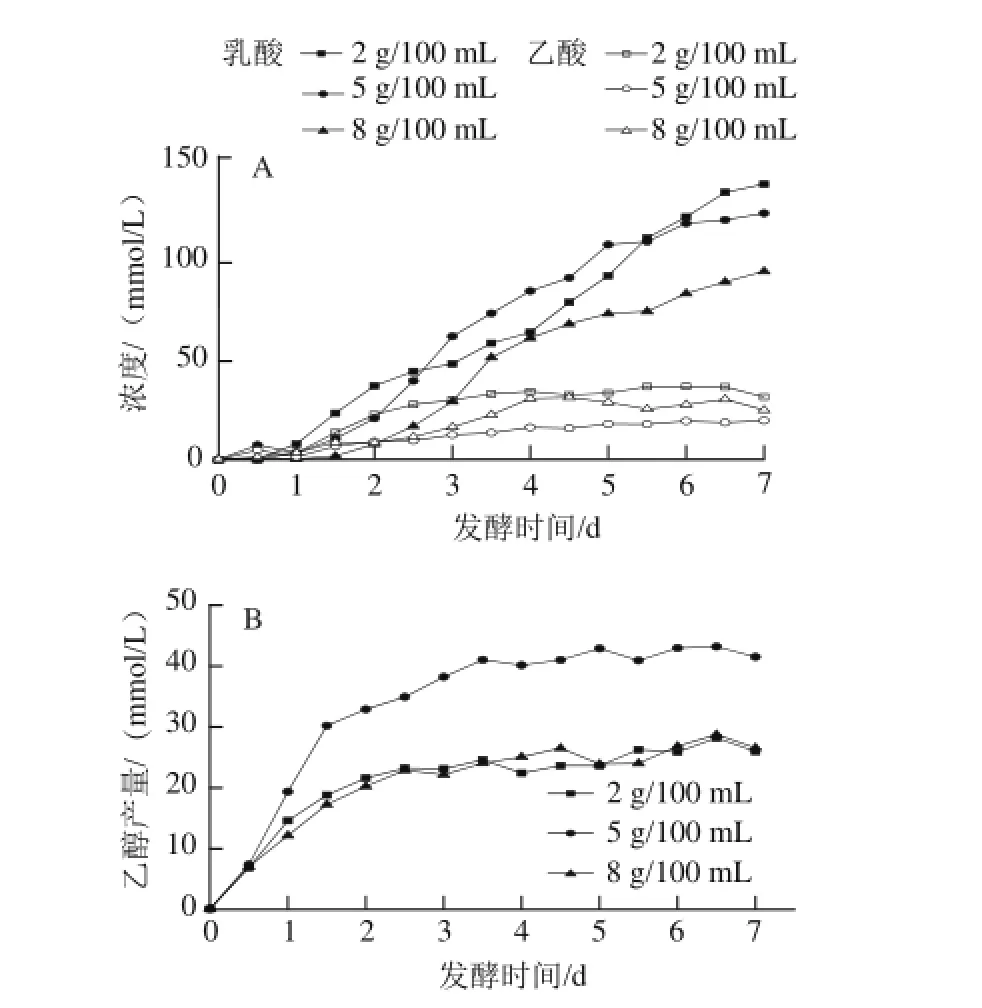
图4 3种食盐质量浓度泡菜发酵过程中乳酸和乙酸(A)、乙醇(B)产量的变化Fig.4 Changes in lactic acid, acetic acid (A) and ethanol (B) contents during the fermentation process of pickled cabbage with three addition amounts of salt
如图4所示,乳酸在发酵前2 d缓慢升高,第3~5天快速积累,之后又缓慢升高。尽管乳酸菌在发酵的前2 d已生长至108CFU/mL,与此同时蔗糖也被快速消耗,然而乳酸的积累量并不大。一方面是因为泡菜发酵前期由产酸能力较弱的异型乳酸菌(如:肠膜明串珠菌)主导[10];另一方面是卤水中存在较多能代谢蔗糖但不产乳酸的微生物(如:霉菌、酵母菌)。在泡菜发酵的中后期由产酸能力较强的同型乳酸菌(如:植物乳杆菌)主导[11],然而在随着发酵的进行,卤水中的乳酸和H+大量积累,乳酸菌需要消耗更多的能量来维持细胞内的pH值稳定,影响了菌体产酸[13],在发酵的第5~7天,乳酸积累较慢。其中2 g/100 mL食盐质量浓度泡菜乳酸产量在第1~2.5天高于另外2种食盐质量浓度泡菜,第3~5天5 g/100 mL食盐质量浓度泡菜乳酸产量高于另外2种食盐质量浓度泡菜,发酵后期乳酸的积累抑制乳酸菌生长和产酸,导致产乳酸速率下降。发酵结束时,2 g/100 mL食盐质量浓度泡菜乳酸产量最高(140 mmol/L),8 g/100 mL食盐质量浓度泡菜中乳酸产量最低(95 mmol/L)。总之,乳酸的产量与食盐质量浓度呈反比关系,杨瑞鹏等[15]通过对不同食盐质量浓度中乳酸菌区系的研究也证实了这一结论。
作为异型发酵乳酸菌的产物之一,适当浓度的乙酸可以有效地提高泡菜的感官性质[25]。异型乳酸发酵过程是葡萄糖经单磷酸己糖途径降解,在有氧条件下发酵产生乙酸[26-27]。乙酸主要是在发酵第1.5~4天变化稍快,在发酵末期趋于稳定。不同食盐质量浓度泡菜的乙酸含量并不相同,2 g/100 mL食盐质量浓度泡菜的卤水中乙酸产量最高,可能是2 g/100 mL食盐质量浓度泡菜的乳酸菌含量在第1.5~4天均高于其他2种食盐质量浓度泡菜,在此阶段异型乳酸菌产生了较多乙酸所致。乙酸与乙醇结合产生乙酸乙酯能增强泡菜的风味。泡菜液中乙醇主要来源于酵母菌和异型乳酸菌,在发酵前期酵母菌数最高达到106CFU/mL,乳酸菌数达到108CFU/mL,发酵前期大多乳酸菌都是异型乳酸菌,在缺氧条件下异型乳酸菌发酵产生乙醇[27]。乙醇产量从发酵启动开始到第2.5天急剧上升,在发酵中后期异型乳酸菌和酵母菌逐渐消亡[20,24],乙醇产量趋于稳定。此外,5 g/100 mL食盐质量浓度泡菜中乙醇产量在发酵结束时达到43.2 mmol/L,远高于另外2种食盐质量浓度的泡菜。一方面是因为在发酵前期5 g/100 mL食盐质量浓度泡菜中酵母菌数高于另外2种食盐质量浓度的泡菜,而且酵母菌的下降量相对另外2种食盐质量浓度的泡菜要缓慢,在第4.5天才消失;另一方面发酵启动到第1天5 g/100 mL食盐质量浓度泡菜中乳酸菌含量明显高于另外2种食盐质量浓度泡菜,在此阶段异型乳酸菌代谢积累乙醇。
2.5不同食盐质量浓度泡菜发酵过程中亚硝酸盐含量变化
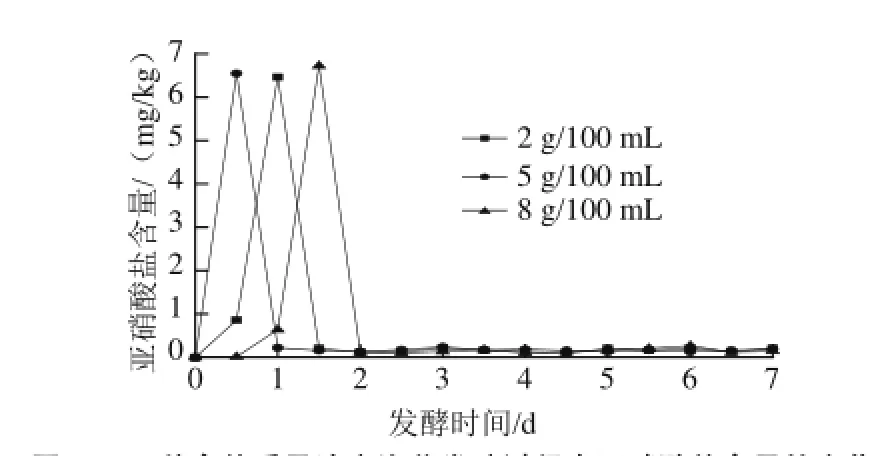
图5 3 种食盐质量浓度泡菜发酵过程中亚硝酸盐含量的变化Fig.5 Changes in nitrite content during the fermentation process ofpickled cabbage with three addition amounts of salt
自然发酵泡菜是利用存在蔬菜表面的微生物群进行发酵的,这种方式生产出来的泡菜中亚硝酸盐含量普遍偏高[28]。有研究表明硝酸还原酶的适宜pH值为7.10~7.15,发酵液pH值越小,亚硝酸盐的降解速率越快[29]。如图5所示,整个泡菜发酵过程卤水中亚硝酸含量变化存在一定的波动,3种食盐质量浓度的泡菜亚硝酸盐含量的最高峰均在6.5 mg/kg左右,但不同食盐质量浓度泡菜通过亚硝峰的时间不同,其中含5 g/100 mL食盐质量浓度的泡菜最先通过了亚硝峰。一方面可能是因为含盐量为5 g/100 mL的泡菜在0.5 d时pH值已经降至5.1,相对于其他食盐质量浓度的泡菜pH值更低,从而对硝酸还原酶的抑制作用更加强烈;另一方面可能是5 g/100 mL的食盐质量浓度能较好地抑制有害微生物的生长[2]。
3 结 论
通过对不同食盐质量浓度的传统自然发酵泡菜研究表明,乳酸菌在发酵前期快速繁殖,然后数量保持稳定;酵母菌数量先上升至106CFU/mL后逐渐消亡。食盐质量浓度主要是对泡菜发酵前期有显著影响,2 g/100 mL的食盐添加量泡菜中产生的渗透压最低,乳酸菌的繁殖代谢最快,酵母菌最先消亡;发酵结束时产生的乳酸含量最高(140 mmol/L),pH值最低(3.15),总酸含量最高(11.2 g/L)。5 g/100 mL的食盐添加量能较好地抑制有害微生物的繁殖,最快通过亚硝峰,发酵结束时乙醇产量最高(43.2 mmol/L),蔗糖利用率最高,葡萄糖和果糖的残留量最高,整个发酵过程中酸度稳定上升。8 g/100 mL食盐添加量减缓了泡菜中乳酸菌的繁殖代谢,使泡菜的成熟期延迟,对蔗糖的利用率最低。食盐质量浓度的改变引起卤水渗透压的变化,导致了发酵过程中菌系结构的不同,微生物的代谢出现差异,最终引起了泡菜中各指标的差异化。传统自然发酵泡菜中适宜的食盐添加量能提高泡菜品质,可进一步研究食盐添加量对泡菜感官和风味的影响,进而为我国传统自然发酵泡菜工业化生产提供可靠依据。
[1]陈功,夏有书,张其圣,等.从中国泡菜看四川泡菜及泡菜坛[J].中国酿造, 2010, 29(8): 5-8.
[2]杨瑞,张伟,陈炼红,等.发酵条件对泡菜发酵过程中微生物菌系的影响[J].食品与发酵工业, 2005, 31(3): 90-92.
[3]付莎莉,陈安均,蒲彪,等.食盐浓度对传统四川泡菜发酵过程中乳酸菌菌相的影响[J].食品与发酵工业, 2013, 39(8): 102-107.
[4] ZHAO Dayun, DING Xiaolin. Studies on the low-salt Chinese potherb mustard (Brassica juncea, Coss.) pickle. I: the effect of a homofermentativeL(+)-lactic acid producerBacillus coagulanson starter culture in the low-salt Chinese potherb mustard pickle fermentation[J]. LWT-Food Science and Technology, 2008, 41: 474-482.
[5]张锐.低盐榨菜自然发酵微生物群落动态的变化与功能分析[D].宁波:宁波大学, 2010.
[6]杨瑞,张伟,徐小会.泡菜发酵过程中主要化学成分变化规律的研究[J].食品工业科技, 2005, 26(2): 96-98.
[7] XIONG Tao, LI Xiao, GUAN Qianqian, et al. Starter culture fermentation of Chinese sauerkraut: growth, acidification and metabolic analyses[J]. Food Control, 2014, 41: 122-127.
[8]李文斌,宋敏丽,唐中伟,等.自然发酵泡菜微生物群落变化的研究[J].中国食物与营养, 2008(11): 22-24.
[9]李幼筠.泡菜与乳酸菌[J].中国酿造, 2001, 20(4): 7-9.
[10]尹曦.四川宜宾芽菜中乳酸菌菌相分析[D].雅安:四川农业大学, 2012.
[11] WOUTERS D, BERNAERT N, CONJAERTS W, et al. Species diversity, community dynamics, and metabolite kinetics of spontaneous leek fermentations[J]. Food Microbiology, 2013, 33: 185-196.
[12]天津轻工业学院,无锡轻工业学院.食品工艺学[M].北京:中国轻工业出版社, 1993: 66.
[13]闫征,王昌禄,顾晓波. pH值对乳酸菌生长和乳酸产量的影响[J].食品与发酵工业, 2002, 29(6): 35-38.
[14]翁佩芳,陈希,沈锡权,等.榨菜低盐腌制细菌群落多样性的分析[J].中国农业科学, 2012, 45(2): 338-345.
[15]杨瑞鹏,赵学慧.温度与食盐浓度对乳酸菌区系的影响[J].中国调味品, 1991, 16(8): 15-17.
[16]潘静,王昌禄.多耐性酒精酵母菌的选育及特性研究[J].中国酿造, 2011, 30(5): 113-116.
[17]单艺,张兰威.优选糯米酒腐木生假丝酵母菌Y-2生长性能及其酿造条件优化的研究[J].食品科技, 2007, 32(11): 40-45.
[18] TOKUOKA K,侯希君.耐糖和耐盐的酵母菌[J].齐齐哈尔师范学院学报, 1993, 13(4): 39-43.
[19]卫永华,齐威,王春玲,等.耐盐酵母在酱油中的应用及其耐盐机理的研究[J].中国酿造, 2012, 31(4): 25-28.
[20]曾骏,陈安均,蒲彪,等.传统四川泡菜中酵母菌的动态变化规律[J].食品科学, 2014, 35(7): 81-85. doi: 10.7506/spkx1002-6630-201407017.
[21] HYUN J E, DONG M S, NAM S H. Selecttion of psychrotrophicLeuconnstocspp. producing highly active dextransucrase from lactate fermented vegetables[J]. International Journal of Food Microniology, 2007, 117: 61-67.
[22] GULLO M, CAGGIA C, de VERO L, et al. Characterization of acetic acid bacteria in“traditional balsamic vinegar”[J]. International Journal of Food Microbiology, 2006, 106: 209-212.
[23] GOBBETTI M, CORSETTI A, ROSSI J. The sourdough microflora: interactions between lactic acid bacteria and yeasts: metabolism of carbohydrates[J]. Applied Microbiology and Biotechnology, 1994, 41(4): 456-460.
[24] XIONG Tao, GUAN Qianqian, SONG Shuhua, et al. Dynamic changes of lactic acid bacteria flora during Chinese sauerkraut fermentation[J]. Food Control, 2012, 26: 178-181.
[25] OLIVEIRA R P S, PEREGO P, OLIVEIRA M N, et al. Growth, organic acids profile and sugar metabolism ofBifidobacterium lactisin co-culture withStreptococcus thermophilus: the inulin effect[J]. Food Research International, 2012, 48: 21-27.
[26] GANZLE M G, VERMEULEN N, VOGEL R F. Carbohydrate, peptide and lipid metabolism of lactic acid bacteria in sourdough[J]. Food Microbiology, 2007, 24: 128-138.
[27] KANDLER O. Carbohydrate metabolism in lactic acid bacteria[J]. Antonie van Leeuwenhoek, 1983, 49: 209-224.
[28]郝明玉.直投式发酵泡菜与自然发酵泡菜的比较研究[D].南昌:南昌大学, 2013.
[29]唐爱明,夏廷斌.乳酸菌降解猪血培养基中亚硝酸盐的研究[J].肉类工业, 2004(9): 34-36.
Effect of Salt Concentration on Microbial Community Composition and Metabolism in Traditional Pickled Cabbage
XIONG Tao, LI Junbo, PENG Fei, GUAN Qianqian (State Key Laboratory of Food Science and Technology, College of Food Engineering, Nanchang University, Nanchang 330047, China)
In this paper, traditional pickled cabbages obtained by natural fermentation with different addition amounts of salt (2, 5 and 8 g/100 mL) were studied by comparing the dominant microorganisms, pH, total acid, substrates and metabolites and nitrite in pickling juices during fermentation. The results indicated that lactic acid bacteria were the dominant bacteria during the fermentation process, sucrose was steadily consumed, glucose and fructose were gradually accumulated, and lactic acid was accumulated to a high level at the end of fermentation. Salinity had a significant effect on the early stage of fermentation, and 2 g/100 mL salt could result in the highest reproduction and metabolism rate of lactic acid bacteria, the lowest pH and the highest total acid at the end of fermentation. In contrast, 5 g/100 mL salt had obvious inhibitory effect on the growth of harmful microorganisms and resulted in the highest speed to reach the nitrite peak. The addition of 8 g/100 mL salt could result in the lowest reproduction and metabolism rate of lactic acid bacteria and the lowest utilization rate of sucrose.
pickled cabbage; salt concentration; lactic acid bacteria; fermentation; metabolism
TS255.54
1002-6630(2015)11-0172-05
10.7506/spkx1002-6630-201511033
2014-07-10
“赣鄱英才555工程”领军人才培养计划项目(18000063);国家重点实验室自由探索课题(SKLF-ZZB-201309);国家高技术研究发展计划(863计划)项目(2011AA100904)
熊涛(1970—),男,教授,博士,研究方向为益生菌及大宗果蔬高值化利用。E-mail:xiongtao0907@163.com
