补充D-核糖对大鼠游泳及恢复期心肌、骨骼肌高能磷酸物质的影响
2015-01-03王亚坤孙文敬刘敬泽
王亚坤,李 梦,魏 转,孙文敬,4,刘敬泽,*
补充D-核糖对大鼠游泳及恢复期心肌、骨骼肌高能磷酸物质的影响
王亚坤1,2,李 梦2,魏 转3,孙文敬2,4,刘敬泽2,*
(1.河北师范大学旅游系,河北石家庄050024;2.河北师范大学生命科学学院,河北石家庄050024;3.河北化工医药职业技术学院制药工程系,河北石家庄050026;4.江苏大学 食品与生物工程学院,江苏镇江212013)
以负重游泳的大鼠为实验对象,采用高效液相色谱法同步测定肌肉样品内三磷酸腺苷(adenosine triphosphate,ATP)及其下游代谢产物和磷酸肌酸(phosphocreatine,PCr)等6种高能磷酸物质的含量,对补充D-核糖后大鼠心肌和腓肠肌内高能磷酸物质进行色谱分析,研究D-核糖对大鼠运动过程中及恢复期心脏及骨骼肌功能的恢复作用。结果表明:D-核糖显著提高了腓肠肌内ATP的合成速率,使机体在72 h内完全恢复运动过程中消耗的ATP,加速了运动后恢复期机体的能量供应水平恢复。同时,D-核糖显著提高了运动过程中心肌组织内ATP的含量,确保心肌组织的能量供应,维持了心脏的正常生理功能。
D-核糖;高能磷酸物质;高效液相色谱法;心肌;骨骼肌
D-核糖存在于所有细胞的能量代谢中,与腺苷酸的形成和三磷酸腺苷(adenosine triphosphate,ATP)的再生有关,是生命代谢最基本的能量来源,能促进局部缺血组织、局部缺氧组织的恢复,在心肌和骨骼肌代谢中起关键作用[1]。补充核糖可以消除心肌、骨骼肌细胞中磷酸戊糖途径的限速步骤,直接提高磷酸核糖焦磷酸(phosphoribosyl pyrophosphate,PRPP)水平,有利于加快心肌和骨骼肌中PRPP的合成速率,从而增加嘌呤核苷酸的生物合成,加快高强度运动后骨骼肌中嘌呤核苷酸水平的恢复,使ATP合成速率成倍地增加[2-4]。
本实验以负载游泳的大鼠为研究对象,在大鼠游泳过程中、游泳后恢复期灌胃补充D-核糖,分别于末次游泳运动后即刻(简称运动后即刻)、恢复72 h后取心脏和腓肠肌,采用高效液相色谱法(high performance liquid chromatography,HPLC)测定心肌和腓肠肌中ATP及其下游代谢产物二磷酸腺苷(adenosine diphosphate,ADP)、一磷酸腺苷(adenosine monophosphate,AMP)、次黄嘌呤核苷酸(hypoxanthine nucleotide,IMP)、磷酸肌酸(phosphocreatine,PCr)和肌酸(creatine,Cr)这6种高能磷酸物质的含量,观察D-核糖对运动过程中及运动后恢复期内各高能磷酸物质水平的影响。
1 材料与方法
1.1材料与试剂
ATP、ADP、AMP、IMP、PCr和Cr标准品(均为色谱纯)美国Sigma公司;甲醇(色谱纯)北京迪马科技有限公司;高氯酸(HClO4)、磷酸二氢钾(KH2PO4)、磷酸氢二钾(K2HPO4)、氢氧化钾(KOH)和四丁基氢氧化铵(tetrabutylammonium hydroxide,TBA)均为国产分析纯。
1.2仪器与设备
HPLC仪(含600泵、2487 UV检测器)美国Waters公司;电子天平德国赛多利斯科学仪器有限公司;Flexi-Dry冷冻干燥机美国F TS Systems公司;Milli-Q超纯水系统美国Millipore公司;微量移液器德国Eppendorf公司。
1.3方法
1.3.1动物模型建立与训练方案
1.3.1.1 动物分组
大鼠按体质量随机分为4组:1)正常对照组(NC组)5只,常规方法饲养,灌胃蒸馏水,剂量1 mL/(100 g·d)(按体质量计,下同);2)游泳对照组(SC组)10只,灌胃蒸馏水,剂量1 mL/(100 g·d),进行中等强度的游泳训练;3)核糖对照组(RC组)30只,常规方法饲养,灌胃核糖溶液。该组又分为3个不同剂量组(每组10只):低剂量核糖对照组(LC组)10 0 mg/(100 g·d)、中剂量核 糖对照组(MC组)300 mg/(100 g·d)、高剂量核糖对照组(HC组)600 mg/(100 g·d);4)核糖实验组(RT组)30只,灌胃核糖溶液,进行中等强度的游泳训练。该组又分为3个不同剂量组(每组10只):低剂量核糖实验组(LT组)100 mg/(100 g·d)、中剂量核糖实验组(MT组)300 mg/(100 g·d)、高剂量核糖实验组(HT组)600 mg/(100 g·d)。
1.3.1.2训练方案
适应性实验4周,做大鼠游泳筛选实验,正式实验4周,共8周。游泳在桶内进行,桶内壁光滑,直径45 cm,水深55 cm,水温34~36 ℃。大鼠每周训练5 d,每天游泳训练1次。第1周0负重,第2周负3%体质量的重物,第3周负4%体质量的重物,第4周负5%体质量的重物,前4周每周的第1天下水游20 min,以后逐日增加10 min,第5天时游泳60 min;第5周负5%体质量的重物,每天游泳60 min,此后维持这一运动强度进行游泳4周,共8周。
1.3.1.3样品制备
运动训练结束后立即随机选取各组大鼠5只,处死后取心脏和腓肠肌,用预冷的生理盐水冲洗后投入液氮冷冻,取材结束后将样品保存于-70℃冰箱保存。
运动训练 结束后剩余各组大鼠(除NC组外每组剩余5只)恢复72 h,处死后分别取心脏和腓肠肌,用预冷的生理盐水冲洗后投入液氮冷冻,取材结束后将样品保存于-70℃冰箱保存。
样品经低温冷冻干燥过夜,在液氮中研成粉末,称取100 mg加入预冷的0.42 mol/L HClO4溶液2 mL,用玻璃匀浆器将粉末匀浆;4℃、6 000 r/min离心5 min,取上清液1 mL,用1 mol/L KOH溶液调至pH 7.0,冰浴10 min;4℃、6 000 r/min离心10 min,取上清液1 mL,0.45 ☒m孔径滤膜过滤,冰浴保存,8 h内测定相关指标[5]。
1.3.2.1标准溶液配制
ATP标准溶液配制:称量ATP标准品2 mg置于超纯水5 mL中充分溶解,得到400 ☒g/mL的ATP标准溶液,再依次稀释至200、100、50、20、10 ☒g/mL溶液,0.45 ☒m孔径滤膜过滤。
ADP、AMP、IMP、PCr和Cr标准溶液配制方法同ATP标准溶液的配制。
混合标准溶液配制:称量ATP、ADP、AMP、IMP、PCr和Cr标准品各2 mg,充分溶解于5 mL超纯水中,得到400 ☒g/mL的混合标准溶液,再依次稀释至200、100、50、20、10 ☒g/mL溶液,0.45 ☒m孔径滤膜过滤。
1.3.2.2色谱条件
色谱柱:Waters ODS2径向加压柱(4.6 mm×250 mm,5μm);流动相:220 mmol/L KH2PO4-K2HPO4缓冲液(pH 6.5,内含3 mmol/L TBA和8%甲醇);检测波长:210 nm;流速:1.0 mL/min;柱温:20℃;进样量:5μL。
1.3.2.3标准曲线回归方程
基坑开挖前,现场技术人员向机械驾驶人员详细交底,交底内容一般包括基坑断面,弃土位置,现有地底下管线情况以及施工技术、安全要求等,并指定专业人员与机械驾驶人员配合,其配合人员必须熟悉机械挖土有关安全操作规范,并能及时量测基坑高程与宽度,防止超挖。
ATP:Y=32 933X-13 300(r=0.999 87);ADP:Y=17 365X-85 900(r=0.999 52);AMP:Y=30 297X+ 70 957(r=0.999 50);IMP:Y=45 607X+126 000(r=0.997 57);PCr:Y=7 424.1X-7 075(r=0.997 49);Cr:Y=16 678X+117 900(r=0.999 14)。
1.4数据统计分析
用STATISTICA 6.0软件对数据进行处理,实验结果以±s表示,数据进行方差分析。
2 结果与分析
2.1腓肠肌内各高能磷酸物质含量的变化
2.1.1腓肠肌中腺苷酸质量浓度比较
经HPLC分析并通过外标法定量,腓肠肌中各种腺苷酸质量浓度测定结果如表1所示,对表中各项指标分析如下。
2.1.1.1 IMP质量浓度比较
运动后即刻:游泳对照组(SC组)、低剂量核糖实验组(LT组)、中剂量核糖实验组(MT组)和高剂量核糖实验组(HT组)的IMP质量浓度均高于正常对照组(NC组),其中SC组的IMP质量浓度显著升高(P<0.05);LT组的IMP质量浓度极显著升高(P<0.01);核糖各剂量实验组(RT组)与对应剂量的核糖对照组(RC组)比较,LT组的IMP质量浓度较低剂量核糖对照组(LC组)极显著升高(P<0.01),MT组和HT组分别较中剂量核糖对照组(MC组)和高剂量核糖对照组(HC组)显著升高(P<0.05)。
恢复72 h:与NC组比较,SC组的IMP质量浓度极显著升高(P<0.01);与SC组比较,LT、MT和HT组的IMP质量浓度显著下降,其中LT组差异极显著(P<0.01),MT组和HT组差异显著(P<0.05);SC组的IMP质量浓度高于运动后即刻,LT、MT和HT组的IMP质量浓度均比运动后即刻降低,基本降至正常水平(P>0.05);RT各剂量组与对应剂量RC组比较,IMP质量浓度无显著差异(P>0.05)。
2.1.1.2 AMP和ADP质量浓度比较
运动后即刻:与NC、SC组和对应剂量RC组比较,RT各剂量组的AMP和ADP质量浓度均无显著变化(P>0.05)。
恢复72 h:与NC、SC组、对应剂量RC组和运动后即刻比较,RT各剂量组的AMP和ADP质量浓度均无显著变化(P>0.05)。
2.1.1.3 ATP质量浓度比较
运动后即刻:与NC组比较,SC组和RT各剂量组的ATP质量浓度极显著下降(P<0.01);RT各剂量组的ATP质量浓度均极显著低于对应剂量RC组(P<0.01)。
恢复72 h:与运动后即刻比较,LT组的ATP质量浓度显著升高(P<0.05),MT和HT组的ATP质量浓度极显著升高(P<0.01),RT各剂量组的ATP质量浓度均已升高至正常水平,与相同剂量RC组相比,ATP质量浓度无显著差异(P>0.05);与NC组比较,SC组的ATP质量浓度极显著下降(P<0.01)。
2.1.1.4 TAN(AMP+ADP+ATP)质量浓度比较
运动后即刻:与NC组比较,SC组、LT组的TAN质量浓度显著降低(P<0.05),MT组与HT组的TAN质量浓度极显著降低(P<0.01);与RC对应剂量组比较,LT组的TAN质量浓度显著升高(P<0.05),MT和HT组的TAN质量浓度极显著升高(P<0.01)。
恢复72 h:与SC组比较,RT各剂量组的TAN质量浓度极显著升高(P<0.01),与NC组比较无显著差异(P>0.05);与运动后即刻比较,LT组的TAN质量浓度显著升高(P<0.05),MT和HT组的TAN质量浓度极显著升高(P<0.01);与RC对应剂量组比较,RT各剂量组的TAN质量浓度无显著变化(P>0.05)。
2.1.2腓肠肌中Cr、PCr质量浓度比较
腓肠肌中Cr、PCr质量浓度测定结果如表2所示。
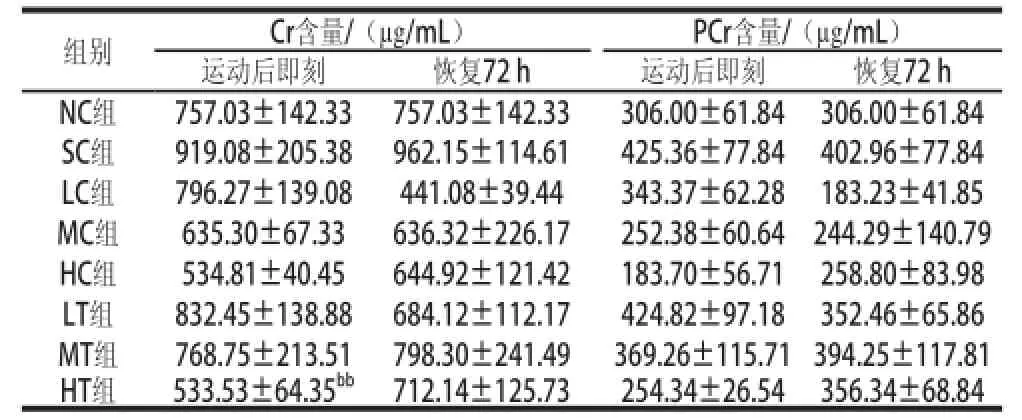
表2 各组大鼠腓肠肌中Cr、PCr质量浓度比较Table 2 Comparison of tCr and PCr concentrations in skeletal muscle among different groups of rats
如表2所示,运动后即刻和恢复72 h的RT各剂量组与对应剂量RC组之间比较,Cr质量浓度差异均不显著(P>0.05)。运动后即刻、恢复72 h,RT组、RC组、SC组和NC组之间的PCr质量浓度比较,各组之间均无显著差异(P>0.05);各组恢复前后进行比较,差异均不显著(P>0.05)。
2.2心肌组织内各高能磷酸物质含量的变化
2.2.1心肌组织中腺苷酸质量浓度比较
经HPLC分析并通过外标法定量,心肌组织中腺苷酸质量浓度测定结果如表3所示,对表中各项指标分析如下。

表3 各组大鼠心肌组织中AMP、ADP、ATP质量浓度比较Table 3 Comparison of AMP, ADP and ATP concentrations in heart among different groups of rats
2.2.1.1 AMP质量浓度比较
运动后即刻:与NC组比较,SC组AMP质量浓度极显著升高(P<0.01);LT、MT和HT组的AMP质量浓度与NC组比较,无显著差异(P>0.05),而与SC组比较,RT各剂量组AMP质量浓度极显著降低(P<0.01);RT各剂量与对应剂量的RC组比较,AMP质量浓度均无显著差异(P>0.05)。
恢复72 h:与运动后即刻比较,SC组的AMP质量浓度极显著降低(P<0.01);LT组的AMP质量浓度显著低于SC组(P<0.05)。RT各剂量组的AMP质量浓度与运动后即刻比较,均无显著差异(P>0.05);RT各剂量组与对应剂量的RC组比较,AMP质量浓度无显著差异(P>0.05)。
2.2.1.2 ADP质量浓度比较
运动后即刻:与NC组比较,SC组ADP质量浓度极显著升高(P<0.01);RT各剂量组的ADP质量浓度与NC组比较均无显著差异(P>0.05),而与SC组比较,RT各剂量组的ADP质量浓度极显著降低(P<0.01);RT各剂量组与对应剂量的RC组比较,ADP质量浓度无显著差异(P>0.05)。
恢复72 h:各组之间ADP质量浓度均无显著差异(P>0.05);与运动后即刻比较,SC组的ADP质量浓度极显著降低(P<0.01);RT各剂量组与运动后即刻比较,ADP质量浓度均无显著差异(P>0.05)。
2.2.1.3 ATP质量浓度比较
RC各剂量组的ATP质量浓度均极显著高于NC组(P<0.01)。
运动后即刻:与NC组比较,SC组的ATP质量浓度显著降低(P<0.05),LT组、MT组和HT组的ATP质量浓度极显著升高(P<0.01);与SC组比较,LT组、MT组和HT组的ATP质量浓度均极显著升高(P<0.01);RT各剂量组与对应剂量的RC组比较,ATP质量浓度无差异(P>0.05)。
恢复72 h:与NC组比较,SC组、LT组、MT组和HT组的ATP质量浓度均极显著升高(P<0.01);与运动后即刻相比,SC组的ATP质量浓度极显著升高(P<0.01),RT各剂量组的ATP质量浓度与运动后即刻相比无显著差异(P>0.05);RT各剂量组与对应剂量的RC组比较,ATP质量浓度无差异(P>0.05)。
2.2.1.4 TAN(AMP+ADP+ATP)质量浓度比较
运动后即刻:与NC组比较,SC组的TAN质量浓度极显著升高(P<0.01);与SC组比较,RT各剂量组的TAN质量浓度降低,其中MT组显著降低(P<0.05),LT组和HT组极显著降低(P<0.01);与NC组比较,MT组的TAN质量浓度极显著升高(P<0.01),HT组的TAN质量浓度显著升高(P<0.05)。
恢复72 h后:SC组与RT各剂量组之间TAN质量浓度无显著差异(P>0.05)。
2.2.2心肌组织中Cr、PCr质量浓度比较
心肌中肌酸、磷酸肌酸质量浓度测定结果如表4所示,对表中各项指标分析如下。

表4 各组间大鼠心肌组织中Cr、PCr质量浓度比较Table 4 Comparison of Cr and PCr concentrations in heart among different groups of rats
2.2.2.1 Cr质量浓度比较
运动后即刻:RT各剂量组与对应剂量RC组进行比较,其中MT组的Cr质量浓度极显著高于MC组(P<0.01),其余各组之间差异不显著(P>0.05)。
恢复72 h:SC组的Cr质量浓度显著低于NC组(P<0.05),与NC组比较,RT组的Cr质量浓度均无显著差异(P>0.05);LT、MT、HT组的Cr质量浓度均显著高于SC组(P<0.05);与运动后即刻比较,SC组的Cr质量浓度极显著降低(P<0.01)。与LC组比较,LT组的Cr质量浓度显著升高(P<0.05)。
2.2.2.2 PCr质量浓度比较
运动后即刻:与NC组和SC组比较,LT组和MT组的PCr质量浓度均极显著升高(P<0.01);与SC组比较,HT组的PCr质量浓度则没有显著变化(P>0.05);LT组和MT组分别与LC组和MC组比较,PCr质量浓度极显著升高(P<0.01),而HT组与HC组比较,PCr质量浓度极显著降低(P<0.01)。
恢复72 h:LT组的PCr质量浓度极显著高于NC组和SC组(P<0.01);MT和HT组的PCr质量浓度与NC和SC组相比则没有显著变化(P>0.05)。LT组与LC组比较,PCr质量浓度极显著升高(P<0.01);HT组与HC组比较,PCr质量浓度极显著降低(P<0.01);与运动后即刻比较,MT组的PCr质量浓度极显著降低(P<0.01)。
3 讨 论
ATP是生物体内的供能物质,是细胞基本的能量来源。ATP经去磷酸化转化为ADP和AMP,而ADP又可以通过氧化磷酸化和底物水平磷酸化获得高能磷酸基团形成ATP。本实验中,运动后即刻对腓肠肌高能磷酸物质的质量浓度进行监测,结果表明与NC组比较,SC组的ATP质量浓度显著下降,IMP的质量浓度显著升高,而ADP和AMP的质量浓度无明显变化,且恢复72 h后ATP质量浓度仍然处于较低水平(表1),说明高强度运动后ATP的消耗增加,水平降低,转化为ADP和AMP,AMP在腺苷酸脱氨酶的催化下,通过嘌呤核苷酸循环进一步分解为IMP和次黄嘌呤,一旦这些代谢产物进入血液循环将会被分解为尿酸排出体外,这就导致补救合成ATP的底物丢失,使ATP水平持续降低[3,6-8]。频繁的高强度运动导致骨骼肌ATP的丢失,这种重复性的丢失要比通过补救途径或者从头途径合成ATP的速率高的多,机体嘌呤补救途径合成ATP的速率很低,即使血液中的嘌呤浓度很高,骨骼肌也不会将其吸收作为合成ATP的原料[9-10]。而且运动后机体骨骼肌细胞内嘌呤浓度的少量增加仅占ATP水平降低的很少一部分[9,11]。因此,ATP的合成主要依靠从头合成途径。腺嘌呤核苷从头合成的限制性因素是可利用的PRPP的量[12-15],一旦PRPP的水平降低,将导致腺嘌呤核苷酸的合成减少。
大鼠混合肌纤维内核苷酸从头合成的速率为35μmol/(kg·h)(以干质量计)[16]。本实验中运动后即刻SC组和RT各剂量组的ATP水平大约降低了4 000~6 000 ☒mol/(kg·h)(以干质量计),如果按照相同的速率从头合成,需要110~170 h才能使ATP完全恢复至正常水平。给予核糖的大鼠在72 h后腓肠肌中的ATP水平即与正常对照组无差异,且TAN的水平也恢复到了正常水平,而未给予核糖的大鼠72 h后ATP质量浓度仍显著低于正常水平(表1),说明补充核糖能够显著增强ATP的合成速率,完全恢复运动期间丢失的ATP。大鼠游泳过程中补充核糖能够促进ATP合成增加,说明可利用的核糖以及PRPP的含量是肌肉组织中ATP合成的限制性因素,且已有研究证实补充核糖不仅能够使骨骼肌嘌呤补救合成速率提高3~7倍[2,4],而且能够使ATP的从头合成速率得到相应的提高[3]。
在心肌组织中,与NC组比较,SC组的ATP质量浓度显著降低,而ADP和AMP的质量浓度显著升高(表3),表明游泳运动消耗了心肌组织中的ATP转化为ADP和AMP。补充核糖后,ADP和AMP的质量浓度恢复到正常水平,ATP的质量浓度显著升高(表3),表明补充核糖可以使运动后即刻心肌组织中ATP水平显著增加,这有利于维持运动过程中心脏的正常生理功能。该结果对于一些引起心脏或者骨骼肌代谢障碍的疾病具有重要意义,如心脏衰竭[17-19]、外周血管堵塞[20]等,补充核糖可以提高这些疾病患者的心肌功能[18]。恢复72 h后,大鼠心肌的AMP、ADP、ATP和TAN都恢复至正常水平(表3)。
ATP除作为直接能源物质供能外,还可将分子中的高能磷酸键转给Cr生成PCr[21]。PCr分子中所含的高能磷酸键不能被直接利用,而是作为高能磷酸键的储存形式[22]。当机体耗能增多,ATP下降而ADP升高时,PCr把高能磷酸键转给ADP生成ATP,供生理活动用。运动过程中PCr消耗程度与运动程度的关系极为密切。本研究运动强度低于60%最大摄氧量强度,因此PCr消耗较少,故腓肠肌组织内运动后即刻PCr和Cr水平变化不明显,与正常静息状态无显著差异(表2)。
机体内可利用的核糖以及PRPP的含量是肌肉组织中ATP合成的限制性因素。补充外源性核糖可以消除磷酸戊糖途径中葡萄糖-6-磷酸脱氢酶的限速步骤,直接提高PRPP水平,从而加快心肌、骨骼肌合成嘌呤核苷酸的速率及机体ATP库的恢复。PRPP一旦形成,就会直接转化成IMP,IMP进一步转化成AMP,AMP再转化为ADP,进而补充ATP的不足,起到抗疲劳作用[23]。
D-核糖显著提高了腓肠肌内ATP的合成速率,使机体在72 h内完全恢复运动过程中消耗的ATP,加速运动后恢复期机体的能量恢复。同时,D-核糖显著提高了运动过程中心肌组织内ATP的水平,确保运动过程中心肌组织的能量供应,维持了运动过程中心脏的正常生理功能,这对于心脏或者骨骼肌能量代谢障碍的患者具有重要意义。
参考文献:
[1] FALLER K M, MEDWAY D J, AKSENTIJEVIC D, et al. Ribose supplementation alone or with elevated creatine does not preserve high energy nucleotides or cardiac function in the failing mouse heart[J]. PLoS ONE, 2013, 8(6): e66461. doi: 10.1371/journal.pone.0066461.
[2] ZARZECZY R, BRAULT J J, ABRAHAM K A, et al. Influence of ribose on adenine salvage after intense muscle contractions[J]. Journal of Applied Physiology, 2001, 91(4): 1775-1781.
[3] HELLSTEN Y, SKADHAUGE L, BANGSBO J. Effect of ribose supplementation on resynthesis of adenine nucleotides after intense intermittent training in humans[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2004, 286(1): 182-188.
[4] BRAULT J J, TERJUNG R L. Purine salvage to adenine nucleotides in different skeletal muscle fiber types[J]. Journal of Applied Physiology, 2001, 91(1): 231-238.
[5]王亚坤,孙文敬,刘敬泽.负载条件下D-核糖对大鼠游泳后血糖和血乳酸含量的影响[J].食品科学, 2006, 27(12): 728-732.
[6] HARMER A R, MCKENNA M J, SUTTON J R, et al. Skeletal muscle metabolic and ionic adaptations during intense exercise following sprint training in humans[J]. Journal of Applied Physiology, 2000, 89(5): 1793-1803.
[7] HELLSTEN-WESTING Y, NORMAN B, BALSOM P D, et al. Decreased resting levels of adenine nucleotides in human skeletal muscle after high-intensity training[J]. Journal of Applied Physiology, 1993, 74(5): 2523-2528.
[8] STATHIS C G, FEBBRAIO M A, CAREY M F, et al. Influence of sprint training on human skeletal muscle purine nucleotide metabolism[J]. Journal of Applied Physiology, 1994, 76(4): 1802-1809.
[9] HELLSTEN Y, RICHTER E A, KIENS B, et al. AMP deamination and purine exchange in human skeletal muscle during and after intense exercise[J]. The Journal of Physiology, 1999, 520(3): 909-920.
[10] HELLSTEN Y, SJODIN B, RICHTER E A, et al. Urate uptake and lowered ATP levels in human muscle after high-intensity intermittent exercise[J]. American Journal of Physiology-Endocrinology and Metabolism, 1998, 274(4): 600-606.
[11] TULLSON P C, BANGSBO J, HELLSTEN Y, et al. IMP metabolism in human skeletal muscle after exhaustive exercise[J]. Journal of Applied Physiology, 1995, 78(1): 146-152.
[12] HARMSEN E, de TOMBE P P, de JONG J W, et al. Enhanced ATP and GTP synthesis from hypoxanthine or inosine after myocardial ischemia[J]. American Journal of Physiology-Heart and Circulatory Physiology, 1984, 246(1): 37-43.
[13] KIM Y A, KING M T, TEAGUE W E, et al. Regulation of the purine salvage pathway in rat liver[J]. American Journal of Physiology-Endocrinology and Metabolism, 1992, 262(3): 344-352.
[14] RUBIN B B, LIAUW S, TITTLEY J, et al. Prolonged adenine nucleotide resynthesis and reperfusion injury in postischemic skeletal muscle[J]. American Journal of Physiology-Heart and Circulatory Physiology, 1992, 262(5): 1538-1547.
[15] YEH G C, PHANG J M. Stimulation of phosphoribosyl pyrophosphate and purine nucleotide production by pyrroline 5-carboxylate in human erythrocytes[J]. Journal of Biological Chemistry, 1988, 263(26): 13083-13089.
[16] TULLSON P C, JOHN-ALDER H B, HOOD D A, et al. De novo synthesis of adenine nucleotides in different skeletal muscle fiber types[J]. American Journal of Physiology-Cell Physiology, 1988, 255(3): 271-277.
[17] BERNOCCHI P, CECONI C, PEDERSINI P, et al. Skeletal muscle metabolism in experimental heart failure[J]. Journal of Molecular and Cellular Cardiology, 1996, 28(11): 2263-2273.
[18] PAULY D F, PEPINE C J.D-Ribose as a supplement for cardiac energy metabolism[J]. Journal of Cardiovascular Pharmacology and Therapeutics, 2000, 5(4): 249-258.
[19] OMRAN H, ILLIEN S, MACCARTER D, et al.D-Ribose improves diastolic function and quality of life in congestive heart failure patients: a prospective feasibility study[J]. European Journal of Heart Failure, 2003, 5(5): 615-619.
[20] BRASS E P. Skeletal muscle metabolism as a target for drug therapy in peripheral arterial disease[J]. Vascular Medicine, 1996, 1(1): 55-59.
[21] ZHAO Liping, YAN Wenhui, XIANG Heng, et al. Proteomic investigation of changes in rat skeletal muscle after exercise-induced fatigue[J]. Biological Research, 2012, 45(1): 75-80.
[22] XIONG Qiang, DU Fei, ZHU Xiaohong, et al. ATP production rate via creatine kinase or ATP synthasein vivoa novel superfast magnetization saturation transfer method[J]. Circulation Research, 2011, 108(6): 653-663.
[23]丁岩,吴丹,贾占红,等.D-核糖对疲劳小鼠骨骼肌组织内高能磷酸物质代谢的影响[J].世界科学技术:中医药现代化, 2013(9): 1916-1920.
Effect of D-Ribose on High-Energy Phosphates in Cardiac and Skeletal Muscles of Rats during Swimming and Subsequent Recovery
WANG Yakun1,2, LI Meng2, WEI Zhuan3, SUN Wenjing2,4, LIU Jingze2,*
(1. Tourism Department, Hebei Normal University, Shijiazhuang 050024, China; 2. College of Life Science, Hebei Normal University, Shijiazhuang 050024, China; 3. Department of Pharmaceutical, Hebei Chemical and Pharmaceutical College, Shijiazhuang 050026, China; 4. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China)
In order to investigate the effect ofD-ribose on the recovery of rat cardiac muscle and skeletal muscle function during and after loaded swimming, the concentrations of high-energy phosphates such as adenosine triphosphate (ATP), ATP metabolites and phosphocreatine (PCr) were determined by high performance liquid chromatography (HPLC). Results showed that the synthesis rate of ATP in skeletal muscle was accelerated significantly byD-ribose; therefore, t he same amount of ATP consumed during swimming was reproduced within 72 h and the energy recovery was accelerated. At the same time,D-ribose significantly enhanced the concentration of ATP in heart so that the energy supply to heart was guaranteed and the normal physiological function of heart was maintained during swimming.
D-ribose; high-energy phosphate materials; high performance liquid chromatography; cardiac muscle; skeletal muscle
Q532
1002-6630(2015)11-0202-06
10.7506/spkx1002-6630-201511039
2014-07-01
河北省自然科学基金资助项目(C2013205158);河北师范大学博士基金项目(L2010B19)
王亚坤(1980—),女,副教授,博士,主要从事功能食品研究。E-mail:wangyakun-2007@163.com
*通信作者:刘敬泽(1964—),男,教授,博士,主要从事生态学与功能食品研究。E-mail:liujingze@mail.hebtu.edu.cn
