土壤菲胁迫对高丹草幼苗叶片光合机构功能的影响
2014-12-24丁俊男张会慧迟德富
丁俊男,张会慧,迟德富
(东北林业大学生命科学学院,黑龙江 哈尔滨150040)
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)指含有两个或两个以上苯环的一类化合物,是典型的持久性有机污染物,具有慢毒性和致癌、致畸、致突变的作用,是环境中重要致癌物质之一[1-2],多环芳烃主要通过土壤-植物和空气-植物两种途径进入植物体,土壤-植物是多环芳烃通过在受污染土壤与植物根系之间的分配进入植物体,而空气-植物是多环芳烃从空气通过气态和颗粒态沉降到叶片的蜡质表皮或者通过气孔吸收进入植物体[3],一般情况下,土壤中的PAHs多来源于大气中多环芳烃的沉降,而土壤内源的PAHs总质量分数较低[4],但人为活动会导致土壤中的PAHs质量分数大大增加[5-6],植物对PAHs的吸收除了通过气孔在进行光合作用的同时将空气中的PAHs带入叶肉细胞中,大部分PAHs是伴随着根系吸水作用进入植物体内的[7-8],土壤中的PAHs会抑制植物种子的萌发和植株的生长[9-10],也有研究发现,多数PAHs对植物生长出现低浓度时促进高浓度时抑制的浓度效应[11-12]以及随着胁迫时间的延长表现出明显的时间效应等[13]。土壤中的PAHs对植物的影响除了限制根系生长外[14-15],进入植物体内的PAHs还会导致植物体内抗氧化系统代谢紊乱[16]、细胞膜质的过氧化[17]、抑制叶绿素的合成或加速其降解[18],破坏叶绿体基质的排列顺序[19],扰乱亚细胞膜的结构和光合相关酶的活性,降低光合碳同化能力等[20-21],但目前有关PAHs对植物光合作用中光合电子的供应及传递能力方面的研究较少。
自然环境中大多数地区PAHs中多以菲(Phe-nanthrene)的质量分数最高,并且菲的溶解度较其他种类的PAHs高,最容易被植物吸收并在食物链中富集,因此,菲对环境的影响较其他种类PAHs要相对严重[22]。在PAHs污染较为严重的工业区生态环境遭到破坏,严重影响牧草的种植,所以,有必要进行PAHs胁迫下牧草生理响应方面的研究。高丹草(Sorghumbicolor×S.sudanense)为高粱(S.bicolor)与苏丹草(S.sudanense)杂交获得的新型牧草品种,不但具有高粱抗旱和抗倒伏的抗逆优势,而且还具有苏丹草营养价值高和适口性好等牧草的品质优点,表现为明显的杂种优势[23-24],是我国目前牧草种植的主要品种之一。本研究以杂交高丹草为试验材料,研究土壤菲胁迫对高丹草幼苗叶绿素荧光参数的影响,探讨土壤菲胁迫对高丹草幼苗叶片放氧复合体活性、光合电子传递能力以及光合能量分配参数的影响,以期探明土壤菲胁迫对植物光合作用的影响机理。
1 材料与方法
1.1 试验材料与处理
试验于2013年4-6月在东北林业大学分子生物学实验室进行。供试牧草品种为高丹草。培养基质采用草炭土,试验基质中菲的含量分别设为0(CK)、50、100和200mg·kg-14个浓度梯度,质量分数以风干土壤计算,各处理以10mL的丙酮作助溶剂,将丙酮和菲的混合液加入土壤混匀后阴凉处风干12h,使丙酮充分挥发。将精选成熟饱满、大小相对一致的高丹草种子均匀播种到含有不同浓度菲土壤的培养钵中,培养钵直径12cm、高15cm,每钵种植20粒种子,每个处理5钵重复,共计20钵。将培养钵放在光照强度400μmol·m-2·s-1、光周期12h/12h(白天/黑夜)、温度25℃/23℃,相对湿度在75%的培养箱内培养,定期浇水和苗期管理,待幼苗出土长至株高约10cm时,间苗处理,每钵保留健壮、生长相对一致的幼苗8株,待播种45d后开始进行生长指标和叶绿素荧光参数的测定。
1.2 测定项目和方法
快速叶绿素荧光动力学曲线(OJIP)的测定:于09:00将高丹草幼苗叶片进行0.5h暗适应,利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100 max,捷克)测定各处理叶片的OJIP曲线,其中O、J、I和P点分别为0、2、30和1 000ms对应的时刻,OJIP曲线由3 000μmol·m-2·s-1的脉冲红光诱导,荧光信号记录是从10μs开始至1s结束,每秒105个数据。利用5次OJIP曲线平均值绘制OJIP曲线,并将曲线按照Zhang等[25]的方法进行O-P点和O-J点标准化,曲线横坐标以对数形式表示。OP点标准化时VO-P=(Ft-Fo)/(Fm-Fo),O-J点标准化时 VO-J=(Ft-Fo)/(FJ-Fo),式中,Ft表示各时间点的荧光强度。分别计算菲浓度为50、100和200mg·kg-1处理(TR)和CK标准化后的OJIP曲线差值,即 ΔVO-P=VO-P(TR)-VO-P(CK),ΔVO-J=VO-J(TR)-VO-J(CK)。
对测得的OJIP曲线通过JIP-test分析得到叶绿素荧光参数:初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在光化学效率(Fv/Fo)、以吸收光能为基础的光合性能指数(PIABS)、OJIP曲线上2ms时的相对可变荧光强度(VJ)、荧光上升的初始斜率(Mo)、QA被氧化还原次数(N)、荧光曲线与Fm所围面积(Area)、2ms时有活性反应中心的开放程度(Ψo)、吸收光能用于QA-以后的电子传递的能量比例(φEo)、非光化学猝灭的最大量子产额(φDo)、单位反应中心吸收的光能(ABS/RC)、单位反应中心吸收光能用于还原QA的能量(TRo/RC)、单位反应中心吸收光能用于电子传递的能量(ETo/RC)和单位反应中心耗散掉的能量(DIo/RC)等,其计算方法按照Strasser等[26]的方法。以CK的各叶绿素荧光参数为标准,求得不同浓度菲处理与CK的各叶绿素荧光值之间比值,制作不同浓度菲胁迫下各叶绿素荧光参数的雷达图。
2 结果与分析
2.1 土壤菲胁迫对高丹草幼苗叶片快速叶绿素荧光诱导动力学曲线的影响
菲胁迫下高丹草幼苗叶片的OJIP曲线形态发生了改变,土壤菲浓度为50和100mg·kg-1时,OJIP曲线上O点荧光强度无明显变化,而菲浓度达200mg·kg-1时O点荧光强度明显增加,随着菲浓度的增加,OJIP曲线上J点荧光强度增强,P点荧光强度降(图1)。由于原始OJIP曲线变异性受外界因素的影响较大,因此常通过数学方法把荧光信号数据标准化,即使所有的OJIP曲线具有相同的起点和终点,将OJIP曲线标准化后(图2)仍可以发现,随着土壤中菲浓度的增加,OJIP曲线上J点和I点的荧光强度明显上升,并且随着土壤中菲浓度的增加,增加趋势更为明显。将不同浓度菲处理与CK之间的标准化OJIP曲线做差值发现(图2),随着土壤中菲浓度的增加,J点和I点的荧光强度变化较明显,并且表现出明显的浓度效应。

图1 不同浓度土壤菲胁迫下高丹草幼苗叶片的OJIP曲线Fig.1 Chlorophyll a fluorescence transient(OJIP)in leaves of Sorghum bicolor ×S .sudanense seedlings to phenanthrene polluted soils
2.2 土壤菲胁迫对高丹草幼苗叶片放氧复合体(OEC)的影响
为探明土壤菲胁迫对高丹草幼苗叶片放氧复合体(OEC)的影响,将OJIP曲线进行O-J点标准化(图2),结果发现,不同处理之间曲线上0.3ms时(K点)的荧光强度出现明显的分异。比较不同浓度菲胁迫和CK之间的差异也可以看出(图2),随着土壤中菲浓度的增加K点荧光强度增加更为明显。
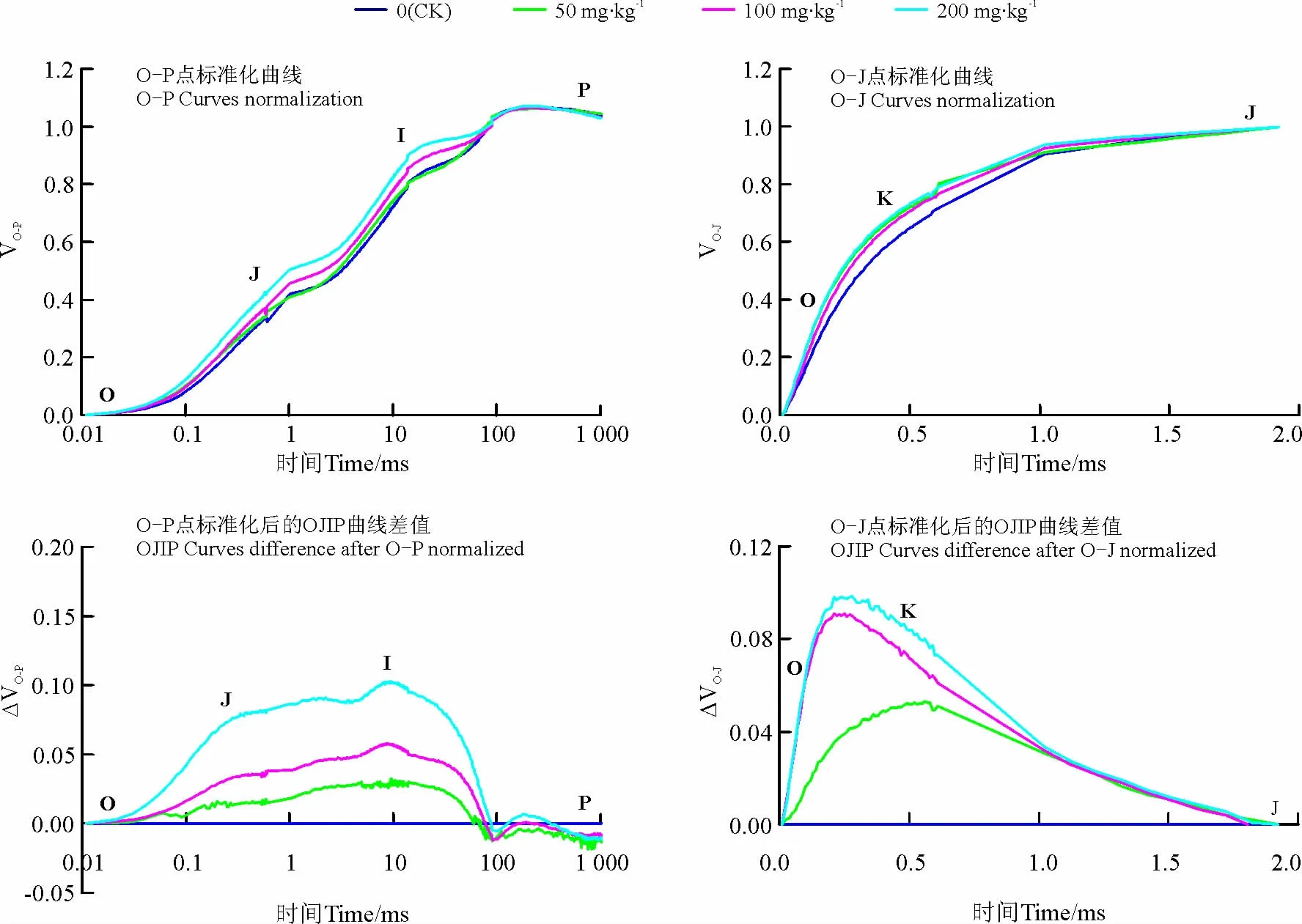
图2 土壤菲胁迫下高丹草幼苗叶片标准化的O-P和O-J曲线及曲线差值Fig.2 Chlorophyll a fluorescence transients(O-P and O-J)were normalized and curves difference in leaves of Sorghum bicolor ×S .sudanense seedlings to phenanthrene polluted soils
2.3 土壤菲胁迫对高丹草幼苗叶片叶绿素荧光参数的影响
随着土壤中菲浓度的增加,高丹草幼苗叶片的Fo呈增加趋势,而Fm、Fv/Fm、Fv/Fo和PIABS则呈降低趋势,当土壤中菲浓度达200mg·kg-1时,高丹草幼苗叶片的Fm、Fv/Fm、Fv/Fo和PIABS分别较 CK降低了12.17%、8.04%、8.45%和20.44%,说明土壤菲胁迫可以导致高丹草幼苗叶片PSⅡ反应中心活性降低(图3)。土壤菲胁迫还导致了高丹草幼苗叶片VJ、Mo和N的增加以及Ψo和Area的降低,即菲胁迫下高丹草幼苗叶片的PSⅡ电子受体侧电子传递受阻。另外高丹草幼苗叶片的光能分配参数也明显受到土壤菲胁迫的影响,随着土壤菲浓度的增加,φEo、TRo/RC 和 ETo/RC 降低,而φDo和DIo/RC呈增加趋势,并且土壤中菲浓度低于100 mg·kg-1时,高丹草幼苗叶片ABS/RC呈降低趋势,而土壤中菲浓度达200mg·kg-1时,ABS/RC却稍有升高。

图3 土壤菲胁迫下高丹草幼苗叶片叶绿素荧光参数雷达图Fig.3 Radar plot of fluorescence data in leaves of Sorghum bicolor ×S .sudanense seedlings to phenanthrene polluted soils
3 讨论
OJIP曲线中蕴含着丰富的PSⅡ原初光化学反应信息,通过短时间照光后荧光信号的瞬时变化以较高的分辨率研究Fo到Fm变化的荧光信息,即可以研究包括PSⅡ电子供应、传递以及PSⅡ反应中心活性的变化等。本试验结果发现土壤菲胁迫下高丹草幼苗叶片的 Fm、Fv/Fm、Fv/Fo和 PIABS等参数均随着土壤菲浓度的增加而降低,即土壤菲胁迫下高丹草幼苗叶片PSⅡ反应中心发生了光抑制。并且PIABS的变化结果较其他参数更为敏感,作为反应植物光抑制的重要指标,PIABS反映PSⅡ活性的变化较Fv/Fm更具有代表性[27]。研究发现,PAHs会抑制植物蛋白质的合成,或加速蛋白质的降解,例如D1蛋白等[28],而D1蛋白的第190位His残基与原初电子供体中的Mn原子相结合,D1蛋白的含量会直接影响到放氧复合体的功能[28],本研究中土壤菲胁迫下高丹草幼苗叶片OJIP曲线上0.3ms时(K点)的荧光强度增加,K点的荧光强度的增加与PSⅡ电子供体侧OEC的损伤有关[29-31],当OEC活性受到抑制时会使水裂解过程中产生大量的H2O2,而叶绿体内还不含有清除H2O2的CAT[32],H2O2会氧化细胞中的DNA和蛋白质等,还会通过破坏OEC的构成亚基而反馈抑制OEC的活性[33],因此,菲胁迫会通过抑制高丹草幼苗叶片OEC的活性而降低光合电子的产生,另外OEC活性的抑制导致活性氧的代谢紊乱也可能是导致PSⅡ反应中心发生光抑制的重要原因之一。
由于光合电子传递过程中PSⅡ反应中心被激发后产生的电子经由去镁叶绿素(Pheo)传给QA生成QA-所需时间仅为250~300ps,而QA-将电子传递到QB的时间却需要100~200μs,因此,逆境条件下会造成QA-的大量积累,荧光迅速上升至J点,即J点荧光的上升反映了QA向QB电子的传递能力[34]。对土壤菲胁迫下高丹草幼苗叶片PSⅡ受体侧电子传递能力分析可以发现,土壤菲胁迫下高丹草幼苗叶片OJIP曲线上J点的荧光强度明显增加,VJ、MO随着菲浓度的增加而增加,VJ和MO是反映电子由QA向QB传递情况的重要指标,说明菲胁迫下高丹草幼苗PSⅡ受体侧电子QA向QB的传递受到了抑制,从而导致QA-的积累量以及QA被还原的相对速率和被氧化还原的次数均呈增加趋势。土壤菲胁迫下高丹草幼苗叶片的Area和ΨO也呈降低趋势,Area和ΨO反映了PSⅡ受体侧接收电子的能力[35],因此菲胁迫下导致PSⅡ受体侧电子传递速率降低的原因与PSⅡ受体侧电子接受能力的降低有关。有研究发现,逆境下植物叶片中的PSⅡ受体侧电子传递受阻与D1蛋白的降解有关,D1蛋白降解后会导致电子传递体QB从D1蛋白上脱落,造成受体库容量的降低,从而影响其电子传递能力[36],因此土壤菲胁迫下导致电子传递能力的降低可能与其造成蛋白质的合成受阻或降解加速有关。土壤菲胁迫还导致OJIP曲线上I点荧光强度的增加,I点即在QA-向QB传递过程中反映了PQ库的异质性,即电子传递过程中快还原型PQ库先被完全还原,然后才是慢还原型PQ库被还原[37],这也说明菲胁迫导致了高丹草幼苗PSⅡ受体侧电子接受能力有所降低。PSⅡ受体侧电子传递能力下降会使电子传递链上积累过剩的电子,这些电子会通过攻击游离的O2而产生大量的活性氧,抑制PSⅡ反应中心的活性,使PSⅡ反应中心发生光抑制。
土壤菲胁迫下高丹草幼苗叶片的光能吸收和分配参数发生了明显的变化,50mg·kg-1菲浓度下高丹草幼苗叶片的ABS/RC与CK相比无明显变化,而100mg·kg-1菲浓度明显降低了高丹草幼苗叶片的ABS/RC,但当菲浓度增加到200 mg·kg-1时高丹草幼苗叶片的ABS/RC降低程度却较100mg·kg-1时有所下降。当PSⅡ反应中心有活性反应中心的数量降低时会迫使剩余有活性反应中心效率增加而表现为吸收光能增强[38],这暗示了土壤中菲浓度过高时会降低高丹草幼苗叶片PSⅡ反应中心有活性反应中心的数量。随着菲浓度的增加,高丹草幼苗叶片的φEO、TRO/RC和ETO/RC降低,而φDO和DIO/RC呈增加趋势,吸收光能用于QA-以后的电子传递的能量比例和单位反应中心捕获的用于电子传递的能量降低,即PSⅡ反应中心吸收光能用于光合电子传递能量的比例降低,而用于热耗散的比例增加,这虽是高丹草幼苗叶片对菲胁迫的一种适应机制,但光合电子传递能量的比例降低势必会降低同化力的生成,从而影响光合碳同化能力。因此,土壤菲胁迫降低了高丹草幼苗叶片PSⅡ反应中心吸收光能用于QA-以后的电子传递的能量比例和单位反应中心捕获的用于电子传递的能量,即改变了高丹草幼苗叶片光合机构对光能的吸收和利用能力,这也是土壤菲胁迫对高丹草幼苗叶片光合机构破坏使之发生光抑制的重要原因之一。
4 结论
土壤菲胁迫会抑制PSⅡ电子供体侧放氧复合体OEC的活性,还会降低PSⅡ电子受体侧的电子的接受能力而影响电子由QA向QB的传递。另外,土壤菲胁迫还导致了高丹草幼苗叶片光能吸收和分配不平衡,光能分配到电子传递的能量比例降低,而用于热耗散的比例增加,PSⅡ反应中心的活性降低。因此,土壤菲胁迫引起高丹草幼苗叶片电子传递速率的降低和光能利用紊乱是引起其光抑制的主要原因。土壤菲胁迫会抑制PSⅡ电子供体侧放氧复合体OEC的活性,还会降低PSⅡ电子受体侧的电子的接受能力而影响电子由QA向QB的传递。另外,土壤菲胁迫还导致了高丹草幼苗叶片光能吸收和分配不平衡,光能分配到电子传递的能量比例降低,而用于热耗散的比例增加,PSⅡ反应中心的活性降低。因此,土壤菲胁迫引起高丹草幼苗叶片电子传递速率的降低和光能利用紊乱是引起其光抑制的主要原因。
[1]Bernard D,Pascaline H,Jeremie J J.Distribution and origin of hydrocarbons in sediments from lagoons with fringing mangrove community[J].Marine Pollution Bulletin,1996,32(10):734-739.
[2]黄翠玲,徐文菁,赵国栋,钟晋贤,蒋可.北京市大气颗粒物中多环芳烃的组成[J].环境科学,2001,22(4):16-20.
[3]柯钦雨,叶媛蓓.不同浓度多环芳烃(菲)胁迫下拟南芥的生理响应[J].环境卫生工程,2009,10(17):110-116.
[4]陈晓秋,苏鹏起,林洟清.废水及土壤中多环芳烃监测时样品的预处理[J].中国环境监测,1994,10(6):27-28.
[5]宋玉芳,许华夏,任丽萍.两种植物条件下土壤中矿物油和多环芳烃的生物修复研究[J].应用生态学报,2001,12(1):108-112.
[6]丁爱芳,潘根兴,张旭辉.吴江市水稻土中多环芳烃(PAHs)含量及来源的研究[J].农业环境科学学报,2005,24(6):1166-1170.
[7]Alkio M,Tabuchi T M,Wang X C,Colón-Carmona A.Stress responses to polycyclic aromatic hydrocarbons inArabidopsisincludegrowth inhibition and hypersensitive response-like symptoms[J].Journal of Experimental Botany,2005,56(421):2983-2994.
[8]Paterson S,Machay D,Tam D,Shiu W Y.Uptake of organic chemicals by plants:A review of processes,correlations and models[J].Chemosphere,1990,21(3):297-331.
[9]Henner P,Schiavon M Druelle V.Phytotoxicity of ancient gaswork soils:Effect of polycyclic aromatic hydrocarbons(PAHs)on plant germination[J].Organic Geochemistry,1999,30(8):963-969.
[10]尹颖,孙媛媛,郭红岩,王晓蓉.芘对苦草的生物毒性效应[J].应用生态学报,2007,18(7):1528-1533.
[11]郑文教,陆志强.红树植物秋茄幼苗对多环芳烃芘胁迫的生理生态响应[J].厦门大学学报(自然科学版),2009,48(6):910-914.
[12]刘亚云,孙红斌,陈桂珠.多氯联苯对桐花树幼苗生长及膜保护酶系统的影响[J].应用生态学报,2007,18(1):123-128.
[13]杜青平,贾晓珊,袁保红.1,2,4-三氯苯对水稻种子萌发及幼苗生长的毒性机理[J].应用生态学报,2006,17(11):2185-2188.
[14]占新华,万寅婧,周立祥.水溶性有机物对土壤中菲的生态毒性影响[J].环境科学,2004,25(3):120-124.
[15]万寅婧,占新华,周立祥.土壤中芘、菲、萘、苯对小麦的生态毒性影响[J].中国环境科学,2005,25(5):563-566.
[16]陆志强,郑文教,马丽.萘和芘胁迫对红树植物秋茄幼苗膜透性及抗氧化酶活性的影响[J].厦门大学学报:自然科学版,2008,47(5):757-60.
[17]McCann J H,Greenberg B M,Solomon K R.The effect of creosote on the growth of an axenic culture ofMyriophyllum spicatumL.[J].Aquatic Toxicology,2000,50(3):267-276.
[18]刘建武,林逢凯,王郁,胥峥,张啸.多环芳烃(萘)污染对水生植物生理指标的影响[J].华东理工大学学报,2002,28(5):520-524,536.
[19]Karukstis K K,Berliner M A,Jewell C J,Kuwata K T.Chlorophyll fluorescence measurements to assess the competition of substituted anthraquinones for QBbinding site[J].Biochimica et Biophysica Acta,1990,1020(2):163-168.
[20]Girotti A W.Photodynamic lipid peroxidation in biological systems[J].Photochemistry and Photobiology,1990,51:497-509.
[21]Reilley K A,Banks M K,Schwab A P.Dissipation of polycyclic aromatic hydrocarbons in the rhizosphere[J].Journal of Environmental Quality,1996,25(2):212-219.
[22]张天彬,杨国义,万洪富,饶勇,高原雪,夏运生.东莞市土壤中多环芳烃的含量、代表物及其来源[J].土壤,2005,37(3):265-271.
[23]张会慧,张秀丽,胡彦波,许楠,李鑫,田野,张婷,孙广玉.高粱-苏丹草杂交种的生长特性和光合功能研究[J].草地学报,2012,20(5):881-887.
[24]张晓艳,刘锋,王风云,张吉旺,叶梅,董树亭.施氮对杂交苏丹草植株硝态氮累积及产量的影响[J].草地学报,2009,17(3):327-332.
[25]Zhang L T,Gao H Y,Zhang Z S,Xue Z C,Meng Q W.Multiple effects of inhibition of mitochondrial alternative oxidase pathway on photosynthetic apparatus inRumexK-1leaves[J].Biologia Plantarum,2012,56(2):365-368.
[26]Strasser R J,Srivastava A G.Polyphasic chlorophyll a fluorescence transient in plants and cyanobacteria[J].Photochemistry and Photobiology,1995,61(1):32-42.
[27]邱念伟,周峰,顾祝军,贾淑芹,王兴安.5种松属树种光合功能及叶绿素快相荧光动力学特征比较[J].应用生态学报,2012,23(5):1181-1187.
[28]孙山,王少敏,王家喜,高辉远.黑暗中脱水对“金太阳”杏离体叶片PSⅠ和PSⅡ功能的影响[J].园艺学报,2008,35(1):1-6.
[29]马丽,何春光,盛连喜,李辉.松前水稻(Oryzasativacv.Matsumae)对土壤菲污染的生理生态响应[J].生态环境学报,2010,19(10):2435-2440.
[30]匡廷云.光合作用原初光能转化过程的原理与调控[M].南京:江苏科学技术出版社,2003.
[31]李庆亮,谭伟,薛明.B型烟粉虱危害对烟草叶片光系统II的影响[J].中国农业科学,2012,45(19):3988-3995.
[32]张会慧,田褀,刘关君,胡彦波,吴翔宇,田野,李鑫,孙广玉.转2-CysPrx基因烟草抗氧化酶和PSⅡ电子传递对盐和光胁迫的响应[J].作物学报,2013,39(10):1435-1440.
[33]Henmi T,Miyao M,Yamamoto Y.Release and reactive-oxygen-mediated damage of the oxygen-evolving complex subunits of PSⅡ during photoinhibition[J].Plant & Cell Physiology,2004,45(2):243-250.
[34]张会慧,张秀丽,朱文旭,许楠,李鑫,岳冰冰,王良再,孙广玉.桑树叶片光系统Ⅱ对NaCl和Na2CO3胁迫的响应[J].北京林业大学学报,2011,33(6):15-20.
[35]李耕,高辉远,赵斌,董树亭,张吉旺,杨吉顺,王敬锋,刘鹏.灌浆期干旱胁迫对玉米叶片光系统活性的影响[J].作物学报,2009,35(10):1916-1922.
[36]张会慧,张秀丽,李鑫,许楠,孙广玉.盐胁迫下桑树叶片D1蛋白周转和叶黄素循环对PSⅡ的影响[J].林业科学,2013,49(1):99-106.
[37]李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报,2005,31(6):559-566.
[38]张会慧,张秀丽,胡彦波,李鑫,许楠,王鹏,梁明,孙广玉.碱性盐胁迫对桑树幼苗叶片叶绿素荧光和激发能分配的影响[J].经济林研究,2012,30(1):12-17.
