提高观赏羽扇豆组织培养效果研究
2014-12-14王小玲刘腾云谭胤静余发新
王小玲,高 柱,刘腾云,谭胤静,余发新*
(1.江西省科学院 生物资源研究所/江西省重金属污染生态修复工程技术研究中心,江西 南昌 330096;2.江西省鄱阳湖重点实验室,江西 南昌 330096)
观赏羽扇豆因其特殊的花语、特别的植株形态、丰富的花序颜色和较高的经济用途而被广泛利用。观赏羽扇豆为自花授粉植物,通过近年的研究发现,在各省引种栽培后,种子结实率低,饱满度不够,主要以进口为主,成本较高[1]。植物组织培养法繁殖的突出特点是快速,且具有几乎不受地理环境和季节限制、遗传背景一致、生长周期短、成本低等诸多优点,因此对观赏羽扇豆这种“名、优、特、新、奇”品种的繁殖意义重大。然而,污染、褐化和玻璃化被认为是花卉组织培养技术环节中存在的三大杀手,会给科研和生产实践带来巨大危害。因此采取有效的防控措施,降低污染率发生的几率,有效控制褐化和玻璃化现象,是实现花卉组织培养工厂化生产的重要保障。
目前,对于观赏羽扇豆组织培养的研究还主要集中在生长激素对不定芽诱导、增殖和生根的影响方面[2-3],对于如何减少污染及控制褐化和玻璃化现象的研究鲜有报道。本研究通过正交试验方法,研究不同因素水平对观赏羽扇豆组织培养过程中的污染、褐化和玻璃化现象的影响,建立高效的观赏羽扇豆组织培养种苗生产体系,为其进一步的生理学、病理学、遗传学、育种学以及生物化学等领域的研究提供技术手段,提高观赏羽扇豆工厂化育苗方面产生的巨大经济和社会效益。
1 材料与方法
1.1 试验材料
试验所用的观赏羽扇豆种子购自浙江虹越花卉有限公司,试管苗材料由江西省科学院生物资源研究所培育。
1.2 试验方法
1.2.1 污染防止处理 将观赏羽扇豆种子在4℃低温下预处理15 d 后,选取均匀、饱满种子,自来水室温条件下浸泡4~6 h,使其吸水膨胀后,用流水冲洗30 min。预处理种子分别使用0.1%高锰酸钾、70%乙醇和0.1%升汞,按照L9(34)正交表进行3 因素3 水平试验处理,因素水平见表1。处理好的种子接种到MS+6 g/L 琼脂+45 g/L 白糖培养基上,每组处理3 个重复,每个重复接种30 粒种子,培养25 d 后,统计污染率。

表1 污染防止L9(34)正交因素水平Tab.1 L9(34)orthogonal factors and levels of pollution control
1.2.2 褐化控制处理 预处理的观赏羽扇豆种子按照1.2.1 方法选取的适宜组合消毒后,分别接种到添加吸附剂(活性炭、聚乙烯吡咯烷酮)和抗氧化剂(维生素C、柠檬酸)的MS+0.5 g/L 6-BA+6 g/L琼脂+45 g/L 白糖培养基上,吸附剂和抗氧化剂的处理浓度见表2。每处理3 个重复,每个重复接种30粒种子,培养25 d 后,统计褐化率。
1.2.3 玻璃化控制处理 随机选取观赏羽扇豆第一次继代培养后的正常苗和玻璃化苗,利用干重法测定组织含水量,丙酮法[4]测定叶绿素含量,蒽酮比色法[5]测定可溶性糖和淀粉含量。
将选取的观赏羽扇豆第一次继代培养后的正常苗,接种到按照L16(45)正交表进行的4 因素3 水平试验处理组合中,因素水平见表3。基本培养基为MS+0.5 mg/L 6-BA+0.8 mg/L GA3+2 g/L AC。每组处理3 个重复,每个重复接种30 个正常苗,培养30 d 后,统计玻璃化率。

表2 吸附剂与抗氧化剂处理Tab.2 Treatments of absorbents and antioxidants to control browning

表3 玻璃化控制L16(45)正交因素水平Tab.3 L16(45)orthogonal factors and levels of hyperhydric control
2 结果与分析
2.1 观赏羽扇豆组织培养污染防止研究
通过调查分析,可用于组织培养外植体消毒的方法很多[6],如升汞、双氧水、次氯酸钠、高锰酸钾、碘化钾、乙醇等等。经全面考虑以及在以往试验的基础上[3],本研究最后确定0.1%高锰酸钾、70%乙醇和0.1%升汞为试验因素,进行3 因素3 水平正交试验,结果见表4。一方面,根据正交试验的特性和试验指标污染率,KA2<KA3<KA1、KB2<KB3<KB1、KC3<KC2<KC1,可断定A2、B2和C3分别为A、B、C 三因素的优水平。三个因素的优水平组合A2B2C3为本试验的最优水平组合,即观赏羽扇豆组织培养消毒的最优方法为0.1%高锰酸钾30 min,70%乙醇40 s,0.1%升汞9 min。另一方面,根据极差Rj的大小,可以判断各因素对试验指标的影响主次。比较本试验各R 值的大小,可见RC>RA>RB,所以三因素对污染率影响的主→次顺序是C→A→B,即0.1%升汞影响最大,其次是0.1%高锰酸钾,70%乙醇影响较小。其原因可能是0.1%高锰酸钾可有效清洗掉观赏羽扇豆种子表面的菌类物质,而升汞则可彻底杀死种子胚乳表面残留的菌类物质,所以两者配合可有效降低污染率。
2.2 观赏羽扇豆组织培养褐化控制研究
处理好的观赏羽扇豆种子接种到添加不同浓度的吸附剂(表5)和抗氧化剂(表6)的培养基中,结果显示,培养25 d 后,添加活性炭、PVP、维生素C 和柠檬酸的外植体平均褐化率分别是8.3%、13.0%、15.0%和10.8%,均显著低于CK,其中吸附剂活性炭效果最好,抗氧化剂柠檬酸次之。添加1.0 g/L 活性炭时,平均褐化率比CK 显著降低了6.4%,褐化程度较轻;添加2.0 g/L 活性炭时,平均褐化率最低,比CK 显著降低了12.3%,褐化程度最轻;当活性炭浓度增加到3.0 g/L,平均褐化率反而显著提高(比CK 降低了9.2%)。由此表明,活性炭可显著降低观赏羽扇豆种子褐化率,但当活性炭增加到一定浓度时,高浓度的活性炭在吸附培养基中有害物质的同时,也吸附了培养基中的无机盐、激素等营养成分[7],致使培养基中的有效成分发生改变,不利于外植体诱导,褐化程度相对加重,因此必须选择合适的活性炭浓度。
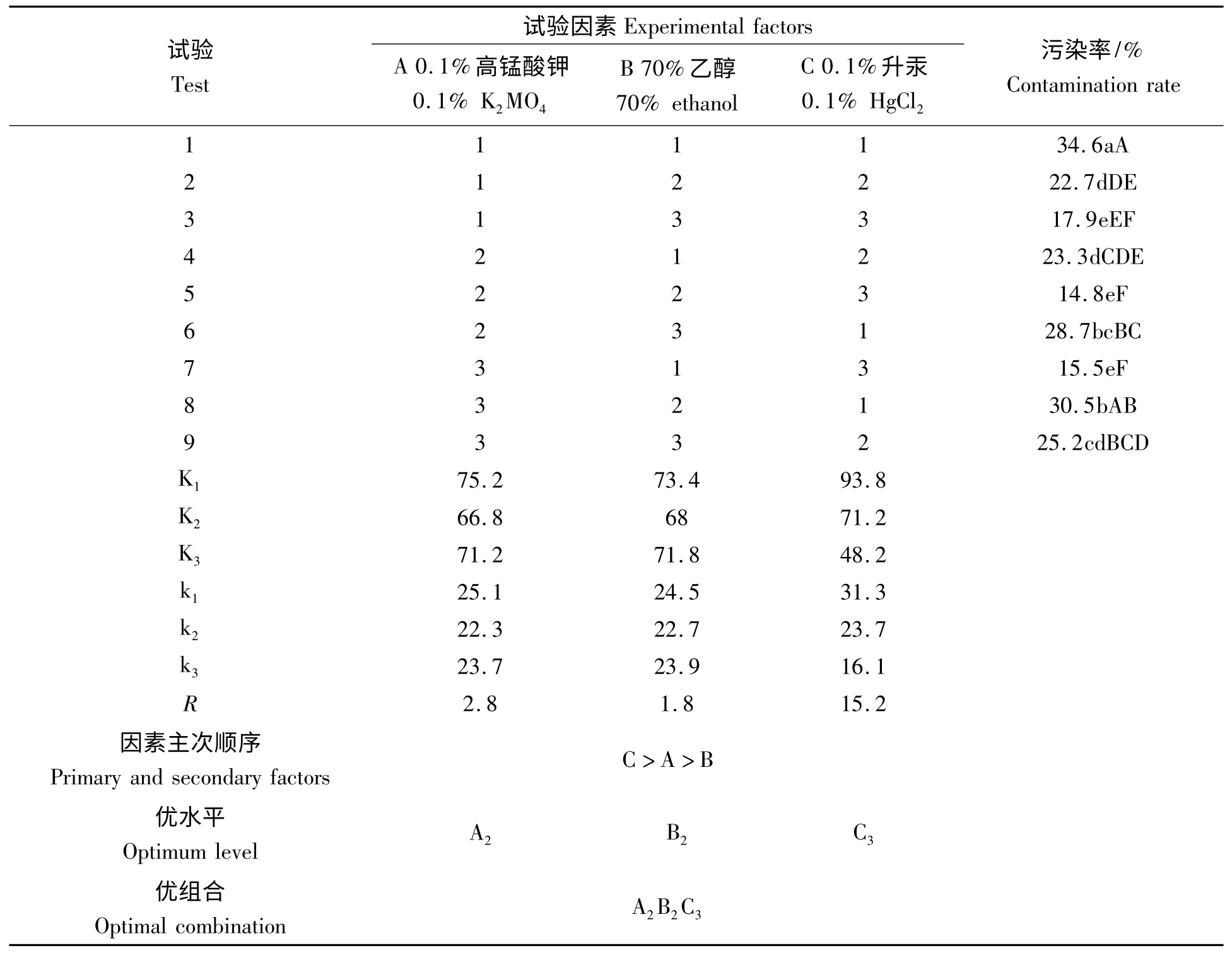
表4 污染防止L9(34)正交试验方案及结果Tab.4 L9(34)orthogonal experimental program and result of pollution control

表5 吸附剂对褐化的影响及结果Tab.5 Effect and result of absorbents on browning control
表6 可知,观赏羽扇豆褐化率同时受抗氧化剂种类和抗氧化剂浓度的影响,其中柠檬酸对观赏羽扇豆褐化抑制效果较维生素C 显著,且浓度越高,褐化率就越低,褐化程度越轻。试验观察结果还表明,随着柠檬酸浓度的升高,观赏羽扇豆诱导苗生长状况缓慢。这可能是柠檬酸促使外植体氧化酶活性降低,同时抑制总酚的生成和扩散,有效控制培养基褐变的产生,但当柠檬酸浓度过高时,植物细胞渗透势增大,造成膜破坏,影响生长[8]。综合考虑柠檬酸对观赏羽扇豆褐化抑制和生长的影响,还有待于进一步研究柠檬酸的适宜浓度,或者研究吸附剂和抗氧化剂联合使用效果。

表6 抗氧化剂对褐化的影响及结果Tab.6 Effect and result of antioxidants on browning control
选取吸附剂(活性炭2.0 g/L)和抗氧化剂(柠檬酸5.0 g/L)2 个处理和CK,进行观赏羽扇豆褐变变化趋势分析。结果显示(图1),3 个处理的褐化率增长趋势为CK>柠檬酸>活性炭;且均在25 d 以内培养时,褐化率增幅较小;培养超过25 d 后,褐化率增幅明显增大。其中CK 在培养第5 天最早发现褐变,柠檬酸在培养第10 天发现褐变,活性炭在培养第15 天最晚发现褐变。随着培养时间的推移,褐变越严重,不同处理之间褐化率差异逐渐缩小。因此,观赏羽扇豆外植体培养的周期应控制在25 d 之内。
2.3 观赏羽扇豆组织培养玻璃化控制研究
观赏羽扇豆试管苗在相同培养条件下,第1 次继代培养25 d 后,取苗高相对一致的正常苗和玻璃化苗,测定其生理生化的变化结果(表7)显示,玻璃化苗和正常苗生理生化指标存在显著差异。其中,玻璃化苗组织含水量、叶绿素a/b 比值和可溶性糖含量分别比正常苗显著高出3.2%,0.63,3.39 mg/L;与其相反,玻璃化苗叶绿素a、叶绿素b、叶绿素总量、淀粉含量和干物质积累却分别比正常苗显著降低了0.48,0.18,0.62,2.46 mg/L 和21%。说明玻璃化苗干物质积累降低,叶绿素含量减少,光合能力减弱,导致光合直接产物可溶性糖转化力和光合积累产物淀粉合成能力下降。

图1 培养天数对3 种处理褐化率的影响Fig.1 Effect of culture days on browning rate of three treatments

表7 正常苗与玻璃化苗生理生化指标对比结果Tab.7 Physiological and biochemical results of normal and hyperhydric shoots
表8 研究了不同水平组合的蔗糖、琼脂、培养温度和光照时间对观赏羽扇豆第1 次继代后的试管苗产生玻璃化现象的影响,结果发现:培养条件一致情况下,蔗糖2(30 g/L)、琼脂3(6 g/L)、培养温度2(20 ℃)和光照时间3(14 h)组合时,试管苗玻璃化率最低为3.1%。对玻璃化率影响最大的因素是培养温度,其次是蔗糖和琼脂浓度,光照时间的影响最小。

表8 玻璃化控制L16(45)正交试验方案及结果Tab.8 L16(45)orthogonal experimental program and result of hyperhydric control
3 结论与讨论
外植体消毒是花卉组织培养体系建立过程中的首要基础工作,也是最关键的步骤,消毒方法选择不合理,将会引起严重的污染问题。大量研究表明,不同植物适宜的消毒方法差异很大。郑颖等[9]采用0.1%升汞消毒台湾桤木外植体9 min,并在培养基中添加50 mg/L 利福平、20 mg/L 盐酸四环素或40 mg/L盐酸四环素可将污染率控制在7.2%~15.6%。而大叶藻种子最好的消毒方法则是,分别用75%乙醇和1.5% KI 处理10 min,且不影响后续种子的萌发[6]。本研究中选取了3 种常用的种子消毒剂,进行了不同处理时间组合对观赏羽扇豆种子消毒效果影响的研究。结果显示,用0.1%高锰酸钾浸泡30 min,再用70%乙醇处理40 s,最后用0.1%升汞处理9 min 是观赏羽扇豆种子消毒的较好方法。而对于在培养中添加抗生素能否抑制观赏羽扇豆组织培养过程中菌污染的影响,还有待于进一步开展研究。
在培养基中,加入抗坏血酸、柠檬酸、硫代硫酸钠、半胱氨酸、聚乙烯吡咯烷酮等抗氧化剂,利用这些物质的还原性,可有效抑制酚类物质的氧化,从而降低褐化的发生。附加抗坏血酸0.125 g/L、亚硫酸钠0.125 g/L 和柠檬酸2.5 g/L 的MS 培养基,可明显抑制3 个大花蕙兰品种产生褐变[10]。阙生全[11]在各种配比的培养基中,以添加吸附剂(活性炭和PVP)的培养基控制茶树的褐变效果最好;添加抗氧化剂的培养基褐化较严重,其中添加硫代硫酸钠培养的外植体褐化最严重。本研究结果则证明,单独添加吸附剂和抗氧化剂均能抑制观赏羽扇豆褐变的发生,其中吸附剂活性炭2.0 g/L 的抑制效果最好,抗氧化剂柠檬酸5.0 g/L 的抑制效果次之。然而,除吸附剂和抗氧化剂的种类外,还和其浓度有关,也有待进一步探索复合吸附剂或复合抗氧化剂比例是否对抑制褐化效果更好。
玻璃化是植物组织培养中试管苗的一种生理失调症状,严重影响组培快繁体系的稳定性,造成人力、财力、物力的极大浪费。植物种类不同,引起试管苗被玻璃化的主导因素也存在一定差异。防风[12]组织培养过程中,增加培养基内琼脂和蔗糖浓度,可以降低玻璃化率;当6-BA 浓度超过2.0 mg/L、光照低于2 000 lx、培养瓶内湿度较大时,玻璃化率明显提高。培养基的种类和激素的使用浓度是引起花楸组织培养玻璃化的2 个主要原因[13]。光照时数少于8 h,光照强度低于1 000 lx 时,容易引起洋桔梗玻璃化[14]。为了防止观赏羽扇豆组培中玻璃化现象,我们采取了调整蔗糖浓度、琼脂浓度、培养温度和光照时间等措施,结果表明,选取蔗糖浓度30 g/L、琼脂浓度6 g/L、培养温度20 ℃和光照时间14 h,可明显抑制玻璃化现象。也有研究表明,在培养基中附加活性炭[15]、赤霉素[16]、青霉素[17]、多效唑[18]等措施均可有效减轻或防治玻璃化。本试验没有进行添加附加物这方面的探讨,今后将逐步进行深入研究。
[1]王小玲,高柱,余发新,等.观赏羽扇豆离体培养生根关联酶活性及可溶性蛋白含量变化规律研究[J].云南农业大学学报,2010,25(6):835-839.
[2]王小玲,高柱,余发新,等,观赏羽扇豆繁殖技术研究[J].安徽农业科学,2008,36(29):12653-12655.
[3]Wang X L,Gao Z,Liu T Y,et al.Primary establishment of the tissue culture technique and regeneration system for ornamental Lupinns polyphyllus[J].Journal of Northeast Agricultural University,2009,16(3):7-12.
[4]高俊凤.植物生理学试验技术[M].西安:世界图书出版公司,2000.
[5]王小玲,赵忠,高柱.插壤温度对四倍体刺槐硬枝插条生根过程中生理生化的影响[J].植物生理学报,2012,48(7):699-704.
[6]刘延岭,李晓捷,崔翠菊,等.大叶澡组织培养中外植体消毒方法的研究[J].农学学报,2013,3(3):54-56.
[7]朱至清.二十世纪我国植物学家对植物组织培养的贡献[J].植物学报,2002,44(9):75-84.
[8]黄玮婷,曾宋君,方中明.柠檬酸对珍珠矮根状茎分化及其褐变抑制的研究[J].武汉生物工程学院学报,2012,8(4):251-255.
[9]郑颖,秦红枚,黎云祥.台湾桤木组织培养中污染和褐化防止[J].江苏农业科学,2013,41(2):64-65.
[10]周音,张建军,殷丽青.复合抗氧化剂对大花蕙兰组织培养的影响[J].上海农业学报,2013,29(2):14-16.
[11]阙生全,彭凌,朱必凤,等.油茶组织培养过程中防止褐变的研究[J].韶关学院学报:自然科学版,2006,27(3):67-69.
[12]马晓菲,张家菁,于元杰.防风组织培养中的玻璃化现象研究[J].分子植物育种,2013,11(3):421-430.
[13]王爱芝,沈海龙,张鹏,等.花楸组织培养中玻璃化现象的发生与防治[J].东北林业大学学报,2009,37(10):18-22.
[14]陈小凤,龚明霞,方锋学,等.自然光及NH4+对洋桔梗玻璃化的影响[J].广西农业科学,2008,39(4):519-522.
[15]王爱勤,何龙飞,裴润梅,等.组培条件对不同品种芦荟试管苗玻璃化的影响[J].中国农学通报,2002,18(5):46-52.
[16]Amita J,Husain S.Micropropagation of Dianthus caryophyllus L.control of vitrification[J].Journal of Plant Biochemistry and Biotechnology,1997,6(1):35-37.
[17]高疆生,张卫芳,段黄金,等.克服香石竹试管苗玻璃化研究[J].北方园艺,2001(3):34-36.
[18]郑丽屏,李文庚,王玲,等.多效唑在重瓣丝石竹组织培养中的作用[J].资源开发与市场,2000,16(5):276-277.
