游离氨和游离亚硝酸对亚硝态氮氧化菌活性的影响
2014-12-14张宇坤王淑莹董怡君彭永臻北京工业大学北京市水质科学与水环境恢复工程重点实验室北京100124
张宇坤,王淑莹,董怡君,彭永臻 (北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京 100124)
游离氨和游离亚硝酸对亚硝态氮氧化菌活性的影响
张宇坤,王淑莹*,董怡君,彭永臻 (北京工业大学北京市水质科学与水环境恢复工程重点实验室,北京 100124)
高浓度游离氨(FA)或游离亚硝酸(FNA)条件下硝化过程常出现亚硝态氮积累,FA、FNA对亚硝态氮氧化菌(NOB)的影响并不清楚.首先用高浓度亚硝态氮污水富集培养 NOB,对富含 NOB的污泥进行荧光原位杂交技术(FISH)分析表明,Nitrobacter占细菌总数比例为(71±5)%.用此污泥考察不同 FA、FNA 浓度对 NOB活性的影响.结果表明,NOB的活性随着 FA 浓度的增大逐渐减小,当 FA 浓度在10mgNH3-N/L左右时,NOB的活性仅为FA为0时的50%.低浓度的FNA(FNA < 0.03mg HNO2-N/L)对NOB活性具有促进作用;当FNA≥0.2mg/L时,NOB的活性被完全抑制.采用Aiba模型计算得到FNA对NOB的抑制常数KI,FNA,NOB为0.0968mg/L. FNA在0.0968mg/L左右时NOB活性仅为FNA为0.003mg/L时的50%.
活性;游离氨;游离亚硝酸;亚硝态氮氧化菌;抑制
生物脱氮技术是城市污水处理的常用技术,硝化过程是生物脱氮过程的限速步骤[1].先由氨氧化菌(AOB)将氨氮氧化为亚硝态氮,再由亚硝态氮氧化菌(NOB)将亚硝态氮氧化为硝态氮.短程硝化反硝化工艺(PND)就是将硝化过程控制在氨氧化阶段,防止亚硝态氮氧化菌将亚硝态氮氧化为硝态氮.由于其具有节省 25%的曝气能耗、减少 40%的碳源投量等优点,成为污水处理领域的研究热点[2-4].
实现短程硝化反硝化工艺需要抑制NOB,使得AOB成为硝化菌群的优势菌种.AOB和NOB竞争的影响因素有:pH值[5]、温度[3]、溶解氧(DO)浓度[6]、游离氨(FA)[7-9]、游离亚硝酸(FNA)[10-12]等.其中,FA、FNA是影响AOB、NOB竞争的重要因素, Anthonisen[13]发现高浓度氨氮和亚硝态氮对硝化菌群存在抑制,但Van等[14-15]认为FA、FNA才是抑制硝化菌群活性的真正抑制剂.FNA对微生物活性和生长速率存在强烈的抑制作用,对污水处理厂微生物种群结构也存在影响[16].目前,现有的研究多集中于FA或FNA对AOB和短程硝化效果的影响[5,7-12],但对 NOB的影响还研究较少[17-18].污水处理厂污泥中 NOB占细菌总数比例一般低于 5%,采用此类污泥研究 NOB的性质容易影响试验结果的可靠性和稳定性.对NOB进行富集培养有利于提高 NOB占细菌总数比例,从而获得更加准确的实验结论.Vadivelu等[17-18]尝试富集培养NOB,所得到的系统污泥浓度较低(可挥发性固体浓度约为 650mg/L),与实际污水处理设施污泥浓度差别较大.关于采用富集程度高的富含NOB污泥研究FA、FNA对NOB的活性影响还未见报道.本试验拟采用序批式反应器(SBR)装置富集培养NOB,以富含NOB的活性污泥为研究对象,采用批次试验研究FA、FNA浓度对 NOB活性的影响,并对 FA、FNA影响NOB活性的原因进行分析,旨在为短程硝化反硝化技术的应用提供理论支持.
1 材料与方法
1.1 亚硝态氮氧化菌富集装置及运行方式
采用SBR装置富集亚硝态氮氧化菌,SBR有效容积为 8L,排水比为 25%;通过温控装置控制温度为(24±1)℃;曝气量恒定为 0.2m3/h;通过 pH探头的反馈信息控制蠕动泵,调节SBR装置内混合溶液的pH值在7~7.5之间.每周期运行6h:进水(3h 20min),曝气(5h,进水开始时即开始曝气),沉淀0.5h,排水0.3h,闲置0.2h;其中进水方式为连续进水,每周期进水总量为2L.经过420d富集培养,NOB富集装置每周期可处理进水-N浓度为1000mg/L的人工配水.
1.2 试验用水水质及污泥来源
采用人工配水富集 NOB, 试验用水均为灭菌后的去离子水.以 NaNO2作为唯一的能源, 其进水浓度范围为100~1000mg-N/L每升配水中, 其他成分如下[17]:0.4g NaHCO3, 1g KH2PO4, 1.31g K2HPO4,以及2mL的微量元素溶液. 每升微量元素溶液中成分为[11]:1.25g EDTA,0.55g ZnSO4·7H2O, 0.4g CoCl2·6H2O, 1.275g MnCl2·4H2O, 0.4g CuSO4·4H2O, 0.05g Na2MoO4·2H2O, 1.375g CaCl2·2H2O, 1.25g FeCl3·6H2O, 44.4g MgSO4·7H2O. 接种污泥取自处理某大学居民区生活污水的中试 SBR,其污泥具有正常的硝化功能.
1.3 FA和FNA对NOB活性影响的批次试验
游离氨(FA)一般采用下式计算[13]:

由公式(1)可知,FA是与氨氮浓度、温度、pH值三者成正相关的函数.本试验拟采用恒定温度(19℃)、恒定 pH(7.7),改变氨氮浓度来获得不同FA浓度.
游离亚硝酸(FNA)一般采用下式计算[13]:

FNA是与亚硝态氮浓度、温度、pH值三者相关的函数,且与亚硝态氮浓度正相关,与pH值、温度呈负相关.本试验拟采用恒定温度(19℃)、恒定pH(7.0),改变亚硝态氮浓度获得不同FNA浓度.
采用批次试验考察 FA、FNA浓度对 NOB活性的影响,批次试验采用体积为500mL锥形瓶,每个批次反应时间为30min,每5min取样过滤并测定氨氮、亚硝态氮、硝态氮.反应过程中控制DO大于5mg/L.FA抑制试验开始前根据试验需要投加一定量的亚硝酸钠、碳酸氢铵,使得混合液中亚硝态氮浓度 20mgNO2--N/L,氨氮浓度见表1; FNA抑制试验采取的亚硝态氮浓度见表2.批次试验结束时测定污泥浓度(MLSS)、可挥发性固体浓度(MLVSS).
1.4 Aiba动力学模型
Aiba动力学模型[19]为底物抑制动力学模型,本试验中FNA既是NOB基质底物,同时也是抑制剂,通过指数相来模拟FNA对NOB活性的影响,动力学模型如公式(3)所示:
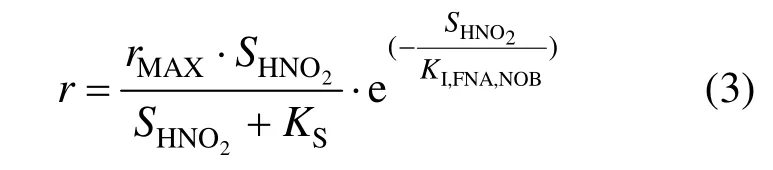
其中:r为NOB的比亚硝态氮氧化速率, rMAX为最大比亚硝态氮氧化速率,为FNA浓度(mgHNO2-N/L),KS为 NOB的底物半饱和常数,KI,FNA,NOB为FNA对NOB的抑制常数.本试验中Ks值取1.5mg/L[17],在pH为7、温度为19度时FNA值为0.000406mgHNO2-N/L,远小于本试验所取最小FNA浓度(0.003mgHNO2-N/L),因此方程(3)可以简化为:

1.5 检测指标及分析方法
氨氮、亚硝态氮、硝态氮、MLSS、MLVSS均采用标准方法测定[20].荧光原位杂交技术(FISH)采用 Amann[21]的操作方法进行,采用 4%PFA, 4℃条件下对污泥样品固定 2~3h.对固定后的污泥样品超声分散 1min,将样品滴加在明胶包被过的载玻片上,干燥后先后浸泡于50%、80%和 98%的乙醇溶液中脱水 3min.杂交缓冲液组成包括0.9mol/L NaCl、20mmol/L Tris/HCl,0.01% SDS和甲酰胺(甲酰胺FA浓度见表2,pH为7.2).将荧光标记的寡核苷酸探针溶解于杂交缓冲液中,在46℃下与污泥样品杂交2h.采用的寡核苷酸探针列于表3.杂交结束后,采用洗脱缓冲液在48℃下洗脱20min.在干燥后的样品上滴加抗荧光衰减液,对每个污泥样品随机拍摄20~25张照片(OLYMPUS BX61 荧光显微镜)用于定量分析.

表1 游离氨批次试验条件Table 1 Experimental conditions applied in FA batch tests

表2 游离亚硝酸批次试验条件Table 2 Experimental conditions applied in FNA batchtests

表3 所用寡核苷酸探针碱基序列Table 3 Oligonucleotide probes used in this study
2 结果与讨论
2.1 NOB富集装置典型周期污染物变化情况及FISH分析
分析 FISH 结果,将图 2(A)和(B)进行对比,可以发现硝化杆菌 Nitrobacter是污泥中优势菌属,经 Image-pro-plus 6.0计数统计发现,Nitrobacter数量占细菌总数比例约为(71±5)%;将图 2(C)和(D)进行对比发现,NOB的另一种重要的硝化螺旋菌属 Nitrospira含量很少,Nitrospira数量占细菌总数比例约为(2 ± 1)%.这说明在本试验采用的培养方法更适合Nitrobacter的生长.
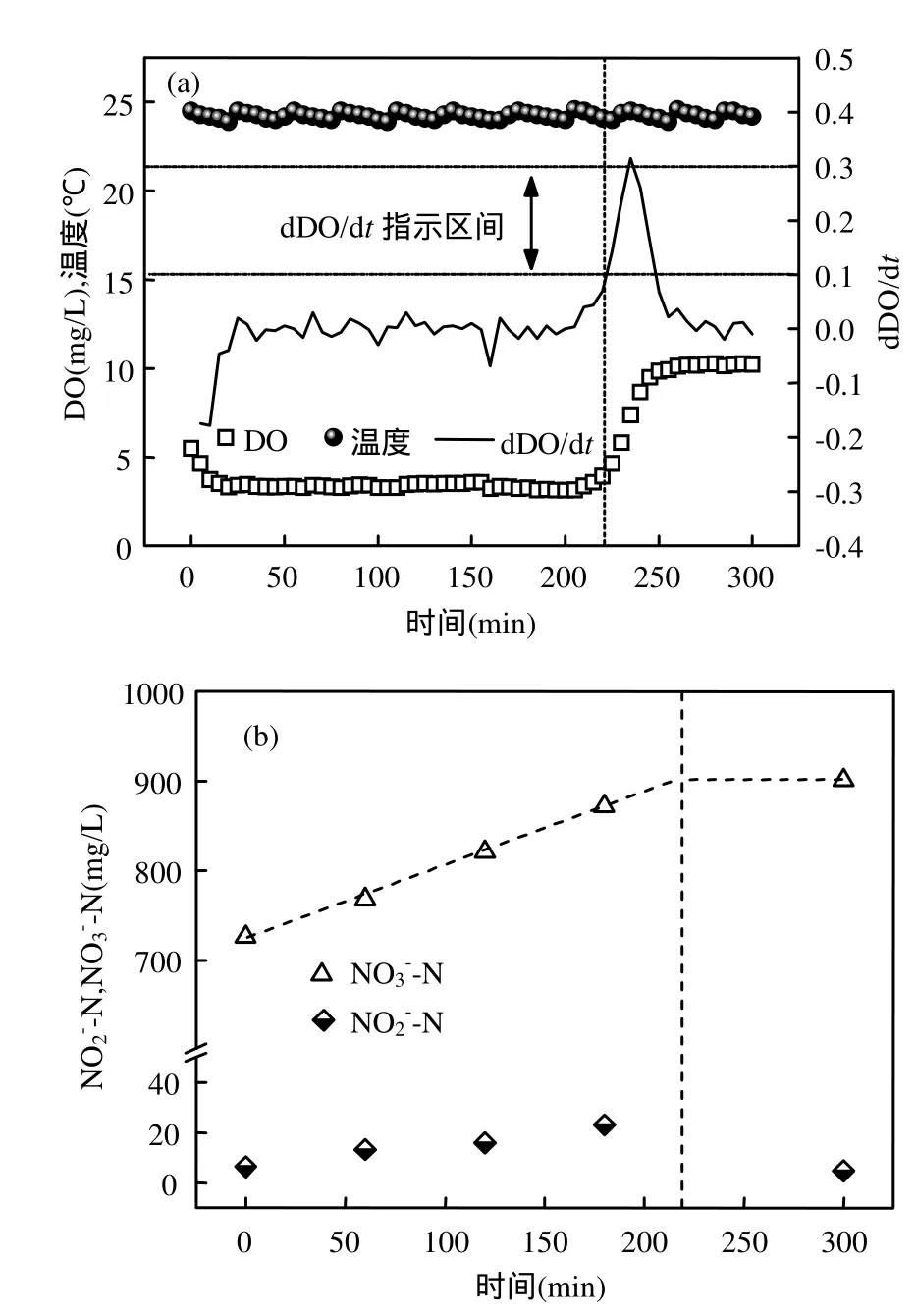
图1 典型周期中-N,-N及参数变化规律(第435d)Fig.1 Variations of nitrite, nitrate and parameters with time in some typical cycle (435d)

图2 第422d的NOB的FISH图Fig.2 FISH images for NOB on day 422
2.2 游离氨(FA)对NOB活性影响
图3显示了NOB活性随FA浓度的变化.将批次试验的比亚硝态氮氧化速率与对照实验(FA=0)的比亚硝态氮氧化速率相除,采用百分数比值来表征NOB的活性.可以看出,当FA浓度小于0.2mgNH3-N/L时,FA对NOB的活性影响不大(NOB活性大于 90%);当 0.2 式中:Y为NOB活性(%),X为FA浓度(mgNH3-N/L),相关性R2= 0.96.FA对NOB的抑制效果明显,当FA浓度为10mgNH3-N/L时,NOB的活性仅为FA为0时的50%.与NOB相比,FA对AOB的影响更小,Vadivelu等[22]认为,FA浓度达到16mgNH3-N/L时对AOB的活性几乎没有影响.刘牡[11]采用两级UASB-A/O工艺处理垃圾渗滤液,在 FA >20mgNH3-N/L的条件下即可实现短程硝化的启动;吴丽娜等[9]发现适当的 FA 浓度(40~70mgNH3-N/L)可以实现稳定的短程硝化.高浓度的FA条件更有利于AOB,进而实现淘洗NOB实现短程硝化.但FA浓度对NOB活性抑制研究并没有形成一致的结论,Blackburne等[18]报道当FA为100mgNH3-N/L时,Nitrobacter的活性还高达 70%,这可能是由于所用富含 NOB的污泥生长环境、污泥浓度等存在差异. 图3 游离氨(FA)浓度对NOB活性的影响Fig.3 Effect of free ammonia inhibition on NOB activity 图4显示了FNA浓度对NOB活性的影响.结果显示低浓度的FNA(FNA < 0.03mg HNO2-N/L)对 NOB活性具有促进作用:与 FNA 为0.003mg/L相比, FNA为0.005mg/L时NOB的活性提高了 20%;但随着 FNA浓度的增大(FNA≥0.03mg/L),NOB 的活性也随之降低,当FNA≥0.2mg/L时,NOB 的活性被完全抑制.采用Aiba等[19]的产物抑制动力学模型(公式 4)对NOB活性与 FNA浓度的结果进行拟合,并计算FNA对NOB的动力学抑制常数KI,FNA,NOB.获得的拟合方程为: 其中 Y为 NOB的活性(%),X为 FNA浓度(mgHNO2-N/L),相关性R2=0.96.由拟合结果可计算得到KI,FNA,NOB= 1/10.33= 0.0968mgHNO2-N/L.Vadivelu[22]认为AOB的FNA抑制常数KI,FNA,AOB在 0.50~0.63mgHNO2-N/L之间.因此,FNA对NOB活性的抑制大于对AOB的抑制.韩晓宇[12]采用 A/O工艺处理消化污泥脱水液,发现维持FNA > 0.6mgHNO2-N/L可获得80%以上的亚硝积累率,但当撤去FNA抑制后3d,短程硝化迅速破坏;傅金祥等[10]、刘牡等[11]认为,当FA抑制作用随着氨氮的氧化而减弱时, FNA的抑制作用(0.09~ 0.4mgHNO2-N/L)是维持短程硝化的重要影响因素.以上结果支持了高FNA浓度下有利于实现短程硝化的结论. 图4 游离亚硝酸浓度(FNA)对NOB活性的影响Fig.4 Effect of free nitrous acid inhibition on NOB activity 3.1 经过420d的富集培养,NOB富集装置的污泥中 NOB成为优势菌种.FISH分析结果显示Nitrobacter占细菌总数比例为(71±5)%,Nitrospira占细菌总数比例为(2 ± 1)%. 3.3 FA对NOB活性具有强烈的抑制作用,NOB的活性随着FA浓度的增大逐渐减小,当FA浓度在10mgNH3-N/L附近时,NOB的活性仅为FA为0时的50%. 3.4 低浓度的FNA(FNA < 0.03mgHNO2-N/L)对 NOB 活性具有促进作用;当 FNA≥0.2mgHNO2-N/L时,NOB的活性被完全抑制;FNA 对 NOB 的 抑 制 常 数 KI,FNA,NOB为0.0968mgHNO2-N/L. [1]Prosser J I. Autotrophic nitrification in bacteria [J]. Advances in Microbial Physiology, 1990,30:125-181. [2]Gu S B, Wang S Y, Yang Q, et al. Start up partial nitrification at low temperature with a real-time control strategy based on blower frequency and pH [J]. Bioresource Technology, 2012,112(5):34-41. [3]Guo J H, Peng Y Z, Huang H J, et al. Short- and long-term effects of temperature on partial nitrification in a sequencing batch reactor treating domestic wastewater [J]. Journal of Hazardous Materials, 2010,179(1-3):471-479. [4]Yang Q, Peng Y Z, Liu X H, et al. Nitrogen removal via nitrite from municipal wastewater at low temperatures using real-time control to optimize nitrifying communities [J]. Environmental Science and Technology, 2007,41(23):8159-8164. [5]魏 琛,罗固源.FA和pH值对低C/N污水生物亚硝化的影响[J]. 重庆大学学报, 2006,29(3):124-127. [6]Guo J H, Peng Y Z, Wang S Y, et al. Long-term effect of dissolved oxygen on partial nitrification performance and microbial community structure [J]. Bioresource Technology, 2009,100(11):2796-2802. [7]于德爽,殷金兰,王晓霞,等.控制DO及FA条件下短程硝化过程系统稳定性研究 [J]. 环境工程学报, 2011,5(12):2677-2680. [8]张 亮,张树军,彭永臻.污水处理中游离氨对硝化作用抑制影响研究 [J]. 哈尔滨工业大学学报, 2012,44(2):75-79. [9]吴莉娜,彭永臻,王淑莹,等.游离氨对城市生活垃圾渗滤液短程硝化的影响 [J]. 环境科学, 2008,29(12):3428-3432. [10]傅金祥,汪 洋,杨 勇.FA与FNA对A/O工艺短程硝化处理垃圾渗滤液的影响 [J]. 工业水处理, 2012,32(5):48-51. [11]刘 牡,彭永臻,吴莉娜,等.FA与FNA对两级UASB-A/O处理垃圾渗滤液短程硝化的影响 [J]. 化工学报, 2010,61(1):172-179. [12]韩晓宇,张树军,甘一萍,等.以 FA与FNA为控制因子的短程硝化启动与维持 [J]. 环境科学, 2009,30(3):809-814. [13]Anthonisen A, Loehr R, Prakasam T, et al. Inhibition of nitrification by ammonia and nitrous-Acid [J]. Journal Water Pollution Control Federation, 1976,48(5):835-852. [14]Van H, Volcke E, Teruel J, et al. Influence of temperature and pH on the kinetics of the sharon nitritation Process [J]. Journal of Chemical Technology and Biotechnology, 2007,82(5):471-480. [15]Prakasam T, Loehr R. Microbial nitrification and denitrification in concentrated wastes [J]. Water Research, 1972,6(7):859-869. [16]Zhou Y, Adrian O, Melvin L, et al. The role of nitrite and free nitrous acid (FNA)in wastewater treatment plants [J]. Water Research. 2011,45(15):4672-4682. [17]Vadivelu V M, Yuan Z G, Fux C, et al. Stoichiometric and kinetic characterisation of Nitrobacter in mixed culture by decoupling the growth and energy generation processes [J]. Biotechnology and Bioengineering, 2006,94(6):1176-1188. [18]Blackburne R, Vadivelu V M, Yuan Z G, et al. Kinetic characterisation of an enriched Nitrospira culture with comparison to Nitrobacter [J]. Water Research, 2007,41(14):3033-304. [19]Abia S, Sohoda M, Nagatani M. Kinetics of product inhibition in alcohol fermentation [J]. Biotechnology and Bioengineering,1968,10(6):242-248. [20]APHA. Standard methods for the examination of water and wastewater [D]. American Public Health Association Washington,DC, 1995. [21]Amann R I, Krumholz L, Stahl D A. Fluorescent- oligonucleotide probing of whole cells for determinative phylogeneric, and environmental-studies in microbiology [J]. Journal of bacteriology, 1990,172(2):762-770. [22]Vadivelu V M, Keller J, Yuan Z G. Effect of free ammonia and free nitrous acid concentration on the anabolic and catabolic processes of an enriched Nitrosomonas culture [J]. Biotechnology and bioengineering, 2006,95(5):830-839. 致谢:感谢刘丽、董怡君在论文修订、试验方面给予的帮助和支持. Effect of FA and FNA on activity of nitrite-oxidising bacteria. ZHANG Yu-kun, WANG Shu-ying*, DONG Yi-jun,PENG Yong-zhen (Key Laboratory of Beijing for Water Quality Science and Water Environmental Recovery Engineering,Beijing University of Technology, Beijing 100124, China). China Environmental Science, 2014,34(5):1242~1247 Nitrite accumulation always accompanies with the nitrification process under the conditions of high concentration of free ammonia (FA) or free nitrous acid (FNA). The impact of FA and FNA concentration on nitrite-oxidising bacteria (NOB) was not clear. In this study, NOB activated sludge was enriched in a lab-scale SBR system with high concentration of nitrite nitrogen wastewater. The fluorescence in situ hybridization (FISH) analysis of NOB-rich sludge showed that Nitrobacter accounted for (71 ± 5)% of total bacteria. The effects of different FA, FNA concentrations on NOB activity were investigated using the sludge. Results showed that NOB activity decreased gradually with the increase of FA concentration. The NOB was still oxidizing nitrite at half of the maximum activity(FA=0mgNH3-N/L)at an FA concentration of 10mgNH3-N/L. Low FNA concentration (FNA < 0.03 mg HNO2-N/L)was beneficial to enhance NOB activity and it was completely restrained when FNA ≥ 0.2mg/L. The inhibition constant of FNA to NOB (KI,FNA,NOB)was 0.0968mg/L with Aiba model. The activity of NOB decreased 50% as the FNA concentration increased from 0.003mg/L to 0.0968mg/L. activity;free ammonia;free nitrous acid;nitrite-oxidising bacteria;inhibition X703.1 A 1000-6923(2014)05-1242-06 2013-09-18 高等学校博士学科点专项科研基金(20111103130002);北京市科委科技创新平台项目 * 责任作者, 教授, wsy@bjut.edu.cn book=5,ebook=187 张宇坤(1987-),男,黑龙江哈尔滨人,北京工业大学博士研究生,主要从事污水生物处理方面的研究.发表论文12篇.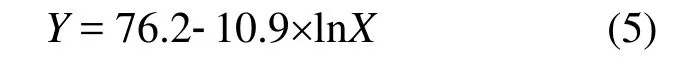

2.3 游离亚硝酸(FNA)对NOB活性的影响
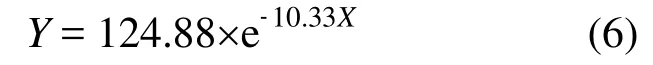

3 结论
