GluK2受体酪氨酸磷酸化突变体的构建及其功能研究
2014-12-11朱秋菊孙长城王亿侯筱宇
朱秋菊 孙长城 王亿 侯筱宇
(江苏省脑病生物信息重点实验室 徐州医学院生物化学与分子生物学研究中心,江苏徐州 221002)
GluK2受体酪氨酸磷酸化突变体的构建及其功能研究
朱秋菊 孙长城 王亿 侯筱宇
(江苏省脑病生物信息重点实验室 徐州医学院生物化学与分子生物学研究中心,江苏徐州 221002)
研究表明谷氨酸过度激活其受体是缺血性脑中风脑损伤的关键,KA受体的GluK2亚基参与了脑缺血再灌注引起的神经细胞的死亡。然而,对于KA 受体在缺血性脑中风中的调节机制知之甚少。本室前期电生理膜片钳研究结果表明Src激酶通过介导GluK2的酪氨酸磷酸化上调KA受体的功能。本课题拟在探索GluK2酪氨酸磷酸化的修饰方式及进一步研究酪氨酸磷酸化修饰GluK2受体功能的调节。
GluK2 酪氨酸磷酸化 Src激酶
缺血性脑损伤中,KA受体的持续激活与神经功能紊乱以及丧失具有密切关系。KA受体在中枢神经系统尤其是海马区广泛表达,是由不同亚基组成的四聚体离子型谷氨酸受体,包括GluK1,2,3;GluK4,5。其中,GluK1,2,3可形成同源功能性KA受体。GluK2基因敲除的小鼠对海人藻酸诱导的神经毒性有抵抗力[1]。我室前期研究表明脑缺血再灌注以及癫痫可以增加GluK2-PSD95-MLK3信号模块的组装继而促进MLK3-JNK3信号通路的活化,最终导致神经元的凋亡[2]。然而,关于KA受体GluK2亚基功能的具体调节机制尚不清楚。
可逆磷酸化是受体功能调节的重要方式之一。越来越多的证据表明酪氨酸磷酸化参与脑缺血后NMDA受体多种功能的调节。然而,关于酪氨酸磷酸化是否参与调节Kainate受体的功能尚未见报道。在哺乳动物中枢神经系统中,非受体酪氨酸蛋白激酶Src激酶家族包括不同的成员:Src,Fyn,Yes,Lck和Lyn[3]。之前的研究表明:脑缺血后,在神经系统大量表达的Src成员在缺血敏感区尤其是海马区的活性显著增强[4-7]。
本研究中采用定点突变体试剂盒获得GluK2胞内区域的酪氨酸位点突变体(Y587/590/844F),用电生理方法检测不同突变体受体功能的变化。结果表明,GluK2亚基的酪氨酸磷酸化位点主要位于胞内区。
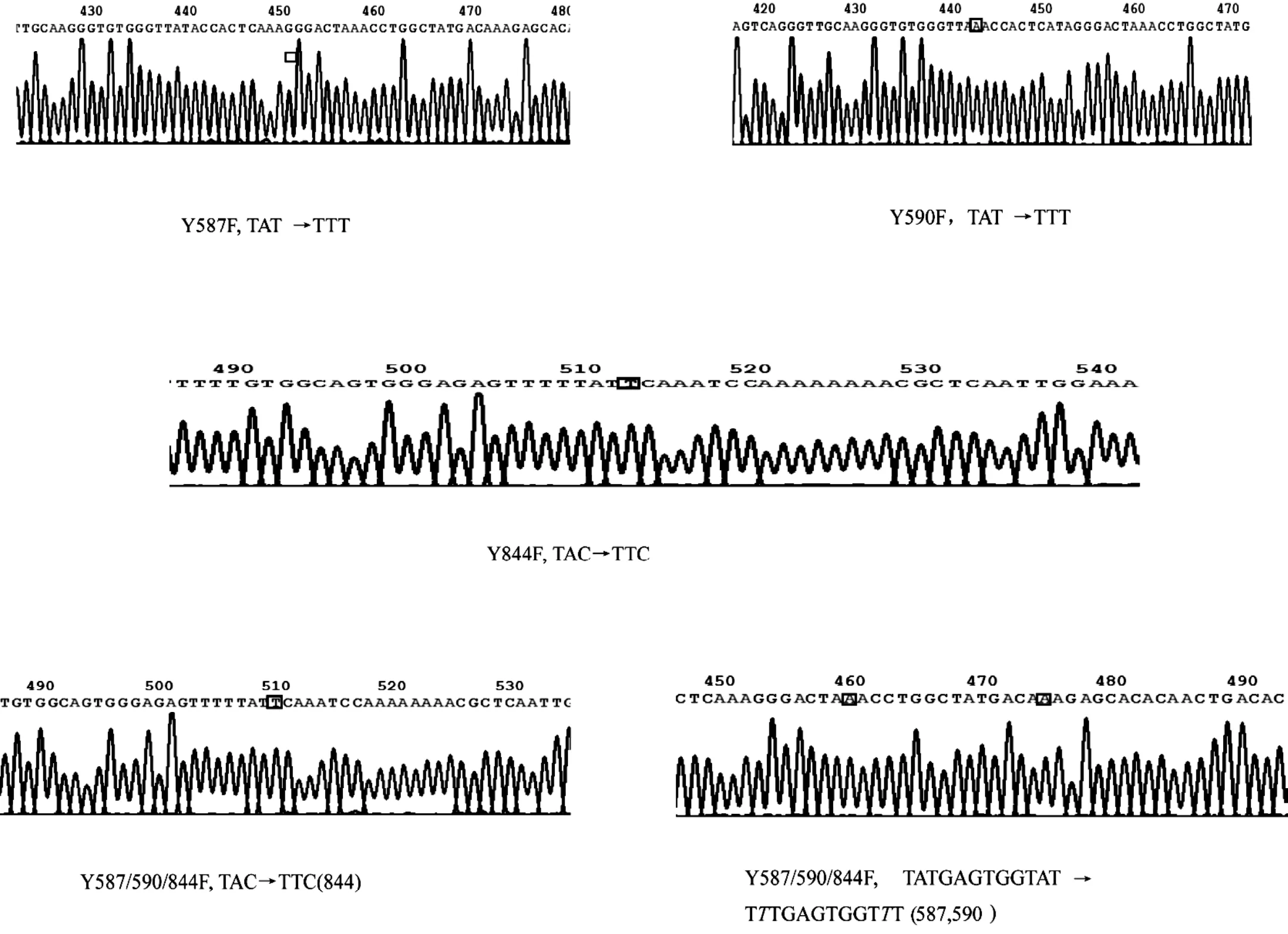
图1 构建的不同突变体的测序结果
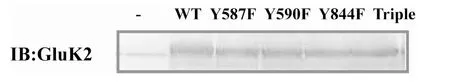
图2 构建的不同突变体在HEK293细胞中的表达
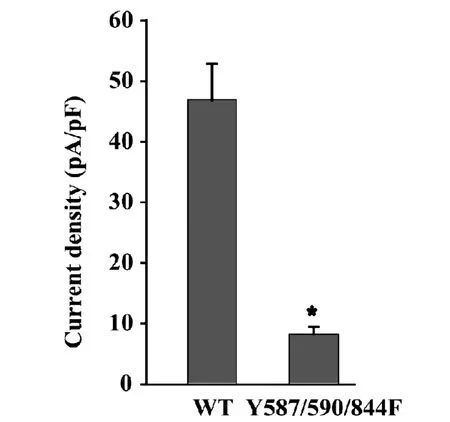
图3 磷酸化缺失型突变体显著降低GluK2受体介导的全细胞电流,结果均表示为平均值±标准误
1 实验材料和方法
1.1 引物和抗体
引物由上海生工生物公司合成提供,兔多克隆抗体抗GluK2/3(06-309)购自Millipore生物公司,碱性磷酸酶AP标记的羊抗兔二抗购自Sigma生物公司。
1.2 GluK2磷酸化缺失突变体的构建
根据文章报道的GluK2受体结构[8],细胞内侧区域存在三个酪氨酸位点,分别为Y587,Y590,Y844。根据GeneBank中GluK2(GenBank:Z11548.1)的序列分别设计在Y587,Y590,Y844对应酪氨酸的附近设计一对上下游引物。以本实验室保存的GluK2(Q型)的重组质粒为模板,利用三个位点定点突变的引物以获得对应三个位点的突变体。Y587F上游引物序列为:
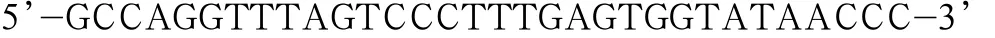
下游引物序列为:
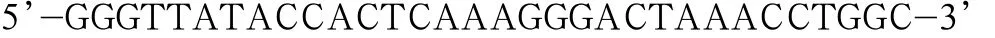
Y590F上游引物序列为:
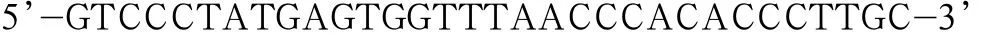
下游引物序列为:
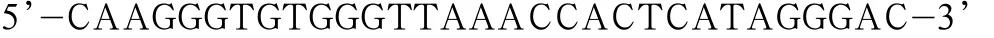
Y844F上游引物序列为:
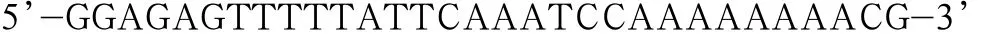
下游引物序列为:
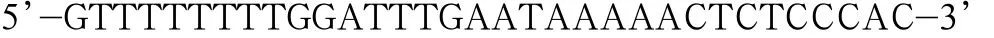
Y587/590F上游引物序列为:
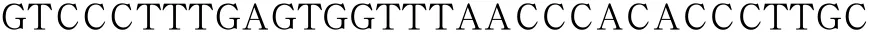
下游引物序列为:
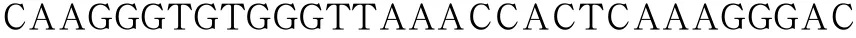
以上述构建成功的GluK2(Q型)Y844F的重组质粒为模板,以Y587/590F双位点突变体引物进行PCR扩增,构建GluK2磷酸化缺失型突变体Y587/590/844F重组真核表达质粒。
以Q型GluK2为模板,按照STRATAGENE 公司快速定点突变试剂盒的操作说明确定合适的实验条件进行PCR反应和质粒转化,按照常规的实验方法进行质粒的筛选,小制备获得的质粒经金斯瑞生物公司测序鉴定
1.3 免疫印迹
按Lowry法进行蛋白质含量测定。构建的质粒转染于HEK293细胞,收取的细胞样品分装及处理均在4℃条件下进行。含相同蛋白量的样品中加入等体积 4×laemmli蛋白上样缓冲液,置沸水浴中5 min变性处理。取等量的变性蛋白质样品(100μg)或IP处理后样品,经SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis;PAGE)分离后,以湿转法电转移至NC膜上。将NC膜置封闭液中室温孵育3 h后,加入一抗工作液,4℃孵育4 h或过夜,TBST洗膜(5min×3)后,加入AP标记的二抗的工作液,室温孵育2小时,TBST洗膜(3min×5),水洗。使用NBT/BCIP试剂盒,在新鲜配制的AP显色液中显色,流水洗涤终止反应。
2 全细胞电压钳
电生理记录方式采用全细胞电压钳模式,钳制电压为-60mV,细胞外液配方(mM):NaCl 140,KCl 5,MgCl2 1,CaCl2 2,HEPES 10,glucose 10。电极内液配方为(mM):CsCl 140,CaCl2 0.5,MgCl2 2,EGTA 5,Na2ATP 3,HEPES 10。使用Axonpatch 700B放大器进行数据测量,Digidata 1322A数据采集器进行数据采集,Clampex和Clampfit软件进行数据分析。
3 实验结果
3.1 成功构建GluK2(Q型)磷酸化缺失型突变体
为了研究GluK2(Q型)可能的磷酸化位点,本实验构建了GluK2受体胞区域序列中的3个酪氨酸位点的单点突变体(Y587F,Y590F,Y844F)以及三点突变体(Triple)。序列比对结果显示,全自动测序的结果中,GluK2 Y587F与GeneBank中GluK2序列仅在1760处碱基的差异(A→T),其余序列完全一致。GluK2 Y590F与GeneBank中GluK2序列仅在1769处碱基的差异(A→T),其余序列完全一致GluK2 Y844F与GeneBank中GluK2序列仅在2531处碱基的差异(A→T),其余序列完全一致。证明所构建的GluK2(Q型)酪氨酸磷酸化缺陷型突变体Y587F、Y590F及Y844F序列均完全正确。
以上述构建成功的GluK2(Q型)Y844F的重组质粒为模板,以Y587/590F双位点突变体引物进行PCR扩增,构建GluK2磷酸化缺失型突变体Y587/590/844F重组真核表达质粒。序列比对结果显示, Y587/590/844F与GeneBank中GluK2序列在1760bp,1769bp和2531bp三个碱基存在差异,均为A→T。结果证明,本实验成功构建GluK2(Q型)酪氨酸磷酸化缺陷型突变体Y587/590/844F。
3.2 构建的各种突变体在COS-7细胞中的表达
将上述构建成功的各种GluK2(Q型)胞内区域酪氨酸位点突变体的真核表达质粒进行中量制备,中制备的质粒采用PEI 转染法进行COS-7细胞转染。转染24h收集细胞,制备的细胞样品以抗GluK2的抗体进行免疫印迹检测GluK2不同突变体的蛋白表达。结果显示Fig.2,GluK2的各种突变体在转染的COS-7细胞中得到很好的表达。结果表明,本实验成功构建的各种GluK2酪氨酸磷酸化缺失型突变体可用于GluK2功能调节的进一步研究。
3.3 Y587/590/844F降低GluK2(Q)同聚型受体电流增强
为了验证GluK2亚基的酪氨酸磷酸化与GluK2同聚型受体功能之间的关系,将三个酪氨酸位点的突变体与活化的Src激酶(aSrc)共转染于HEK293细胞,利用全细胞电压钳技术,记录HEK293细胞上GluK2同聚型受体介导的电流,进一步探索GluK2同聚型受体功能与Src激酶介导的酪氨酸磷酸化反应之间的关系。
结果显示Fig.3,在Src激酶作用下,在Y587/590/844F转染(8.29±1.12pA/pF,n=11)记录到的电流密度小于野生型(wildtype,wt)组(46.95±5.91pA/pF,n=25),差异有统计学意义(P〈0.05),实验结果表明,Src激酶介导的GluK2(Q)酪氨酸磷酸化
对其受体功能的调节主要与其胞内区域的酪氨酸位点有关。
4 讨论
谷氨酸兴奋毒是脑缺血引起神经元功能损伤的重要机制。脑缺血引起各种谷氨酸受体主要包括NMDA 受体和海人藻酸受体的过度激活,最终引起神经元死亡。对受体功能调节机制的研究在阐明脑缺血神经元损伤机制的研究以及脑缺血中风疾病的治疗方面具有非常重要的意义。
报道称离子通道型受体受到多种可逆共价修饰方式的调节。蛋白质的酪氨酸磷酸化是调节蛋白质功能的重要方式之一[9],已有研究报道脑缺血再灌注过程中Src家族激酶介导了NMDA受体、AMPA受体的酪氨酸磷酸化并能上调其功能[10,11]。关于Src家族激酶介导KA受体功能的调节尚未见报道。本文中成功构建各种可能是Src介导KA受体GluK2亚基酪氨酸磷酸化位点的定点突变体,为研究Src激酶催化GluK2酪氨酸磷酸化及其对GluK2受体功能调节的具体过程提供了基础。
[1]Mulle C,Sailer A,Perez-Otano,et al.Altered synaptic physiology and reduced susceptibility to kainate-induced seizures in GluR6-deficient mice.Nature,1998,392:601-605.
[2]Pei DS,Guan QH,Sun YF,et al.Neuroprotcetive effects of GluR6 antisense oligodeoxynucleotides on transient brain ischemia/reperfusion-induced neuronal death in rat hippocampal CA1region.J Neurosci Res,2006,82:642-649.
[3]Du CP,Gao J,Tai JM,Liu Y,QI J,Wang W,Hou XY(2009)Increased tyrosine phosphorylation of PSD-95 by Src family kinases after brain ischaemia.Biochem J 417,277-285
[4]Zhang F,Guo A,Liu C,Comb M,Hu B (2013) Phosphorylation and assembly of glutamate receptors after brain ischemia. Stroke 44:170-176.
[5]Liu Y,Hou XY,Zhang GY,Xu TL(2003)L-type voltage-gated calcium channel attends regulation of tyrosine phosphorylation of NMDA receptor subunit 2A induced by transient brain ischemia.Brain Res 972:142-148.
[6]Choi JS, et al (2005) Activation of Src tyrosine kinase in microglia in the rat hippocampus following transient forebrain ischemia. Neurosci Lett 380:1-5.
[7]Jiang X, et al (2008) Activated Src kinases interact with the N-methyl-D-aspartate receptor after neonatal brain ischemia.Ann Neurol 63:632-641.
[8]Sutcliffe MJ, Wo ZG, Oswald RE(1996)Three-dimensional model of non-NMDA glutamate receptors.Biophys J 70:1575-1589.
[9]Liu Y,Zhang G,Gao C,et al.NMDA receptor activation results in tyrosine phosphorylation of NMDA receptor subunit 2A(NR2A)and interaction of Pyk2 and Src with NR2A after transient cerebral ischemia and reperfusion. Brain Res, 2001, 909: 51-58.
[10]Wang LY,Dudek EM,Browning MD,et al.Modulation of AMPA/kainate receptors in cultured murine hippocampal neurones by protein kinase C.J Physiol,1994,475:431-437.
[11]Hou XY,Zhang GY,Yan JZ,Chen M,Liu Y.Activation of NMDA receptors and L-type voltage-gated calcium channels mediates enhanced formation of Fyn-PSD95-NR2A complex after transient brain ischemia.Brain Res,2002,955:123-132.
