缺氧诱导因子1α在肢端恶性黑素瘤组织中的表达
2014-12-09周璐胡彬黄莹雪邵雪宝李阿梅陈浩孙建方
周璐 胡彬 黄莹雪 邵雪宝 李阿梅 陈浩 孙建方
缺氧诱导因子1α在肢端恶性黑素瘤组织中的表达
周璐 胡彬 黄莹雪 邵雪宝 李阿梅 陈浩 孙建方
目的探讨缺氧诱导因子(HIF)1α在肢端恶性黑素瘤(MM)中的表达及其与干细胞因子(SCF)/c-kit途径的关系。方法应用免疫组化法检测HIF-1α在93例MM、21例非肢端MM、39例肢端色素痣组织中的表达,并用15例肢端正常皮肤组织作对照。同时检测c-kit在93例肢端MM组织中的表达情况,采用Spearman相关分析,分析其与HIF-1α的相关性。结果在93例肢端MM中,81例(87.10%)阳性表达HIF-1α,在21例非肢端MM中19例(90.48%)阳性,39例肢端色素痣中6例(15.38%)阳性;15例肢端正常皮肤均为阴性。与肢端正常皮肤和肢端色素痣相比较,肢端MM中HIF-1α的表达增高,差异有统计学意义(均P<0.01);在肢端MM和非肢端MM组间,HIF-1α表达差异有统计学意义(P<0.01)。HIF-1α表达水平与黑素瘤Clark分级、Breslow厚度分级均呈正相关(rs=0.442,P<0.01;rs=0.368,P<0.01)。在原位、侵袭性、转移性肢端MM组织中,HIF-1α表达水平与肿瘤进展呈正相关(rs=0.420,P<0.01)。在肢端MM中,HIF-1α表达与c-kit表达呈正相关(rs=0.307,P<0.01)。结论HIF-1α蛋白在肢端MM中呈高表达,且与肿瘤的分期、进展、侵袭性均呈正相关,与c-kit在肢端MM组织中的协同表达,提示可能共同参与肢端MM的发病机制。
黑色素瘤;缺氧诱导因子1,α亚基;原癌基因蛋白质c-kit
皮肤恶性黑素瘤(malignant melanoma,MM)是一种高度恶性的皮肤肿瘤,致死率高,研究发现不同的人种中黑素瘤的发生率、临床表现、组织学亚型和基因改变不尽相同,亚洲人种以肢端黑素瘤为主,而肿瘤位于肢端,提示其发生可能与肢端的缺氧微环境相关。众所周知,组织缺氧是肿瘤微环境基本特征之一,与肿瘤的发生、发展有关,缺氧诱导因子(hypoxia-inducible factor,HIF)1α是肿瘤缺氧反应中关键性因子,既往文献报道其在多种肿瘤中表达升高,与其中某些肿瘤的恶性程度及患者死亡率明显相关[1-4]。在乳腺癌及胰腺癌中发现HIF-1α和干细胞因子(stem cell factor,SCF)通过SCF/c-kit途径诱导肿瘤血管生成及侵袭性增加[5-6],而在黑素瘤中的相关研究报道较少[2,7]。我们推测在肢端黑素瘤中,可能存在低氧状态诱导HIF-1α高表达及SCF/c-kit途径的异常活化,为进一步探讨HIF-1α在肢端黑素瘤发病机制中的作用及其与SCF/c-kit途径的联系,我们选择肢端MM组织,观察皮损中HIF-1α、c-kit的表达。
资料与方法
1.标本:收集2010年1月至2013年6月期间在中国医学科学院皮肤病医院经临床及病理证实的肢端MM 93例,非肢端MM 21例,肢端色素痣39例,肢端正常皮肤组织15例。93例肢端MM患者中,女56例,男37例;发病年龄29~90岁,平均年龄59.94岁;原位肿瘤28例,侵袭性肿瘤58例,转移性MM 7例;Clark分级Ⅰ~Ⅱ级38例,Ⅲ~Ⅴ级55例。21例非肢端MM患者中,女10例,男11例;发病年龄24~87岁,平均年龄62.99岁;原位肿瘤5例,侵袭性肿瘤16例;ClarkⅠ~Ⅱ级6例,Ⅲ~Ⅴ级15例。肢端色素痣39例,其中发育不良痣5例,普通良性痣34例。
2.标本处理:所有标本经4%甲醛固定、常规脱水、石蜡包埋;4 μm厚度切片后常规HE染色或敷贴于10%多聚赖氨酸预先处理的载玻片上,用于免疫组化实验。
3.试剂及仪器:鼠抗人HIF-1α单克隆抗体(ab1)产自英国Abcam公司(工作浓度为1∶100),即用型鼠抗人c-kit单克隆抗体、即用型羊抗鼠二抗、3,3-二氨基联苯胺(DAB)酶底物显色试剂盒均产自福州迈新生物技术开发有限公司。显微镜工作台及照相系统为日本Nikon公司产品。
4.免疫组化法:石蜡切片脱蜡脱水;Tris-EDTA缓冲液(0.01 mol/L,pH9.0)高温高压修复 3 min,室温自然冷却;后分别滴加抗HIF-1α抗体和抗c-kit抗体(其中抗c-kit抗体只在肢端MM组织切片中滴加);湿盒中4℃过夜;再滴加二抗孵育,DAB显色,苏木素复染细胞核,中性树胶封片。上述各步骤之间均以磷酸盐缓冲液(PBS)漂洗3次。用PBS代替一抗作阴性对照,用人卵巢鳞状上皮细胞癌作HIF-1α染色阳性对照,用肥大细胞瘤作c-kit阳性对照。所有组织染色条件相同。
5.结果判定:判定标准:肿瘤细胞核呈棕褐色颗粒着色为阳性细胞。高倍镜下(×400)随机选择5个视野,计数全部有核细胞,分别计算切片中着色强度和着色阳性细胞的百分率。着色强度:强着色为3分,中等着色为2分,弱着色为1分,不着色或着色不清为0分;着色阳性细胞的百分率>50%为3分,10%~50%为2分,<10%为1分,不着色为0分,最后将所计的分数相乘得出最终的免疫组化积分。组化积分0~1分为(-),2~3分为(+),4~6分为(++),>6分为(+++)[8]。结果判定由2名皮肤病理医生独立进行。
6.统计学分析:应用SPSS17.0统计软件包分析。计数资料比较采用χ2检验,等级资料比较采用Mann-WhitneyU检验;HIF-1α和肿瘤进展、肿瘤分级及c-kit蛋白间相关性研究用Spearman相关检验。检验水准α均为0.05。
结 果

图1 缺氧诱导因子(HIF)1α和c-kit在肢端侵袭性黑素瘤中的表达(DAB染色×200) 1a:HIF-1α染色;1b:c-kit染色 图2 HIF-1α在良性色素痣中的阴性表达(DAB染色×100) 真皮浅层痣细胞成巢区域分布较多色素颗粒
1.HIF-1α蛋白的表达:免疫组化结果显示(图1a),在93例肢端MM中,阳性表达81例(87.10%)。21例非肢端 MM中,19例阳性(90.48%);其中,5例原位肿瘤中3例阳性;16例侵袭性肿瘤中7例阳性(43.75%)。在39例色素痣(图2)中6例阳性(15.38%);15例肢端正常皮肤均为阴性。与肢端正常皮肤组和肢端色素痣组比较,肢端MM组中HIF-1α的蛋白表达水平差异均有统计学意义(χ2=52.258,62.889,均P< 0.01);在侵袭性MM中,肢端组中HIF-1α的蛋白表达水平显著高于非肢端组,差异具有统计学意义(χ2=24.081,P<0.01),在原位MM中,两组的蛋白表达水平差异无统计学意义(χ2=0.118,P>0.05)。
2.HIF-1α蛋白表达与肢端MM患者临床特征及肿瘤侵袭和转移的关系(表1):93例肢端MM中,HIF-1α表达水平在Clark分级Ⅰ~Ⅱ级组与Ⅲ~Ⅴ级组间、有/无溃疡组间差异有统计学意义(均P<0.05),而在不同性别组间、Breslow厚度0~2 mm组与厚度>2 mm组间、有/无炎细胞浸润组间差异无统计学意义(均P>0.05)。在原发、侵袭性、转移性肢端MM组织中,HIF-1α表达水平与肿瘤进展呈正相关(rs=0.420,P< 0.01);HIF-1α 表达水平与肿瘤Clark分级、Breslow厚度分级均呈正相关(rs=0.442,P< 0.01;rs=0.368,P< 0.01)。
3.肢端MM中HIF-1α蛋白与c-kit表达的相关性(表2):93例肢端MM中,84例表达c-kit,其中 42例(图 1b)(+++),33例(++),9例(+),9例不表达;经Spearman相关分析,HIF-1α与c-kit表达呈正相关(rs=0.307,P< 0.01)。
讨 论
皮肤MM发生于人体的最外层组织,即距离中心循环系统最远、相对缺氧的皮肤组织内[9],而肢端皮肤缺氧程度较其他部位皮肤更甚,提示缺氧在肢端皮肤黑素瘤的发生中可能起到一定作用。
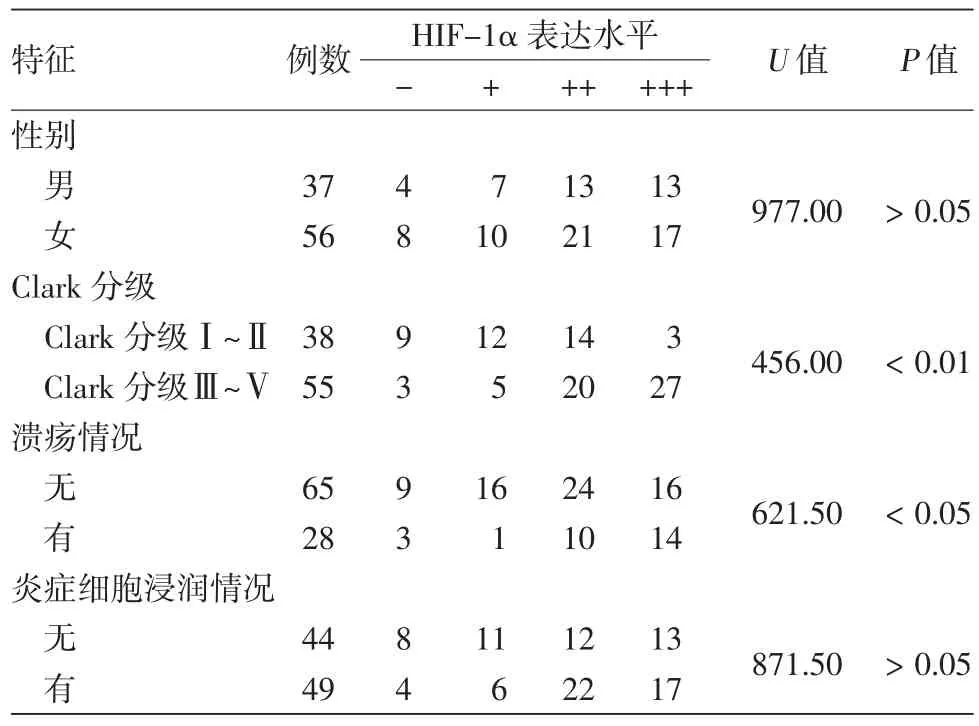
表1 肢端皮肤恶性黑素瘤组织中缺氧诱导因子1α表达与临床特征的关系
亚洲人种以肢端MM为主,提示其发生可能与肢端的缺氧微环境相关。缺氧可以促进肿瘤的生长、侵袭和转移,且影响患者预后。肿瘤对缺氧的反应主要通过转录调节HIF-1α的水平来实现[1]。HIF-1α调节细胞对氧压力的适应性,影响肿瘤细胞的重塑、代谢、增殖、存活、侵袭、凋亡及血管形成中等相关基因的表达[1-2,10]。HIF-1α在乳腺癌、肠癌、前列腺癌、肺癌等肿瘤均有高表达,且与肿瘤的恶性进展相关[2-3,11]。此外,研究亦发现HIF-1α还可诱导肿瘤对治疗的抵抗,减弱机体抗肿瘤的适应性免疫,而HIF-1α表达越高,患者预后及对治疗的反应越差[12-13]。以上研究均提示HIF-1α在肿瘤形成和进展中有重要的作用,为肿瘤的治疗同样提供了新的靶点。
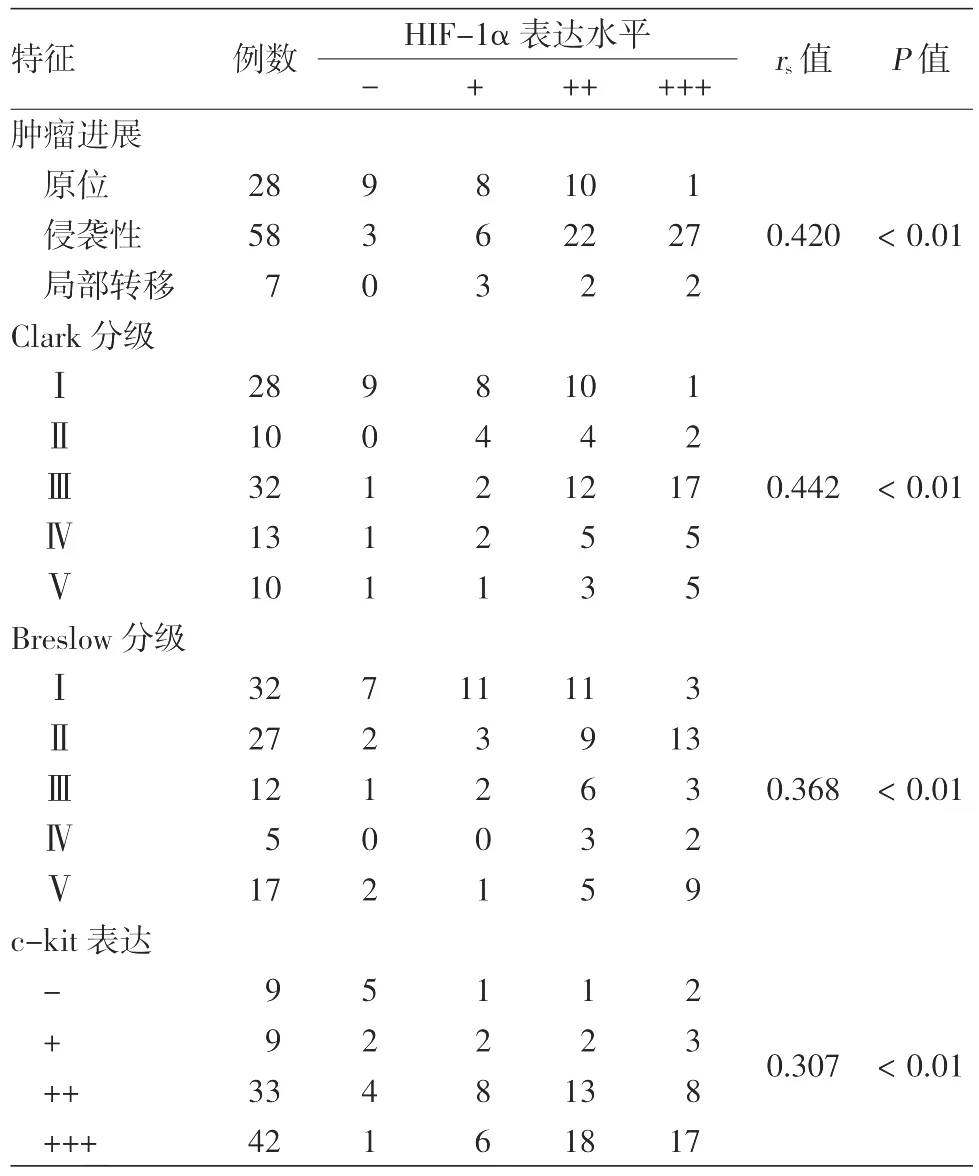
表2 肢端皮肤恶性黑素瘤组织中HIF-1α表达与肿瘤进展、分期及c-kit表达间的相关分析
缺氧条件下,肿瘤内HIF-1α蛋白水平升高,一方面,其可与SCF启动子中功能性缺氧反应元件(hypoxia-response element,HRE)区域相结合,从而活化SCF及其受体c-kit,激活下游PI3K/Akt通路,引起肿瘤细胞的增殖、血管形成,并增加侵袭相关基因的表达[6,14]。 另一方面,Monsel等[7]发现,HIF-1α还可使含有突变型c-Kit基因的黑素瘤细胞增殖活化,亦能激活下游PI3K/Akt通路,激活肿瘤的一系列生物学行为。
我们的研究发现,在肢端MM中,HIF-1α蛋白的表达水平明显高于肢端良性色素痣,且与肿瘤的分期、进展、侵袭性均呈正相关,提示HIF-1α在肢端MM组织中高表达,可能参与肢端MM的发病机制;在侵袭性肿瘤中,肢端MM中HIF-1α蛋白的表达高于非肢端MM,提示肢端部位肿瘤进展和缺氧微环境的关系较非肢端部位的肿瘤更密切。我们的研究还发现,在肢端MM中,HIF-1α与c-kit蛋白表达水平呈正相关,进一步佐证了HIF-1α与c-kit基因的表达在诱导黑素瘤细胞活化、增殖等方面具有协同作用。目前,关于HIF-1α在肿瘤,特别是肢端MM发病机制方面的研究仍较广泛,具体机制尚不明确,提示可能通过多条途径影响肿瘤的发病过程。而HIF-1α与c-kit在肢端MM组织中的协同表达,提示在抗肿瘤治疗中,也许可以联合应用HIF-1α与c-kit的拮抗剂,从而为黑素瘤的治疗提供新的治疗策略。
[1]Chan DA,Giaccia AJ.Hypoxia,gene expression,and metastasis[J].Cancer Metastasis Rev,2007,26(2):333-339.
[2]Mills CN,Joshi SS,Niles RM.Expression and function of hypoxia inducible factor-1 alpha in human melanoma under non-hypoxic conditions[J].Mol Cancer,2009,8:104.
[3]Simiantonaki N,Taxeidis M,Jayasinghe C,et al.Hypoxia-inducible factor 1 alpha expression increases during colorectal carcinogenesis and tumor progression[J].BMC Cancer,2008,8:320.
[4]顾黎雄,高莹,邵雪宝,等.原发性乳房外Paget病中基质金属蛋白酶2、Ⅰ型膜型基质金属蛋白酶和缺氧诱导因子1α的检测[J].中华皮肤科杂志,2009,42(6):427-428.
[5]Currie MJ,Hanrahan V,Gunningham SP,et al.Expression of vascular endothelial growth factor D is associated with hypoxia inducible factor(HIF-1alpha)and the HIF-1alpha target gene DEC1,but not lymph node metastasis in primary human breast carcinomas[J].J Clin Pathol,2004,57(8):829-834.
[6]Zhang M,Ma Q,Hu H,et al.Stem cell factor/c-kit signaling enhances invasion of pancreatic cancer cells via HIF-1α under normoxic condition[J].Cancer Lett,2011,303(2):108-117.
[7]Monsel G,Ortonne N,Bagot M,et al.c-Kit mutants require hypoxia-inducible factor 1alpha to transform melanocytes[J].Oncogene,2010,29(2):227-236.
[8]Bosman FT,de Goeij AF,Rousch M.Quality control in immunocytochemistry:experiences with the oestrogen receptor assay[J].J Clin Pathol,1992,45(2):120-124.
[9]AdamsAE,ChudnovskyY,KhavariPA.Oxygendeprivationprovokes melanoma[J].Nat Med,2006,12(2):168-169.
[10]Kelly BD,Hackett SF,Hirota K,et al.Cell type-specific regulation of angiogenic growth factor gene expression and induction of angiogenesis in nonischemic tissue by a constitutively active form of hypoxia-inducible factor 1[J].Circ Res,2003,93(11):1074-1081.
[11]Xiang ZL,Zeng ZC,Fan J,et al.Gene expression profiling of fixed tissues identified hypoxia-inducible factor-1α,VEGF,and matrix metalloproteinase-2 as biomarkers oflymph node metastasis in hepatocellular carcinoma[J].Clin Cancer Res,2011,17(16):5463-5472.
[12]Semenza GL.HIF-1 mediates metabolic responses to intratumoral hypoxia and oncogenic mutations[J].J Clin Invest,2013,123(9):3664-3671.
[13]Barsoum IB,Smallwood CA,Siemens DR,et al.A mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells[J].Cancer Res,2014,74(3):665-674.
[14]Han ZB,Ren H,Zhao H,et al.Hypoxia-inducible factor(HIF)-1 alpha directly enhances the transcriptional activity of stem cell factor(SCF)in response to hypoxia and epidermal growth factor(EGF)[J].Carcinogenesis,2008,29(10):1853-1861.
2014-01-17)
(本文编辑:尚淑贤)
Expression of hypoxia-inducible factor-1α in acral malignant melanoma tissue
Zhou Lu,Hu Bin,Huang Yingxue,Shao Xuebao,Li Amei,Chen Hao,Sun Jianfang*.*Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s:Chen Hao,Email:ch76ch@163.com;Sun Jianfang,Email:sunjf57@163.com
ObjectiveTo measure the expression of hypoxia-inducible factor(HIF)-1α in acral malignant melanoma(MM)tissue and to investigate its relationship with the stem cell factor(SCF)/c-kit pathway.MethodsImmunohistochemical staining was performed to measure the expression of HIF-1α in tissue specimens from lesions of 93 patients with acral MM,21 with non-acral MM,39 with acral melanocytic nevi,and from the normal acral skin of 15 healthy human controls.Meanwhile,the expression of c-kit was detected by immunohistochemical staining in the 93 acral MM tissue specimens.Statistical comparisons were carried out by chi-square test and Mann-WhitneyUtest.The relationship of HIF-1α expression with c-kit expression as well as tumor progression and staging was assessed by Spearman correlation analysis.ResultsImmunohistochemistry showed that the expression rate of HIF-1α was 87.10%(81/93)in acral MM specimens,90.48%(19/21)in non-acral MM specimens,15.38%(6/39)in acral melanocytic nevus specimens,but 0(0/15)in the normal acral skin specimens.The expression of HIF-1α was significantly higher in acral MM lesions than in normal acral skin and acral melanocytic nevus lesions(bothP<0.01),and significantly different between acral MM and non-acral MM lesions(P< 0.01).Moreover,HIF-1α expression was positively correlated with Clark level and Breslow depth of melanoma(rs=0.442,0.368,respectively,bothP< 0.01),with the progression of acral MM(fromin situto aggressive and metastatic MM)(rs=0.420,P< 0.01),and with the expression of c-kit(rs=0.307,P< 0.01).Conclusions HIF-1α is highly expressed in acral MM,positively correlated with the staging,progression and aggression of MM,and co-expressed with c-kit in acral MM tissue,suggesting that both HIF-1α and c-kit take part in the pathogenesis of acral MM.
Melanoma;Hypoxia-inducible factor 1,alpha subunit;Proto-oncogene proteins c-kit
10.3760/cma.j.issn.0412-4030.2014.09.002
国家自然科学基金(81102067)
210042南京,中国医学科学院北京协和医学院皮肤病研究所[周璐(现在青岛大学附属医院皮肤科,266000)、胡彬、黄莹雪、邵雪宝、李阿梅、陈浩、孙建方]
陈浩,Email:ch76ch@163.com;孙建方,Email:sunjf57@163.com
