盐酸氨溴索缓释混悬剂在犬体内的生物等效性研究
2014-12-03尹飞刘宏飞师双双潘卫三辽宁省肿瘤医院药学部沈阳110042沈阳药科大学药学院沈阳110016江苏大学药学院江苏镇江21201
尹飞,刘宏飞,师双双,潘卫三(1.辽宁省肿瘤医院药学部,沈阳110042;2.沈阳药科大学药学院,沈阳110016;.江苏大学药学院,江苏镇江 21201)
盐酸氨溴索(Ambroxol hydrochloride,AH)作为呼吸系统祛痰药的首选药物已被广泛研究,并已有多种剂型上市。但尚未有AH液体缓释制剂的研究,如能将其制备成液体缓释制剂,将会增加其适用人群(婴幼儿、老年患者),提高患者服用的顺应性(易于服用、便于分剂量等)[1-2]。笔者自制了AH缓释混悬剂,采用高效液相色谱(HPLC)法作为检测方法,对AH缓释混悬剂在犬体内的药动学特征及与市售AH缓释胶囊的生物等效性进行了研究,为其临床研究提供参考。
1 材料
1.1 仪器
HPLC仪,包括LC-10A型输液泵、SPD-10A型紫外检测器(日本岛津公司);TG328B电光分析天平(上海天平仪器厂);MD200-2电光分析天平[奥豪斯国际贸易(上海)有限公司]。
1.2 药品与试剂
AH对照品(中国食品药品检定研究院,批号:100599-201203,纯度:99.9%);受试制剂:AH缓释混悬剂(沈阳药科大学药学院自制,批号:20120601,规格:75 mg∶10 ml);参比制剂:AH缓释胶囊(常州第四制药厂,批号:H20124211,规格:每粒75 mg);内标盐酸丁咯地尔(原料药,齐鲁制药有限公司,批号:20120326,纯度:99.94%);氢氧化钠、乙醚、盐酸均为分析纯,乙腈和甲醇均为色谱纯,水为纯化水。
1.3 动物
健康Beagle犬6条,♀♂各半,体质量12~15 kg,由沈阳药科大学动物实验室提供,使用许可证号:SYXK(辽)2003-0012。
2 方法与结果
2.1 实验设计
采用两制剂双周期试验设计。取犬6只,禁食12 h后分别灌服参比制剂或受试制剂75 mg,自由饮水,给药4 h后统一进食,间隔时间为1周。在犬前肢静脉处安置留置针,于给药前取空白血,给药后1、2、3、4、5、6、8、10、12、14、24 h取样品血5 ml,肝素抗凝,立即3000 r/min(离心半径13.5 cm,下同)离心10 min,分离出血浆,于-20℃下保存,待分析。
2.2 血浆样品的处理[3-6]
取犬血浆1 ml,置于10 ml具塞玻璃试管中,加入50 μl内标水溶液(盐酸丁咯地尔10 μg/ml),旋涡混匀30 s,加入0.01 mol/L的氢氧化钠溶液0.5 ml,涡旋混匀30 s,加入乙醚5 ml,封口后旋涡混匀3 min,4000 r/min离心8 min;分取醚层4 ml至另一支10 ml具塞玻璃试管中,再加入0.03 mol/L的盐酸溶液200 μl,涡旋混匀3 min,4000 r/min离心8 min;弃去醚层;取酸层20 μl注入HPLC仪进行分析。
2.3 色谱条件与系统适用性试验
色谱柱:Diamonsil C18(200 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-0.01 mol/L磷酸盐缓冲液(pH 5.3)-三乙胺(100∶100∶100∶0.04),流速:1.0 ml/min;检测波长:307 nm;进样量:20 μl;温度:35 ℃。分别取空白血浆、空白血浆+AH+内标、血浆样品+内标,按“2.2”项下方法处理后进样测定,色谱图见图1。

图1 高效液相色谱图A.空白血浆;B空白血浆+AH+内标;C.血浆样品+内标;1.AH;2.内标Fig 1 HPLC chromatogramsA.blank plasma;B.blank plasma+AH+internal standard;C.plasma sample+internal standard;1.AH;2.internal standard
2.4 标准曲线的制备
精密称取AH对照品适量,配制成0.5、1、2、5、10、25 μg/ml的对照品溶液。精密量取空白血浆0.9 ml,置于10 ml具塞玻璃试管中,分别精密加入上述对照品溶液100 μl制成含AH 0.05、0.1、0.2、0.5、1.0、2.5 μg/ml的血浆样品,按“2.2”项下方法处理后进样测定,记录色谱。以AH与内标的峰面积比值(y)为纵坐标、AH的质量浓度(x)为横坐标进行线性回归,得标准曲线方程为y=1.345x+0.006(r=0.9995),AH检测质量浓度的线性范围为0.05~2.5 μg/ml。信噪比为3时,检测限为0.12 ng;信噪比为10时,定量限为0.4 ng。
2.5 方法回收率与提取回收率考察
按“2.4”项下方法制备含AH 0.05、0.5、2.5 μg/ml的血浆样品,按“2.2”项下方法处理后进样测定,记录峰面积,代入标准曲线方法计算质量浓度,与样品质量浓度的比值计算方法回收率;另取质量浓度为 0.05、0.5、2.5 μg/ml的AH水溶液,进样测定峰面积,记录色谱图和峰面积,以相应质量浓度血浆样品峰面积与AH水溶液峰面积的比值计算提取回收率,重复5次。回收率试验结果见表1。
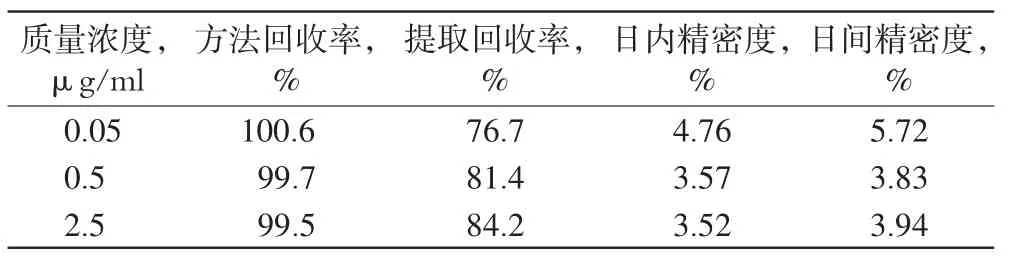
表1 回收率与精密度试验结果(n=5)Tab 1Results of recovery and precision tests(n=5)
2.6 日内精密度与日间精密度考察
精密量取空白血浆0.9 ml,置于10 ml具塞玻璃试管中,分别精密加入100 μl“2.4”项下对照品溶液制备成的含AH分别为0.05、0.5、2.5 µg/ml的血浆样品,按“2.2”项下方法处理后进样测定,记录峰面积,代入标准曲线方程计算质量浓度。同日内每一质量浓度测定5次考察日内精密度;每日测1次,连续测定5 d考察日间精密度,结果见表1。
2.7 药动学研究
2.7.1 药动学参数。取“2.1”项下各犬的血浆,按“2.2”项下方法处理、进样测定,记录峰面积,按内标法代入标准曲线方程计算质量浓度,绘制两种制剂在犬体内的药-时曲线,见图2。

图2 两种制剂在犬体内的药-时曲线Fig 2 Mean plasma concentration-time curves of 2 kinds of preparations in Beagle dogs
由于参比制剂与受试制剂均为缓释制剂,不能直接由3p87程序判断隔室模型,根据研究资料确立AH的隔室模型为单室模型[7-9]。采用非隔室模型计算两种制剂的药动学参数,结果见表2。
表2 两种制剂在犬体内的药动学参数(±s,n=6)Tab 2 Pharmacokinetic parameters of 2 kinds of preparations in Beagle dog(s±s,n=6)
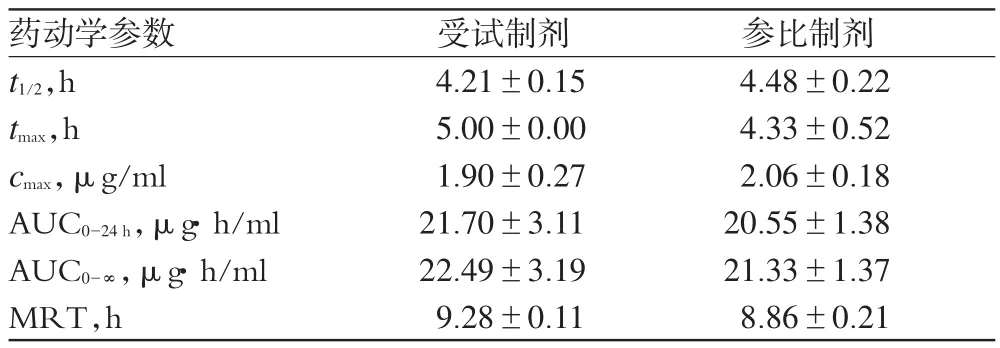
表2 两种制剂在犬体内的药动学参数(±s,n=6)Tab 2 Pharmacokinetic parameters of 2 kinds of preparations in Beagle dog(s±s,n=6)
药动学参数t1/2,h tmax,h cmax,μg/ml AUC0-24 h,μg· h/ml AUC0-∞,μg· h/ml MRT,h参比制剂4.48±0.224.33±0.522.06±0.1820.55±1.3821.33±1.378.86±0.21受试制剂4.21±0.155.00±0.001.90±0.2721.70±3.1122.49±3.199.28±0.11
2.7.2 生物等效性与生物利用度判定。对表2中数据进行双单侧t检验,结果受试制剂的AUC0-24h有90%可信区间在参比制剂AUC0-24h的96.6%~113.8%内;受试制剂的cmax有90%可信区间在参比制剂cmax的88.9%~106.5%内,表明受试制剂与参比制剂有生物等效性。受试制剂针对参比制剂的相对生物利用度为105.2%。
2.7.3 体内外相关性。AH口服属于单室模型,采用W-N法计算不同时间的吸收分数(Fa),以体外累积释放百分率(F)为自变量、体内Fa为应变量,进行最小二乘法线性回归,求得相关方程和相关系数(r),判定体外释放与体内吸收的相关性。结果回归方程为Fa=1.7035F-0.1409(r=0.9121),表明体内外相关性较好。
3 讨论
AH于244 nm和307 nm波长处有最大吸收,虽然在244 nm波长处AH灵敏度较高,但血浆杂质对药物有明显干扰;而307 nm波长处虽然药物灵敏度略有降低,但由于为远端吸收,杂质峰高降低50倍且对药物无干扰。故最终选择307 nm为检测波长。
受试制剂的消除相曲线不如参比制剂平滑,应该是由于相对于参比制剂,受试制剂在肠道反离子的作用下缓慢释放药物,故存在部分二次吸收现象。
[1]周雅萍.2种盐酸氨溴索制剂的人体药动学研究[J].中国药房,2012,23(26):2341.
[2]范国荣,林梅,安登魁.单剂量口服盐酸氨溴索缓释胶囊的人体生物等效性[J].中国医院药学杂志,2001,21(1):9.
[3]黄友旗,温预关.盐酸氨溴索口腔崩解片在健康人体的药物动力学[J].中国组织工程研究与临床康复,2007,11(22):4321.
[4]程天贵.盐酸氨溴索含片的研制及质量控制[J].中南药学,2009,7(3):208.
[5]张丽芳,胡晓,甘小健,等.盐酸氨溴索口腔崩解片的相对生物利用度与生物等效性研究[J].医药导报,2008,27(6):618.
[6]刘祖雄,张红,杨晓松.盐酸氨溴索分散片的制备与质量控制[J].医药导报,2011,30(6):789.
[7]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录ⅪⅩA.
[8]梁文权.生物药剂学与药物动力学[M].2版.北京:人民卫生出版社,2003:357.
[9]刘定远.医药数理统计方法[M].3版.北京:人民卫生出版社,1999:89.
