阿司匹林对SD大鼠小肠内源性保护因素影响的初探①
2014-11-27杨天飞车筑平谭庆华贵阳医学院附属医院贵阳550004
郑 桐 杨天飞 车筑平 谭庆华(贵阳医学院附属医院,贵阳 550004)
近年来,随着我国医疗卫生事业的发展,人均期望寿命已明显延长,人口构成的老龄化,高血压病、冠心病及风湿类疾病患者日益增加,NSAIDs如阿司匹林,临床应用越来越广泛,该类药物起治疗作用的同时也产生了一些副作用,长期以来人们比较重视其引起胃十二指肠的损伤,但随着肠镜普及,发现NSAIDs引起的小肠副作用也并不低。最近研究表明服用NSAIDs的患者中有50%出现小肠黏膜破坏[1]。国内外文献对NSAIDs引起的肠道损伤的发病机制的报道并不多,所以探讨其发病机制,制定相关的防治措施已成为重要课题。小肠黏膜上皮内有多种产肽产胺的内分泌细胞,其中D细胞见于小肠各段,分泌SST。NSAIDs相关性肠病是否有肠道黏液、SST、EGFR及PGE2的改变,这种改变与上皮组织的损伤和修复是否有关?需要实验来明确。
1 材料与方法
1.1 实验动物及分组 实验动物为成年健康SD大鼠(重庆医科大动物实验室)32只,雌雄各半,体重(198.59±18.83)g,各组间在性别、年龄、体重上无显著差别,饲养标准棒状饲料,自由饮水,室温(23±2)℃,12 h昼夜交替光照,实验前适应性喂养1周。随机分为四组,Ⅰ组(灌胃组)8只,精氨酸阿司匹林注射液灌胃;Ⅱ组(灌肠组)8只,精氨酸阿司匹林注射液灌肠;Ⅲ组(腹腔注射组)8只,腹腔注射精氨酸阿司匹林注射液;以上三组精氨酸阿司匹林注射液(海南灵康制药有限公司,产品批号100601)用量为100 mg/kg,每天2次;Ⅳ组8只不采取任何干预措施,自由饮水,饮食,饲养2周后断颈处死实验动物后留取距回盲瓣5 cm的回肠组织保存于-80℃备用。
1.2 对回肠黏膜损伤进行评分 采用Chiu氏6级评分法[2]。0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性坏死、脱落,部分绒毛脱落,固有层裸露,毛细血管扩张、充血;5分:绒毛脱落,固有层崩解。
1.3 阿利辛蓝染色显示回肠黏膜表面黏液 试剂配制:3%醋酸溶液:冰醋酸3 ml+蒸馏水97 ml。阿利辛蓝溶液(pH2.5):阿利辛蓝1 g+3%醋酸100 ml。0.1%核固红溶液:核固红0.1 g+硫酸铝5 g+蒸馏水100 ml,硫酸铝溶于水中,加核固红,慢慢加热到沸腾并把它冷却过滤,并添加一粒百里香酚作为防腐剂。取石蜡包埋的各组动物末段回肠组织,切片、脱蜡至水,阿利辛蓝着色30 min,自来水冲洗。0.1%核固红溶液复染核5 min,自来水冲洗,脱水,封片,显微镜观察。采用Image Pro plus图像分析软件进行半定量分析,每个样本随机检测5个染色较好的高倍视野(×400),计算黏液的阳性面积及积分光密度(IOD),得出5个高倍视野的均数,即代表该样本黏膜表面及杯状细胞中的黏液IOD值。
1.4 ELISA检测大鼠回肠SST、EGFR、PGE2 取上述回肠组织100 mg,剪碎为3 mm×3 mm大小,加入1ml PBS液,低温匀浆,放入1.5 ml离心管,离心1 000 r/min,4℃,5 min,取上清液分装待用。按试剂盒(活乐生物有限公司,上海)说明书操作。
1.5 免疫组化显示SST、EGFR、PGE2 取石蜡包埋的各组动物末段回肠组织切片,脱水后行免疫组化染色。免疫组化一抗分别为:1∶200兔抗鼠SST单克隆抗体,兔抗鼠EGFR单克隆抗体,兔抗鼠PGE2单克隆抗体;二抗试剂盒,SP免疫组化检测试剂盒及DAB显示液,以上试剂均来自博奥森公司(北京,中国)。切片经脱蜡至水,修复抗原、一抗、二抗程序作用后,加入酶标链霉卵白素复合物,DAB室温显色,苏木素复染,脱水,封片,显微镜观察。以细胞质及细胞膜染为棕黄色为阳性细胞。采用Image Pro plus图像分析软件进行半定量分析,每个样本随机检测5个染色较好的高倍视野(×400),计算阳性细胞IOD值,得出5个高倍视野的均数,即代表该样本阳性细胞IOD值。
1.6 统计学方法 用SPSS20统计软件进行四组间秩和检验及Dunnett t检验,差异显著性水平设定为P<0.05。
2 结果
2.1 肉眼观察回肠标本,未发现明显水肿、糜烂、溃疡、出血、坏死、梗阻、穿孔等现象,见图1。

图1 回肠肉眼观察Fig.1 Appearance of ileum
2.2 对回肠黏膜损伤进行评分 正常对照组肠黏膜损伤评分最小为0(P<0.05),Ⅰ组(灌胃组)为3.00±0.76,Ⅱ组(灌肠组)为 2.75±0.71,Ⅲ组(腹腔注射组)为2.88±0.64,三组阿司匹林肠黏膜损伤评分两两比较无差别。见表1。
表1 各组阿利辛蓝的面积及积分光密度(IOD,)Tab.1 Area and IOD of Alcian blue was counted in each group(IDO,)

表1 各组阿利辛蓝的面积及积分光密度(IOD,)Tab.1 Area and IOD of Alcian blue was counted in each group(IDO,)
Note:Compared with normal control group,1)P<0.05;compared with oral intake group,coloclyster group,2)P<0.05.
Normal control group Area 892.88±311.881)1 093.16±195.281)602.17±158.031)2)Oral intake group Coloclyster group Intraperitoneal injection group 802.48±99.34 1 757.79±345.83 IOD 408.20±155.111)521.81±175.531)249.54±113.191)2)
2.3 阿利辛蓝染色显示肠黏膜黏液分布及量变杯状细胞位于黏膜层,散在于吸收细胞间,分泌黏液,杯状细胞中的黏液及黏膜表面黏液与阿利辛蓝结合后呈蓝色(图2)。在光镜下正常对照组肠壁结构清晰,黏膜上皮完整,绒毛排列紧密,杯状细胞较多。三组阿司匹林组的肠壁结构清晰,黏膜厚度变薄,黏膜上皮有脱落现象,绒毛萎缩变短,间隙增大,排列不整齐,黏膜腺体排列稀疏,杯状细胞减少。测量杯状细胞黏液的面积和IOD值均比正常对照组低(表1,P<0.05)。三组不同给药方式中,腹腔注射的面积及IOD值最低(P<0.05)。

图2 阿利辛蓝染色回肠组织Fig.2 Ileal tissue sections were stained by Alcian blue
2.4 ELISA定量分析大鼠回肠SST、EGFR、PGE2灌胃组、灌肠组及腹腔注射组SST、EGFR水平与正常对照组无差异;灌胃组、灌肠、腹腔注射组的PGE2均数比正常对照组低(P<0.05,表2)。

表2 ELISA检测各组小肠SST、EGFR、PGE2水平Tab.2 Concentration of SST,EGFR and PGE2 were detected by ELISA
2.5 免疫组化显示回肠黏膜SST、EGFR、PGE2分布(图3)及量变(表3) 灌胃组、灌肠组、腹腔注射组SST和EGFR的IOD值与正常对照组比较无差异。灌胃组、灌肠组、腹腔注射组PGE2的IOD值均比空白对照组低(P<0.05),三组阿司匹林处理组中,三组间两两比较其水平没有差异。
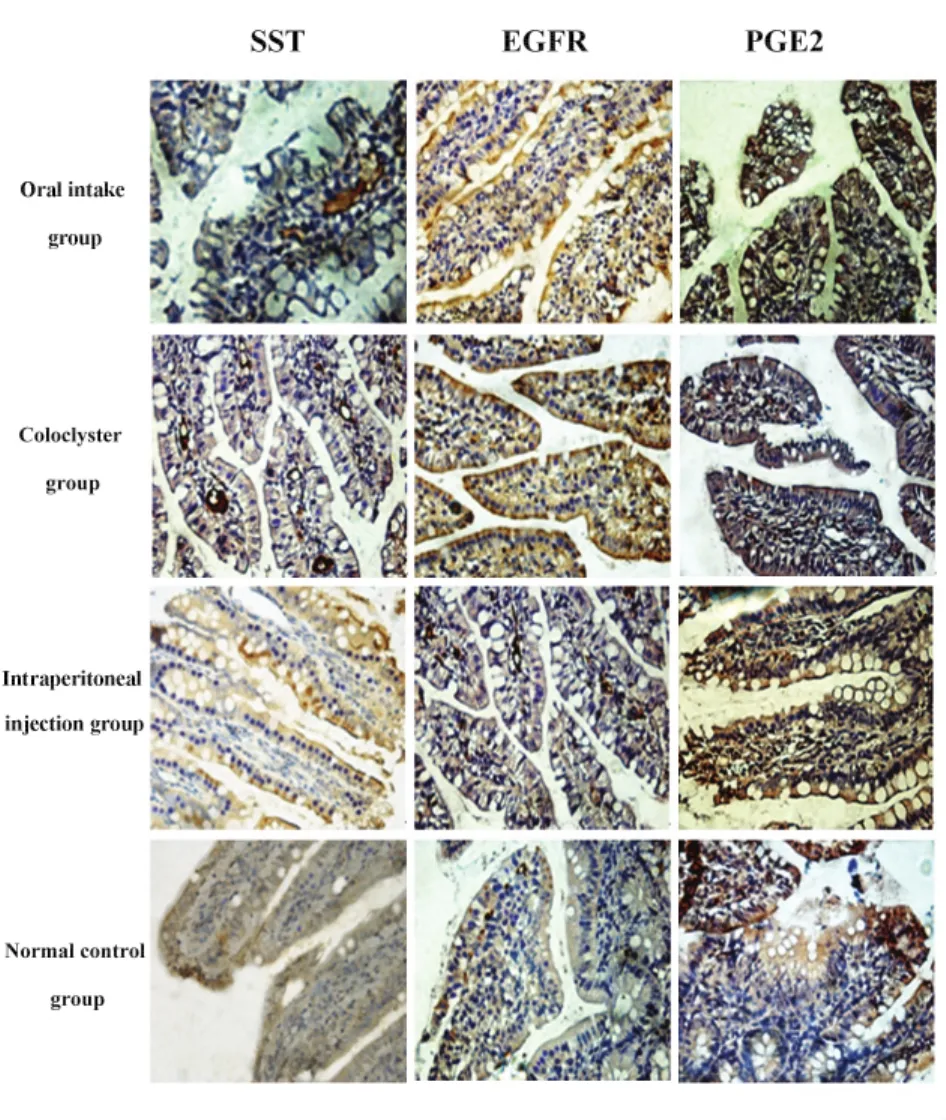
图3 免疫组化显示各组回肠SST、EGFR、PGE2分布Fig.3 SST,EGFR and PGE2 in ileum were detected by immunohistochemistry
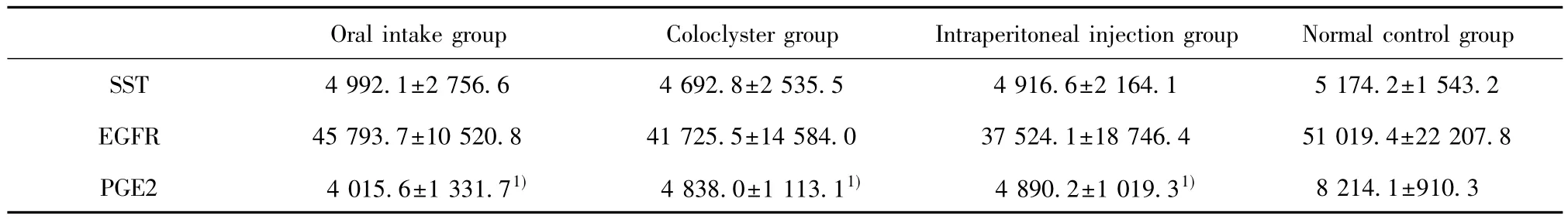
表3 各组间SST、EGFR、PGE2的IOD值Tab.3 SST,EGFR and PGE2 were detected and IOD were measured in each group
3 讨论
NSAIDs相关性肠病中典型的病理改变为小肠黏膜炎症、糜烂、溃疡、黏膜下层纤维增生,引起肠腔狭窄等[3]。本研究中,光镜下可见肠黏膜糜烂,说明不同给药途径的治疗量阿司匹林,均可肯定地引起大鼠小肠黏膜损伤。但没有见到典型的大体损伤表现,分析其原因笔者认为:①造模时间不同。服用NSAIDs 6个月以上小肠炎症发生率高达60%~70%,可并发小肠出血、蛋白丢失、吸收障碍以及小肠穿孔等严重并发症[4]。何旭东等[5]通过对46例行胶囊内镜检查的患者分析也发现NSAIDs所致的消化道损伤与服药时间有关,服用时间越长,其发生率越高。②所使用的阿司匹林剂型不同。肠溶片及控释片的药物在小肠停留时间较长,故对小肠损伤较重,该剂型为注射液,进入大鼠体内后聚集在小肠浓度较低故对小肠破坏不明显。③阿司匹林不从胆汁排泄,因而无肠肝循环,不引起或者只引起轻微小肠黏膜损伤。这与黄文柱等[6]的报道相一致。④该药临床应用较安全,现代制药工艺的进步使得该药物的副作用降低,这与罗佳等[7]研究发现阿司匹林与吲哚美辛、布洛芬和塞来昔布相比较对大鼠小肠黏膜损伤明显减轻一致。
人类胃、小肠黏膜含有丰富的PGE2,它是小肠黏膜重要的保护因素。PGE2具有广泛的生物活性,在抑制胃酸分泌,保护黏膜细胞等方面有着重要的作用。PGE2具有直接的血管扩张作用,增加肠道黏膜的血流量;在组织炎症时,通过抑制炎症细胞的黏附、抑制炎性细胞因子介导的细胞损伤等途径,发挥其对黏膜细胞的保护作用。NSAIDs对胃、肠黏膜中PGE2的影响是早已明确的。NSAIDs可以通过以下几方面引起小肠的损害[8-13]:①抑制前列腺素生成,主要通过抑制环氧化酶(Cyclooxygenase,COX),COX存在3种异构体,分别为COX-1、COX-2和COX-3。COX-1在各种组织中广泛表达,主要起维持正常生理功能的作用。而COX-2在大多数正常组织中无表达,主要表达在炎症部位巨噬细胞、成纤维细胞、上皮细胞和内皮细胞等部位。COX-3可能是COX-2的异构体,在体内和离体实验中均产生一些具有抗炎活性的因子。NSAIDs抑制COX2和COX1产生,从而抑制前列腺素产生。②局部作用,主要是肠剂或肠道控释剂停留于肠道释放高浓度的药物,对肠黏膜局部刺激引起损伤。③引起肠道细菌移位,主要通过损害小肠上皮细胞引起上皮细胞通透性增加,使肠道菌群易于通过肠道黏膜屏障。④肠肝循环加重了NSAIDs对小肠的损害,胆汁结合的NSAIDs对小肠细胞有更强的损害,同时肠肝循环延长了NSAIDs与小肠黏膜接触的时间。⑤近年有学者通过研究认为活性氧自由基的产生是NSAIDs吲哚美辛引起小肠损伤的机制之一[14]。结果显示,通过不同途径给予阿司匹林后,引起了小肠组织中 PGE2的明显减少,与既往研究结果一致[8-13]。其中,各种给药途径所引起的 PGE2的变化无差异。
小肠上皮主要由吸收细胞、杯状细胞和少量的内分泌细胞构成。杯状细胞散在吸收细胞之间,其主要功能是分泌黏液,在吸收细胞表面形成一层黏液层。小肠黏膜的完整性和其表面的黏液层是小肠重要的物理、生物和化学屏障,避免肠腔内有害物质的侵入。而黏液量的多少与阿利辛蓝染色的IOD值和厚度成正相关。灌胃组、灌肠组、腹腔注射组阿利辛蓝染色面积及IOD值比正常组都低。提示阿司匹林注射液通过某种方式降低了小肠杯状细胞合成和分泌黏液的能力。而三组不同给药方式中,腹腔注射组的黏液量又最少,黏液分泌受抑制的程度与各组PGE2的变化无平行关系。说明PGE2只是影响黏液分泌的重要因素之一。
SST是1973年首先从下丘脑分离出来的一个具有14个氨基酸的肽类激素,SST细胞在神经系统、消化系统都有大量分布。本文结果显示灌胃组、灌肠组及腹腔注射组小肠组织中SST的浓度、IOD值无明显变化。由于调节SST合成和分泌的因素较多,SST水平的无差异,提示我们影响SST合成和分泌的因素可能没有受到影响,或是各种变化的因素之间相互抵消了引起的SST变化。其功能很多,除了可抑制胃肠分泌和胰腺的内外分泌外,有免疫调节、肠道细胞保护等多种作用[15,16]。
SST与PGE2之间的相互作用也很复杂。SST可以通过抑制PGE2引起的肠黏膜分泌减少,抑制小肠黏膜碳酸氢盐的分泌降低肠黏膜细胞的自身保护机制。而PGE2则可能增加小肠黏膜黏液的分泌量,增加黏膜中 SST的含量[17-19],但这些功能都必须通过SST受体才能表现出来,所以SST水平的无变化,也不能排除SST没有参与NSAIDs性肠道损伤的病理生理过程。
EGFR属于跨膜受体酪蛋白氨酸蛋白激酶家族,可介导细胞的代谢、增殖、分化、黏附、迁移等生命现象。有研究表明在胃黏膜损伤修复中有EGFR的高度表达,对胃黏膜的保护及其损伤的修复有很重要的作用[20,21]。本文中灌胃组、灌肠组、腹腔注射组EGFR的浓度及IOD值均无明显变化。这与芦惠等[22]发现,腹腔注射 5 mg/kg内毒素(Lipopolysaccharide,LPS)后,EGFR表达与回肠损伤程度无相关性相一致。因而推测可能是小肠的内环境与胃的内环境不同,在小肠的修复中有其他因素参与造成的,同时也说明了灌胃、灌肠及腹腔注射三种给药方式对EGFR的影响无区别。
总之,阿司匹林在不同给药途径下,2周均可引起大鼠小肠黏膜的损伤。这种损伤中,小肠黏膜的完整性破坏和黏膜黏液的分泌受到了明显影响,而腹腔注射给药对小肠黏膜黏液的合成和分泌影响最大。可能这些改变与PGE2的降低有关。无明确结果表明SST和EGFR参与了NSAIDs性肠病的病理生理过程,但不排除SST受体的变化影响了SST的作用。
[1]Kazuhide Higuchi EU,Toshio Watanabe,Yukiko yoda,et al.Present status and strategy of NSAIDs-induced small bowel injury[J].J Gastroenterol,2009,44(9):879-888.
[2]Chiu CJ,McArdle AH,Brown R,et al.Intestinal mucosal lesion inlowflow states:I.A morphological,hemodynamic,and metabolic reappraisal[J].Archives Surgery,1970,101:478.
[3]张 烁,吕 宾,姒健敏,等.非甾体类消炎药对大鼠小肠黏膜机械屏障功能的影响[J].中华内科杂志,2009,48(1):44-47.
[4]Brazeau PVW,Burgus R,Ling N,et al.Hypothalamic polypeptide that inhibits the Secretion of immuoreactive pictuitary growth hormone[J].Science,1973,179:77-79.
[5]何旭东,姜红梅,王文峰,等.NSAIDs致下消化道损伤的研究[J].临床消化病杂志,2011,5:305-307.
[6]黄文柱,张亚书,张振书 等.非甾体类抗炎药相关性小肠病[M].见:现代小肠病学;北京:军事医学出版社,2003:488.
[7]罗 佳,王惠吉.非甾体类抗炎药对小肠黏膜的损伤作用[J].胃肠病学,2008,13(9):536-539.
[8]KT IB.Intestinal permeability in the pathogenesis of NSAID-induced enteropathy[J].J Gastroenterol,2009,44(19):23-29.
[9]祝 林,胡三元,张光永,等.前列腺素E2对阻塞性黄疸大鼠小肠粘膜形态的保护作用[J].山东大学学报(医学版),2009,44(19):13-15.
[10]夏 允,张丽萍.幽门螺杆菌感染对血清中前列腺素E2水平的影响[J].医师进修杂志,2005,28(12):40-41.
[11]熊 瑛,陈嘉熠,吴丽虹.幽门螺杆菌感染与非甾体类消炎药对消化性溃疡发病的影响[J].重庆医学,2012,26:2744-2745.
[12]Satoh HKT.Role of food and enterobacteria in the formation and prevention of small intestinal damage induced by NSAIDs[J].Front Gastrointest Res Basel Karger,2012,30:52-60.
[13]Yanaka AJS,Ohmori S.Sulforaphane protects small intestinal mucosa from aspirin/NSAID-induced injury by enhancing host defense systems against oxidative stress and by inhibiting mucosal invasion of anaerobic enterobacteria[J].Curr Pharmaceutic Design,2013,19(1):157-162.
[14]Omatsu T,Naito Y,Handa O,et al.Involvement of reactive oxygen species in indomethacin-induced apoptosis of small intestinal epithelial cells[J].J Gastroenterol,2009,44(19):30-34.
[15]王 彤,初桂兰.生长抑素对缺氧缺血性脑病肠损伤的治疗[J].国际儿科学杂志,2009,36(4):331-333.
[16]凌东进,傅华群,李建华.生长抑素对大鼠不同肠段粘膜机械屏障损伤的保护作用[J].江西医学院学报,2006,46(2):17.
[17]Warhurst GBG,Higgs NB,Reyl-Desmars F,et al.Expression of somatostatin receptor genes and their role in inhibiting Clsecretion in HT-29cl.19A colonocytes[J].Am J Physiol,1995,269(5 Pt 1):G729-G736.
[18]Kapraali MSC,Marín L,Johansson O,et al.Prostaglandin E2 modulates serotonin-and gastrin/CCK-immunoreactive cells in the duodenal mucosa of the rat[J].Digestion,1997,58(3):247-257.
[19]Odes HSMR,Reimer R,Ioffe S,et al.Effect of somatostatin-14 on duodenal mucosal bicarbonate secretion in guinea pigs[J].Dig Dis Sci,1995,40(3):678-684.
[20]YuY,Rishi AK,Turner JR,et al.Cloning of a novel EGFR-related peptide:a putative negative regulator of EGFR[J].Am J Physiol Cell Physiol,2001,280:C1083-C1089.
[21]谭 莹,谭庆华.大鼠结肠黏膜电切术后抗菌治疗对局部组织修复的影响[J].中国医药导报,2010,35(7):13-16.
[22]芦 惠,薛辛东.表皮生长因子及其受体在新生鼠肠损伤中的动态变化[J].中华围产医学杂志,2008,11(3):173-176.
