烟草NtSnRK2.1基因的克隆及其在非生物胁迫条件下的表达
2014-11-24张洪映贾宏昉张松涛杨永霞崔红
张洪映,贾宏昉,张松涛,杨永霞,崔红
河南农业大学烟草学院,烟草行业栽培重点实验室,郑州市文化路95号 450002
烟草NtSnRK2.1基因的克隆及其在非生物胁迫条件下的表达
张洪映,贾宏昉,张松涛,杨永霞,崔红
河南农业大学烟草学院,烟草行业栽培重点实验室,郑州市文化路95号 450002
从普通烟草腺毛cDNA文库中筛查烟草SnRK2基因的EST序列,以此序列为信息探针,通过电子克隆和RT-PCR的方法从烟草中克隆到一个包含1017 bp开放阅读框、编码338个氨基酸的cDNA序列,命名为NtSnRK2.1。生物信息学分析表明,NtSnRK2.1蛋白同时具有磷酸化丝氨酸/苏氨酸和酪氨酸的活性。氨基酸序列比对发现,NtSnRK2.1与拟南芥、水稻和小麦等植物中受逆境胁迫诱导表达的直系同源基因高度同源。组织表达分析结果显示,烟草NtSnRK2.1基因的组织表达差异较大,在根部的表达量最高,其次是叶片,茎部的表达量最低。胁迫处理下的基因表达分析结果表明,NtSnRK2.1受高盐、高渗、低温胁迫和ABA处理诱导表达,对各胁迫条件的应答模式不同,其对各胁迫条件的敏感度为:高渗>高盐>低温>ABA。
普通烟草;NtSnRK2.1;非生物胁迫;克隆;表达分析
烟草(Nicotiana tabacumL.)是我国重要的经济作物,也是进行分子生物学和植物生理学等研究的重要模式植物,研究烟草非生物胁迫响应的相关基因对于揭示烟草的抗逆分子机制和改良烟草抗逆性具有重要意义。植物体内蛋白质的可逆磷酸化是其在逆境条件下能量代谢和信号传递中的重要反应,其中,蛋白磷酸化过程由蛋白激酶催化完成[1]。蔗糖非发酵相关蛋白激酶家族2 (SnRK2, SNF1-related protein kinase 2)是一类植物专一性蛋白激酶。研究表明,SnRK2基因家族成员广泛参与植物的逆境应答反应,且各成员功能各异。在植物中第一个分离得到的SnRK2成员是小麦PKABA1基因,来源于ABA处理的小麦胚胎cDNA文库[2],PKABA1在干旱、低温和盐胁迫条件下可以上调表达[3]。对小麦TaSnRK2.4、TaSnRK2.7和TaSnRK2.8的抗逆性研究发现,三个基因以不同的调控方式增强植物的非生物胁迫抗性[4-6]。对拟南芥SnRK2家族的研究发现,AtSnRK2.2、AtSnRK2.3、AtSnRK2.6、AtSnRK2.7和AtSnRK2.8成员受ABA诱导激活,所有的拟南芥SnRK2成员均不受冷处理诱导,但是除AtSnRK2.1之外的所有SnRK2成员均受高盐和甘露醇诱导激活[7-9]。拟南芥SnRK2.4和SnRK2.10基因的功能研究发现,其主要是通过维持根系的正常生长发育增强植物的抗盐胁迫能力[10]。在水稻中分离到的10个SnRK2成员(SAPK1-10)均可以被渗透胁迫诱导表达,其中有三个基因SAPK8-10可以被ABA激活[11]。在大豆中克隆的第一个SnRK2成员GsAPK基因,受ABA诱导激活,能够显著增强植物的抗盐胁迫能力[12]。目前在烟草中未见该家族功能的报道。
本研究从普通烟草腺毛cDNA文库中筛查烟草SnRK2的EST序列信息,以获得的SnRK2 EST序列(种子序列)为信息探针,通过电子克隆的方法进行电子拼接和延伸,利用RT-PCR技术得到烟草SnRK2基因的cDNA序列,通过分析SnRK2基因对不同逆境胁迫条件的应答模式,揭示其在各非生物胁迫条件下的应答机制,为利用SnRK2基因改良普通烟草的抗逆境胁迫能力提供理论指导。
1 材料与方法
1.1 材料
供试材料为普通烟草品种K326,植株培养在16 h/8 h (光/暗)周期的生长培养箱中,温度为25℃,相对湿度60%。
播种出苗后培养至3~4片真叶,挑选大小一致的幼苗移至沙培育苗盘中,Hoagland营养液培养至五叶期,进行胁迫处理,处理方式包括四种:250 mmol L-1NaCl溶液进行高盐胁迫;20% PEG-6000对烟草幼苗进行渗透胁迫;在4℃下进行低温胁迫;100 µmol L-1的ABA喷洒烟草幼苗,同时用无离子水培养的幼苗作为对照。在胁迫前及胁迫处理后1 h、3 h、6 h、12 h、24 h、48 h和72 h分别采收叶片,同时收集对照幼苗的根、茎和叶片做基因的组织表达分析。经液氮速冻后,-70℃保存备用。
1.2 NtSnRK2基因的克隆
1.2.1 NtSnRK2基因的电子克隆
筛查本实验室构建的烟草腺毛cDNA文库[13],选取烟草SnRK2 EST序列作为信息探针(种子序列),应用NCBI网站的Blast程序搜索烟草EST序列数据库。利用DNAstar软件中的Seqman程序将搜索到的EST序列与种子序列进行拼接和比对,组装成重叠群(contig),以contig序列作为信息探针在烟草EST数据库中继续进行检索、拼接和延伸序列,重复此过程至无新的EST序列检出。最终获得烟草SnRK2的电子延伸序列。
1.2.2 NtSnRK2基因的分离
总RNA提取按照Invitrogen TRizol Reagent说明书进行。反转录程序参照Invitrogen公司的M-MLV Reverse Transcriptase试剂盒说明书进行。
应用Primer Premier 5.0软件在NtSnRK2基因电子延伸序列的ORF区两侧设计RT-PCR扩增引物(F:5’-CCCTTGATTATGGAGCGTTA-3’,R:5’-TACAGCGCACTACACGTTCA-3’)。将 PEG 处理的7个时间点烟草cDNA等量混合物作模板,用高保真Pfu酶进行PCR扩增,回收纯化目标片段,将其连接到pMD19-T载体上,转化大肠杆菌后挑选阳性克隆进行测序验证。
1.3 序列分析方法
应用DNAStar软件进行基因序列ORF区的查找、蛋白翻译以及基因序列比对;利用SMART程序和ScanProsite (au.expasy.org/prosite)网站预测蛋白特性;蛋白质的分子量和等电点由Compute pI/MW程序进行计算;利用TMPRED软件(http://ch.embnet.org/cgibin/TMPRED)进行跨膜预测。
1.4 聚类分析
在NCBI数据库下载拟南芥、水稻、小麦及玉米SnRK2家族10个基因成员的氨基酸序列,通过ClustalW网站进行序列的多重比对分析,然后应用PHYLIP程序进行聚类分析。
1.5 实时定量RT-PCR和半定量RT-PCR检测
应用Primer Premier 5.0软件设计扩增引物(F:5’-CTGTAGGGACGCCTGCTTATG-3’,R:5’-TGGACTTGTTCGGGGATTGA-3’)。以烟草组成型表达基因L25(F:5’-GCTTTCTTCGTCCCATCA-3’,R:5’-CCCCAAGTACCCTCGTAT-3’)作为内参。按照Invitrogen公司的RealMasterMix (SYBR Green)试剂盒说明书进行实时定量RT-PCR,每个样品3次重复。
实时定量的实验结果采用2-ΔΔCt算法[14]进行分析,假设目的基因在胁迫处理下的表达量是对照(正常培养)的N倍,N = 2-ΔΔCt,ΔΔCt = Treat(Ct样品- CtL25) - CK(Ct样品 - CtL25)。
2 结果与分析
2.1 烟草SnRK2基因的克隆与序列分析
以普通烟草腺毛cDNA文库中得到的SnRK2 EST序列为信息探针,在NCBI烟草EST数据库中搜索到30条高度同源序列,电子克隆后获得一条长度为1306 bp的烟草SnRK2基因序列, RT-PCR扩增和测序证实得到序列与电子拼接结果一致。将该序列输入到ORF Finder中,目标片段长1182 bp,包含1个1017 bp的ORF区(158-1174 bp),编码338个氨基酸,分子量约43 kD,等电点(pI)为5.78。
Blast序列比对分析发现,克隆基因与已知同科植物SnRK2.1基因编码的氨基酸序列高度同源(图1), 与番茄SAPK2-like(Solanum lycopersicum,XM_004237888)同源性达到92.0%,与马铃薯SnRK2.1(Solanum tuberosum, JX280911)同源性达到90.7%。表明这个新克隆的cDNA序列为烟草SnRK2家族基因成员,将该基因命名为NtSnRK2.1。

图1 烟草NtSnRK2.1、马铃薯SnRK2.1和番茄SAPK2-like的氨基酸序列比对Fig. 1 Amino acid sequence comparison of tobacco NtSnRK2.1, potato SnRK2.1 and tomato SAPK2-like
2.2 NtSnRK2.1编码产物的生物信息学分析
2.2.1 NtSnRK2.1的结构域预测
应用NCBI结构域数据库进行保守域预测发现,NtSnRK2.1氨基酸序列的第4-260位之间存在丝氨酸/苏氨酸激酶和酪氨酸激酶催化域,推测该蛋白同时具有催化丝氨酸/苏氨酸和酪氨酸磷酸化的活性。其中第10-33位氨基酸是蛋白激酶ATP结合域信号、第119-131位氨基酸为丝氨酸/苏氨酸蛋白激酶活性位点信号,第123位为质子接受位点。ScanProsite和SMART程序预测结构域发现NtSnRK2.1具备蛋白激酶超家族的特征基序,包括酪氨酸激酶磷酸化位点、酪蛋白激酶Ⅱ磷酸化位点、蛋白激酶C磷酸化位点。此外,该蛋白存在N-豆蔻酰化位点(第134-139位AAR)和跨膜结构域(第207-224位AAR)。因此,NtSnRK2.1编码产物是典型的植物蛋白激酶。
2.2.2 NtSnRK2.1的跨膜结构域预测
利用TMPRED软件对NtSnRK2.1基因编码的氨基酸序列进行跨膜区预测,大于500分值为存在有意义的跨膜螺旋。TMPRED模型分析发现NtSnRK2.1蛋白包含多个跨膜螺旋区域(图2),其中包含2个可能性极高的跨膜螺旋:183-201位(i—o)存在1个强的由内向外的跨膜螺旋,得分1302,180-198位(o—i)存在1个强的由外向内的跨膜螺旋,据此推测该基因编码的激酶是跨膜蛋白。
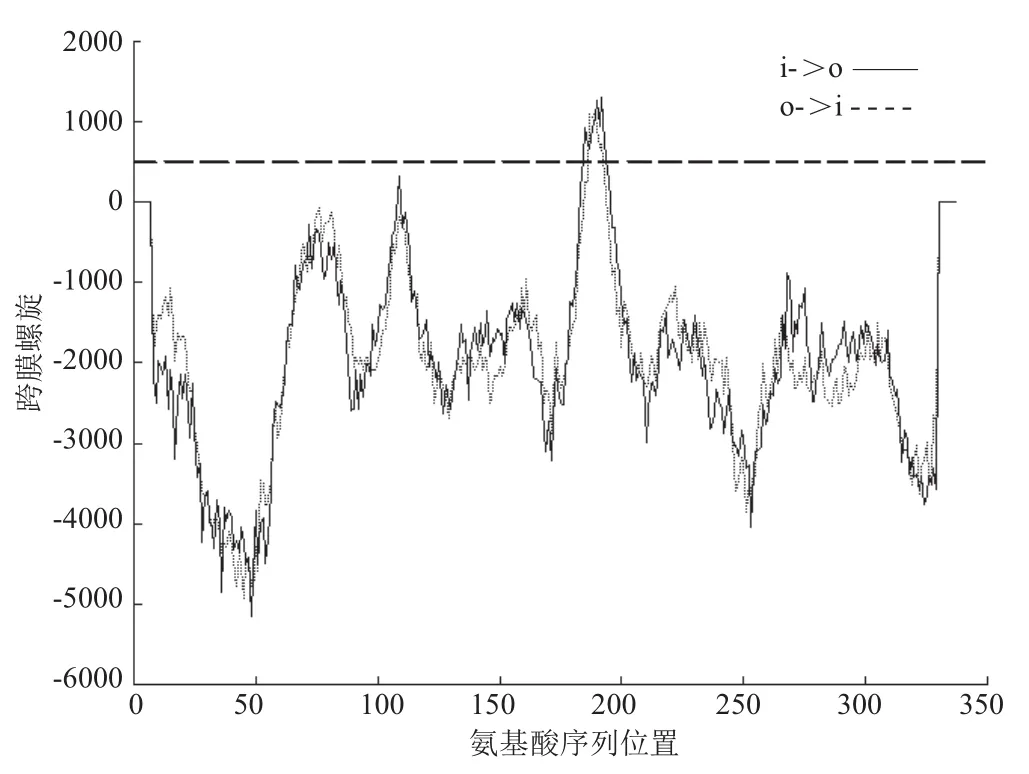
图2 NtSnRK2.1蛋白跨膜结构域预测Fig. 2 Protein transmembrane domain of NtSnRK2.1
2.3 聚类分析
2.3.1 NtSnRK2.1基因的进化分析
拟南芥、玉米和水稻已发现10个SnRK2基因家族成员,其C端典型特征是氨基酸相对较短,具有一个富含天冬氨酸或谷氨酸(E/D)的酸性补丁结构。根据C端结构将SnRK2家族分为两个亚族:SnRK2a (Subclass I和Subclass II)和SnRK2b (Subclass III),其中SnRK2a亚族成员的C端富含天冬氨酸,而SnRK2b亚族成员中富含谷氨酸[15]。SnRK2 C端的酸性补丁结构域与酶的激活、蛋白间的相互作用及ABA信号转导相关[16-17]。烟草NtSnRK2.1基因C端富含天冬氨酸,进化分析表明应属于SnRK2家族Subclass II亚族 (图 3)。

图3 NtSnRK2.1系统进化分析Fig. 3 Phylogenetic analysis of NtSnRK2.1
2.3.2 NtSnRK2.1同源性分析与功能预测
将NtSnRK2.1基因与拟南芥、水稻、小麦、大豆、玉米、番茄和马铃薯同源基因的氨基酸序列进行进化分析(图 4),发现与烟草NtSnRK2.1同源关系最近的为同科植物番茄SAPK2-like(92%)和马铃薯StSnRK2.1(90.7%),其次为大豆、小麦、水稻和玉米,同源关系最远的为拟南芥。已报道的这些NtSnRK2.1同源基因都与植物逆境胁迫的应答反应相关,例如拟南芥SnRK2.1基因受高盐和高渗透胁迫诱导表达[7],水稻SAPK2受冷、高盐和高渗等逆境胁迫的诱导[11],小麦PKABA1在低温、干旱和盐胁迫条件下上调表达[3],玉米ZmSPK1为ABA、高盐和高渗诱导的蛋白激酶[18]。
同源性分析的结果,进一步验证了NtSnRK2.1功能保守域推测的结果,即所克隆的NtSnRK2.1基因属于烟草SnRK2家族基因,可能与其同源基因类似,具有抗逆境胁迫功能。
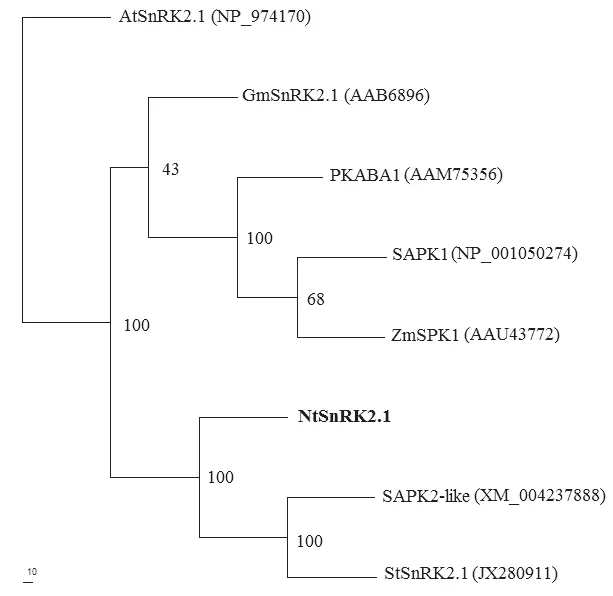
图4 SnRK2.1的同源性分析Fig. 4 Homology analysis of SnRK2.1
2.4 NtSnRK2.1的表达特性
2.4.1 NtSnRK2.1的组织表达特性
烟草NtSnRK2.1基因的组织表达特性分析表明,在烟草的根、茎和叶均有表达,但组织间的表达差异较大,NtSnRK2.1基因在烟草根部的表达量最高,其次为叶片,茎部的表达量最低(图5)。

图5 NtSnRK2.1的组织表达分析Fig. 5 Tissue expression analysis of NtSnRK2.1
2.4.2 非生物胁迫下NtSnRK2.1的表达特性分析
半定量和实时定量的实验结果均表明,烟草NtSnRK2.1基因广泛参与了高渗、高盐、低温胁迫和ABA处理的应答反应(图6)。当烟草幼苗受到渗透胁迫时,NtSnRK2.1基因在胁迫后1 h迅速上升到对照(处理前)的27.9倍,而后急速下降,在胁迫24 h时,表达量回升至对照的19.8倍,随后表达量逐渐降低。在盐胁迫1 h 时,NtSnRK2.1表达量迅速升高(为对照的8.4倍),6 h时达到高峰,为对照的10.6倍,随后表达量降低并维持在对照的2-4倍。当烟草幼苗受到低温胁迫(4℃)时,NtSnRK2.1基因的表达量持续升高至48 h时达到峰值,为对照的21.2倍,72 h时下降至对照的11.4倍。当外源ABA诱导处理时,NtSnRK2.1的表达量较胁迫处理增幅不大,在最初的3个小时内基本不变,而后开始上升,12 h达到高峰,为对照水平的2.8倍,24 h后开始逐渐下降,在72 h时表达量降至对照的1.5倍。总之,烟草NtSnRK2.1基因受高渗、高盐、低温胁迫和ABA诱导表达,且在四种诱导条件下的应答模式不同,其对各诱导条件的敏感度为:高渗>高盐>低温>ABA。
3 结论与讨论
3.1 NtSnRK2.1的生物信息学分析
蛋白功能域预测发现NtSnRK2.1同时具有N-豆蔻酰化位点MYRISTYL和跨膜结构域,这两个功能域是植物在逆境胁迫下细胞信号转导和蛋白间相互作用的关键位点[19-20]。跨膜结构域预测NtSnRK2.1为跨膜蛋白,因而该蛋白可能在膜上有分布,推测NtSnRK2.1蛋白可能与小麦SnRK2[4-6]的亚细胞定位结果一致,在细胞膜、细胞质和细胞核均有分布。

图6 烟草NtSnRK2.1基因对不同逆境胁迫处理的应答模式Fig. 6 Response of NtSnRK2.1 gene to different stress treatment
SnRK2的系统进化分析结果显示烟草NtSnRK2.1属于SnRK2家族Subclass II亚族基因成员(图3),聚类结果显示SnRK2基因家族分为三个亚族,各亚族同时包含拟南芥、水稻和玉米的SnRK2基因成员,此结果表明SnRK2基因家族成员的分化时间先于单子叶和双子叶植物的分化时间。同源性比对结果表明,烟草NtSnRK2.1基因与同科植物同源基因的相似性高达90%以上,可见,SnRK2.1在茄科植物中是高度保守基因。
3.2 NtSnRK2.1的表达分析
拟南芥根部的SnRK2C基因能够调控抗旱相关基因在渗透胁迫下过量表达[21]。本研究结果发现烟草NtSnRK2.1基因在烟草根部的表达量最高,其次为叶片,在烟草茎部的表达量最低。考虑到SnRK2基因在蔗糖代谢中的重要作用,推测其抗逆机理可能是,蔗糖非发酵相关蛋白激酶家族2 (SnRK2)在逆境胁迫下在根部过量表达,降低根部细胞渗透势,以增强根系对水分以及营养成分的吸收。烟草NtSnRK2.1基因的转基因功能验证实验正在进行中。
烟草NtSnRK2.1基因的小麦、水稻、玉米和拟南芥同源基因同时受外源ABA诱导和多种逆境胁迫表达[3,7,11,18]。基因表达特性分析显示,NtSnRK2.1受高渗、高盐、低温和ABA处理诱导,推测该基因是一种作用广泛的胁迫应答基因;此外,NtSnRK2.1对各胁迫条件的应答模式不同,其对各胁迫条件的敏感度为:高渗>高盐>低温>ABA。
植物中存在ABA依赖型和非ABA依赖型两种信号传递途径同时调控渗透胁迫诱导基因的表达[22]。一些非ABA依赖型抗逆基因的启动子区同时含有干旱胁迫应答元件和ABA应答元件,虽然这些基因不依赖ABA诱导表达,能够直接响应干旱等逆境因子,但仍能够对外源ABA响应[23-24]。同样,NtSnRK2.1在高渗、高盐、低温胁迫下迅速响应,而在受外源ABA诱导时,其表达量的最高值仅为对照的2.8倍,据此推测烟草NtSnRK2.1基因对非生物胁迫条件的快速应答可能不依赖于细胞内的ABA作用,该结论还需要对NtSnRK2.1基因启动子进行研究证实。
NtSnRK2.1受多种非生物胁迫的诱导表达,一方面表明植物体内各种逆境信号传递途径间可能存在串扰,另一方面也说明该基因可能存在于复杂网络调控的交叉点,是一种作用广泛的抗逆基因,因此对于提高作物的抗逆性具有重要的意义。
[1]Knight H. Calcium signaling during abiotic stress in plants[J]. Int Rev Cytol, 2000, 195: 269-325.
[2]Anderberg R J, Walker-Simmons M K. Isolation of a wheat cDNA clone for an abscisic acid-inducible transcript with homology to protein kinases [J]. Proc Natl Acad Sci USA,1992, 89: 10183-10183.
[3]Holappa L D, Walker-Simmons M K. The wheat abscisic acid-responsive protein kinase mRNA PKABA1, is upregulated by dehydration, cold temperature, and osmotic stress [J]. Plant Physiol, 1995, 108: 1203-1210.
[4]Mao Xinguo, Zhang Hongying, Tian Shanjun, et al.TaSnRK2.4, a SNF1-type serine/threonine protein kinase of wheat (Triticum aestivum L.), confers enhanced multistress tolerance in Arabidopsis [J]. J Exp Bot, 2010, 61: 683-696.
[5]Zhang Hongying, Mao Xinguo, Jing Ruilian, et al.Characterization of a common wheat (Triticum aestivum L.)TaSnRK2.7 gene involved in abiotic stress responses [J]. J Exp Bot, 2011, 62: 975-988.
[6]Zhang Hongying, Mao Xinguo, Wang Chengshe, et al.Overexpression of a common wheat gene TaSnRK2.8 enhances tolerance to drought, salt and low temperature in Arabidopsis [J]. PLoS ONE, 2010, 5: e16041.
[7]Boudsocq M, Barbier-Brygoo H, Lauriere C. Identification of nine sucrose nonfermenting 1-related protein kinases 2 activated by hyperosmotic and saline stresses in Arabidopsis thaliana [J]. Biological Chemistry, 2004, 279: 41758-41766.
[8]Boudsocq M, Droillard M J, Barbier-Brygoo H, et al.Different phosphorylation mechanisms are involved in the activation of sucrose non-fermenting 1 related protein kinases 2 by osmotic stresses and abscisic acid [J]. Plant Mol Biol, 2007, 63: 491-503.
[9]Xie Tian, Ren Ruobing, Zhang Yuanyuan, et al. Molecular mechanism for inhibition of a critical component in the Arabidopsis thaliana abscisic acid signal transduction pathways, SnRK2.6, by protein phosphatase ABI1[J]. J Biolo Chem, 2012, 287: 794-802.
[10]McLoughlin F, Galvan-Ampudia CS, Julkowska MM, et al.The Snf1-related protein kinases SnRK2.4 and SnRK2.10 are involved in maintenance of root system architecture during salt stress [J]. Plant J, 2012, 72: 436-449
[11]Diedhiou C J, Popova O V, Dietz K J, et al. The SNF1-type serine-threonine protein kinase SAPK4 regulates stressresponsive gene expression in rice [J]. BMC Plant Biol,2008. 8: 49.
[12]Yang Liang, Ji Wei, Gao Peng, et al. GsAPK, an ABA-activated and calcium-independent SnRK2-type kinase from G. soja, mediates the regulation of plant tolerance to salinity and ABA stress [J]. PLoS ONE, 2012, 7: e33838.
[13]Cui Hong, Zhang Songtao, Yang Huijuan, et al. Gene expression profile analysis of tobacco leaf trichomes [J].BMC Plant Biol, 2011, 17: 76.
[14]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod [J]. METHODS, 2001, 25: 402-408.
[15]Halford N G, Hardie D G. SNF1-related protein kinases:global regulators of carbon metabolism in plants [J]. Plant Molecular Biology, 1998, 37: 735-748.
[16]Huang J F, Teyton L, Harper J F. Activation of a Ca(2+)-dependent protein kinase involves intramolecular binding of a calmodulin-like regulatory domain [J]. Biochemistry,1996, 35: 13222-13230.
[17]Kobayashi Y, Yamamoto S, Minami H, et al. Differential activation of the rice sucrose nonfermenting1-related protein kinase 2 family by hyperosmotic stress and abscisic acid [J]. Plant Cell, 2004, 16: 1163-1177.
[18]Zou Huawein, Zhang Xiuhai, Zhao Jiuran, et al. Cloning and characterization of maize ZmSPK1, a homologue to nonfermenting1-related protein kinase2 [J]. African Journal of Biotechnology, 2006, 5: 490-496.
[19]Podel S, Gribskov M. Predicting N-terminal myristoylation sites in plant proteins [J]. BMC Genomics, 2004, 5: 37-51.
[20]Ishitani M, Liu J P, Halfter U, et al. SOS3 function in plant salt tolerance requires N-myristoylation and calcium binding [J]. Plant Cell, 2000, 12: 1667-1677.
[21]Umezawa T, Yoshida R, Maruyama K, et al. SRK2C, a SNF1-related protein kinase 2, improves drought tolerance by controlling stress-responsive gene expression inArabidopsis thaliana[J]. PNAS, 2004, 101: 17306-17311.
[22]Shinozaki K, Yamaguchi-Shinozaki K. Molecular responses to dehydration and 1ow temperature: differences and crosstalk between two stress signaling pathways [J]. Curr Opin Plant Biol, 2000, 3: 217-223.
[23]Bray E A. Molecular responses to water deficit [J]. Plant Physiol, 1993, 103: 1035-1040.
[24]Shinozaki K, Yamaguchi-shinozaki K. Gene expression and signal transduction in water stress response [J]. Plant Physiol, 1997, 115: 327-334.
Cloning and expression ofSnRK2.1gene under abiotic stress
ZHANG Hongying, JIA Hongfang, ZHANG Songtao, YANG Yongxia, CUI Hong
Key Laboratory of Tobacco Cultivation, College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, China
One EST ofSnRK2was screened from glandular trichome cDNA library of tobacco. Based on the EST sequence,NtSnRK2.1was isolated from tobacco (Nicotiana tabacumL.) byin silicocloning and RT-PCR.NtSnRK2.1includes an open reading frame (ORF)of 1017 bp and encodes 338 deduced amino acid residues (AAR) with a calculated molecular mass of 43 kDa and a predicted pI of 5.78.Scansite analysis indicated that NtSnRK2.1 contained potential serine/threonine protein kinase activities like other SnRK2 family members.Phylogenetic analysis suggestedNtSnRK2.1was high homologous to its orthologous genes from Arabidopsis, rice and wheat, which were also induced by abiotic stresses. Reverse transcription-polymerase chain reaction (RT-PCR) and quantitative real-time PCR (qRT-PCR)was used to determine expression patterns ofNtSnRK2.1in tobacco. Results revealed thatNtSnRK2.1expressed most strongly in tobacco roots, more in leaves, and marginally in stems. Expression patterns under abiotic stress responses suggested thatNtSnRK2.1was involved in response to NaCl, PEG, cold stresses and ABA treatment, with significant different responsive profiles. The sensitivity degrees ofNtSnRK2.1responding to four treatments was in the order of hyperosmolality > high salinity > low temperature (4℃ ) > abscisic acid.
Nicotiana tabacum; NtSnRK2.1; abiotic stress; cloning; expression analysis
10.3969/j.issn.1004-5708.2014.04.018
Q81 文献标志码:A 文章编号:1004-5708(2014)04-0094-07
中国烟草总公司特色优质烟叶开发重大专项浓香型项目(110201101001 TS-01),国家烟草局资助(110200902045)
张洪映(1982—),博士,讲师,从事烟草生物技术研究,Email: Zhangying198215@163.com
崔红(1966—),博士,教授,从事烟草生物技术研究,Email: cuihonger_13@163.com
2013-07-08
