烟草青枯菌遗传多样性分析
2014-11-24周训军杨玉文王静赵廷昌高必达
周训军,杨玉文,王静,赵廷昌,高必达
1中国农业科学院植物保护研究所,北京 100193 ;2湖南农业大学生物安全科技学院,长沙 410128;3中国农业科学院烟草研究所,青岛 266101
烟草青枯菌遗传多样性分析
周训军1,2,杨玉文1,王静3,赵廷昌1,高必达2
1中国农业科学院植物保护研究所,北京 100193 ;2湖南农业大学生物安全科技学院,长沙 410128;3中国农业科学院烟草研究所,青岛 266101
为阐明中国主要产烟省区烟草青枯菌的种内遗传多样性,揭示烟草青枯菌种内遗传多样性与烟草品种、地理来源等的关系,采用多位点序列分型(Multilocus Sequence Typing, MLST)研究方法对采自我国11个主要产烟省区的93株烟草青枯菌进行种内遗传多样性分析。结果表明:93株供试菌株被分为51个序列型(Sequence Type, ST),运用eBURST V3软件共享5/7基因标准可将所有供试菌株划分为4个亚群(group)与4个单一群(singleton)。我国烟草青枯菌地理分布广泛,存在丰富的种内遗传多样性,但烟草青枯菌的组群划分与菌株的地理区域和烟草品种没有明显的相关性。
烟草青枯菌;MLST;遗传多样性
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的危害全球烟草产业的毁灭性病害之一,印度尼西亚于1864年首先发现了青枯菌能对烟草造成毁灭性危害。现在,植物青枯病已经成为世界范围内广泛传播、危害严重的重大病害之一[1]。由于青枯病菌具有丰富的种内遗传多样性,使其寄主范围十分广泛,能侵染54个科的450多种植物[2]。烟草青枯病在我国分布广泛,尤其是长江流域及其以南产烟省区普遍发生,其中以福建、云南、四川、湖南和贵州烟区危害最为严重,甚至在某些年份大范围暴发流行,给当地烟农造成巨大损失。近年来,由于全球气候变暖等方面的原因,该病的危害范围在我国有由南向北扩展蔓延之势,且危害时间也在延长,对我国烟草的生产造成了巨大威胁[3]。
至今仍没有特别有效的药剂能够防治烟草青枯病。因此,培育出对烟草青枯病具有较强抗性和耐受性的烟草新品种是防治青枯病最理想也是最经济有效的方法。但由于青枯菌寄主范围的多样性和基因组的变异性,其致病性和菌系的变化与寄主作物品种、耕作栽培方式及其外界环境温度等均存在较大关系。所以,在实际生产中推广的抗病品种通常会由于种植年限的增长或种植地域的不同,使品种抗性丧失[4]。因此青枯菌的种内遗传多样性研究具有重要意义。
多位点序列分型(Multilocus Sequence Typing,MLST)是由多位点酶电泳技术发展出来的一种新的遗传多样性分析方法。该方法主要运用PCR技术和测序技术来揭示看家基因序列的碱基位点突变从而对菌株进行遗传多样性分析[5]。看家基因(Housekeeping gene)是具有高度保守性质的与核心代谢功能相关的基因,但是不同的种以及不同菌株之间的看家基因又存在一定的差异即变异性,一个等位基因位点上可能存在一个或几个碱基的变异。目前该方法已广泛应用于动物细菌病害的分型研究和流行病学研究[6-12],在植物细菌病害的研究中仅见对瓜类果斑病菌的研究报道[13-14]。
1 材料与方法
1.1 材料
1.1.1 供试菌株的采集、鉴定
2011年度分别于四川、云南、贵州、重庆、湖南、湖北、广东、广西、江西和安徽等十个主要产烟省区田间采集了不同烟草品种疑似青枯病病样材料167份,以75% 酒精对病样材料进行表面消毒,于无菌条件下取茎秆或叶片的病健交界处组织,放入灭菌培养皿中,倒入75%的酒精灭菌4 min,用镊子将材料夹入无菌水中清洗5~10 min,然后置于小研钵中研磨,用移液器吸取40 μL左右研磨汁液滴入含有TTC的NA培养基平板划线,写上标签,放入28℃培养箱中培养72 h,挑取呈典型菌落形态(菌落一般较大,微凸起,呈现不规则圆形,中间粉红色,外周乳白色,对光观察能见轮纹,菌落流动性较强[15])的单菌落,于NA培养基平板或斜面上划线,28℃条件下培养48 h后挑菌,室温条件下保存于装有灭菌去离子水的离心管中备用。经分离、纯化和鉴定共得到67株烟草青枯菌(表1);另外,对本实验室保存的26株已鉴定的烟草青枯菌进行活化(表2),最终确定了采自我国11个烟草主产省区12个不同烟草品种上的共93株烟草青枯菌作为本研究的实验材料。
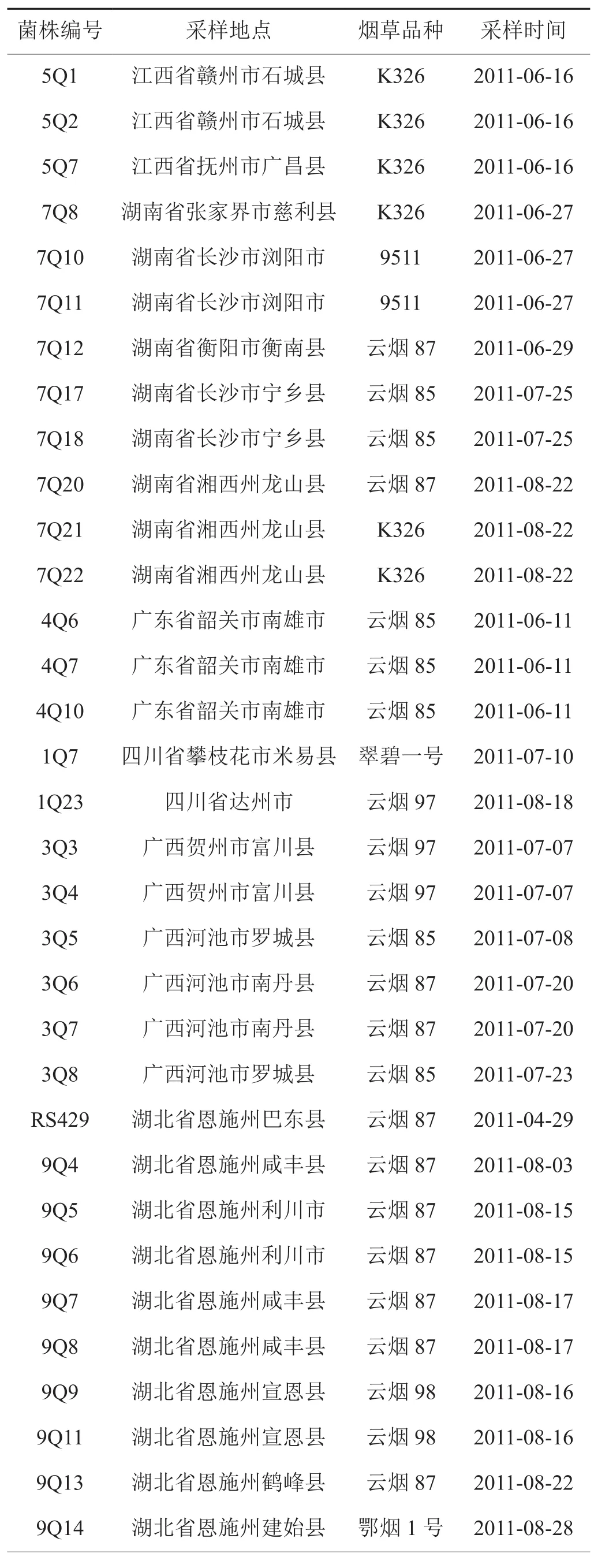
表1 分离鉴定的67株烟草青枯菌Tab. 1 67 tobacco plants with R. solanacearum tested separately

表1 (续)
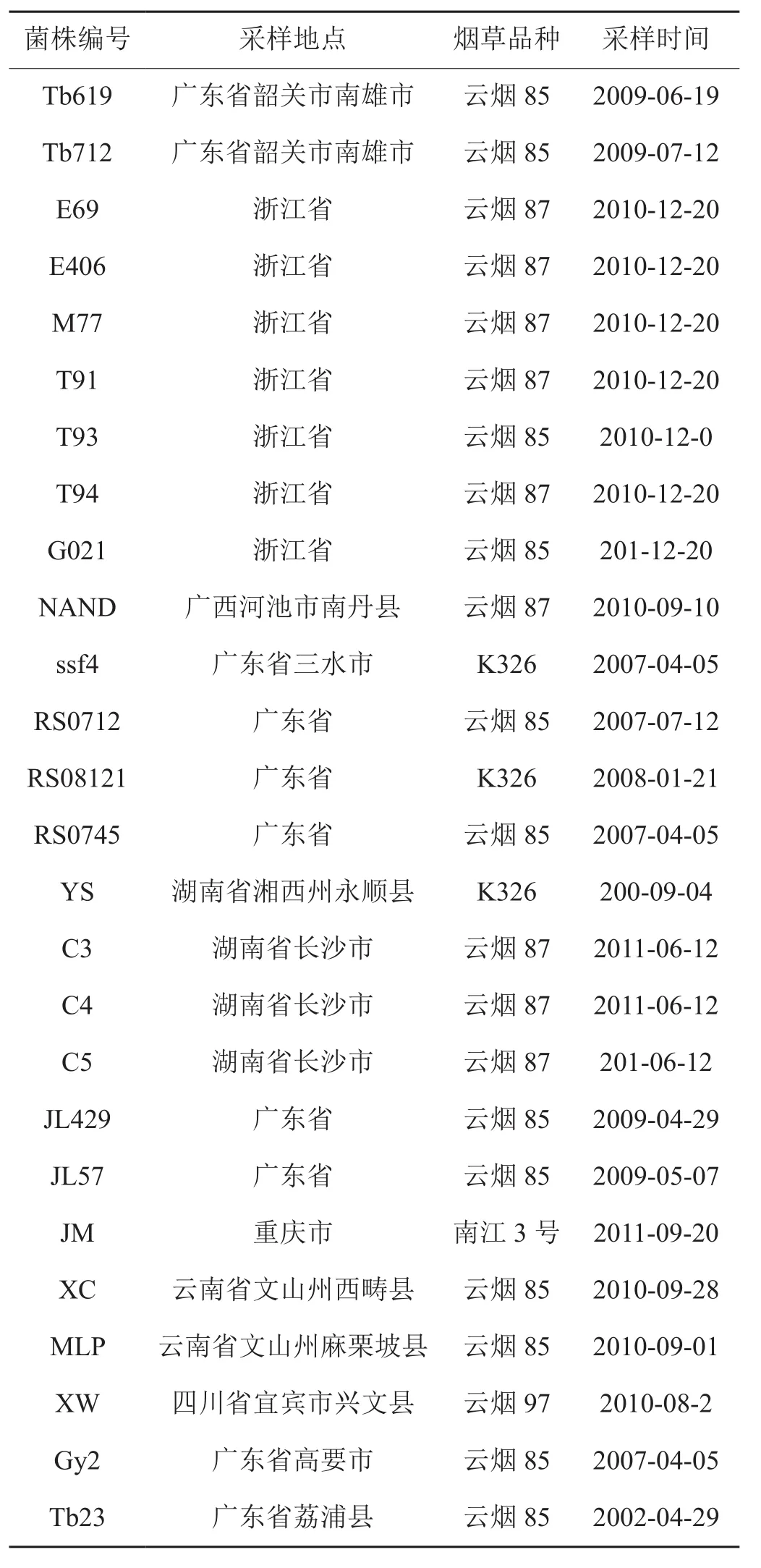
表2 本实验室保存的26株烟草青枯菌Tab. 2 26 tobacco plants with R. solanacearum stored in the laboratory
1.1.2 主要仪器和试剂
超净工作台(苏州净化设备有限公司,SW-CJ-1FD型单人单面净化工作台),恒温培养箱(上海实验仪器厂有限公司,DHP120),恒温水浴锅(Julabo,TW8),PCR仪(TaKaRa PCR Thermal Cycler),电泳仪(北京六一仪器厂,DYY-8C),凝胶成像分析系统(BIO-RAD Gel DocTMXR Imaging System);细菌基因组DNA提取试剂盒(北京百灵克生物科技有限责任公司),2×Taq PCR MasterMix(天根生化科技北京有限公司),琼脂糖(InvitrogenTMAgarose-Molecular Biology Grade),DNA MarkerII、λDNA/HindIII( 中科瑞泰(北京)生物科技有限公司)等。
1.2 方法
1.2.1 菌株基因组DNA提取
将青枯菌在TTC培养基平板划线并于28℃培养箱中培养48h,然后用灭菌枪头在无菌条件下挑取火柴头大小的菌落,接种在装有高压灭菌的NA液体培养基的玻璃试管内。将试管放在28℃恒温摇床内,200 r/min摇培16~17 h,将摇好的菌悬液按照细菌基因组DNA提取试剂盒上面的步骤进行菌株基因组DNA的提取。
1.2.2 看家基因的筛选
参考相关文献并从中选出12个常用于革兰氏阴性细菌MLST分型且多态性好的看家基因[6-14],从NCBI网站下载青枯菌菌株GMI1000基因组全序列,将初选的12个看家基因与GMI1000基因组全序列比对,并利用引物设计专业软件primer5.0分别设计各看家基因的引物并对各看家基因进行PCR预扩增,以筛选合适的看家基因和扩增条件,最终确定了7个看家基因(表2)为本实验的看家基因,PCR扩增引物由上海生工生物工程有限公司合成。

表3 7个看家基因在青枯菌菌株GMI1000基因组中的功能、位置和引物序列Tab. 3 Function, location and primer sequence of 7 house-keeping genes in the genome GMI1000
1.2.3 扩增体系及反应程序
用筛选出的特异性高的引物对所有供试菌株的七个看家基因分别进行PCR扩增,PCR扩增采用50 μL反应体系,其中2×Taq PCR MasterMix 20 μL,ddH2O 24 μL,上下游引物各2 μL,DNA模板2 μL。反应程序为95℃预变性5 min,95℃30 s,59℃30 s,72℃90 s,35个循环;72℃延伸10 min。取10 μL PCR产物于1.5%的琼脂糖凝胶电泳,再通过Bio-rad凝胶成像系统观察结果,然后将扩增产物送至北京六合华大基因科技股份有限公司进行测序。
1.2.4 序列比对和分析
经过对看家基因的PCR扩增以及碱基测序,每个菌株都能得到7个400~600 bp大小的看家基因扩增产物的碱基序列,运用DNAMAN软件对全部供试菌株的7个看家基因的扩增产物碱基序列分别进行多序列比对分析,依照各个看家基因中不同等位基因的碱基差异将每个看家基因的各等位基因进行排列组合并进行数字编号,然后所有菌株都能得到各个看家基因上的一个数字编号即等位基因号 (Allelic Profile),最后每个菌株都能够用7个看家基因的等位基因号组成的数列表示,称为菌株的序列型(Sequence Type,ST)[9]。
登录http://eburst.mlst.net/,采用eBURST V3程序共享5/7基因标准分析,将全部供试菌株的由不同序列型及等位基因号组成的一个数字矩阵提交网络,利用程序分析便能够获得全部菌株的种群遗传关系图谱。
2 结果与分析
2.1 基因组DNA提取和PCR扩增
用细菌基因组提取试剂盒提取基因组DNA后电泳检测提DNA提取效果,然后进行看家基因的PCR扩增,并电泳检测扩增效果,将合格样品送至北京六合华大基因科技股份有限公司进行测序,获得菌株看家基因的碱基序列。图1与图2分别为2011年部分新分离菌株基因组DNA电泳和看家基因扩增产物电泳图。

图1 部分基因组DNA提取产物电泳图Fig. 1 Electrophoresis map of extraction of some genome

图2 引物pstS1/pstS2扩增部分烟草青枯病菌的产物电泳图Fig. 2 Electrophoresis map of R. solanacearum for the expanded part of pstS1/pstS2
2.2 序列比对和分析
将所有菌株的7个看家基因测序所得碱基序列用DNAMAN软件分别进行比对分析,结合测序峰图,峰图中开始的若干个波峰不明显的碱基不计入分析。将各个看家基因的不同等位基因位点上的不同碱基进行排列组合并进行数字编号,形成每个看家基因的不同等位基因号,分析结果表明:所有供试菌株的七个看家基因rfbD、efp、pstS1、dnaQ、ureG、ppa、adk分别存在5、7、14、10、8、9、4个等位基因号。对各个看家基因的各等位基因位点上的不同碱基形成不同的组合进行数字编号,即为每个看家基因的等位基因号( Allelic Profile),最后每个菌株都能够用7个看家基因的7个等位基因号组成的数列表示,称为菌株的序列型(Sequence Type, ST)。经过数据统计分析,93株供试菌株被划分为51个序列型(Sequence Type,ST)。登陆http://eburst.mlst.net/,将所有供试菌株形成的序列型和等位基因号形成的数字矩阵提交网络,选择共享5/7的基因标准,运用eBURST V3程序分析,结果表明,所有菌株可分为4个亚群(group)和4个单一群(singleton):亚群1包含24个ST的50个菌株,其核心型为ST1,ST1包含19个菌株,来源包括了除江西以外的所有采样省区;亚群2包含19个ST的32个菌株,其核心型为ST40,ST40 包含2个菌株,都来自安徽;亚群3包含2个ST的2个菌株,都来自湖南;亚群4包含2个ST的5个菌株,其中3株来自重庆,2株来自贵州;4个单一群各包含1个菌株,分别是浙江2个菌株,云南和广西各1个菌株。
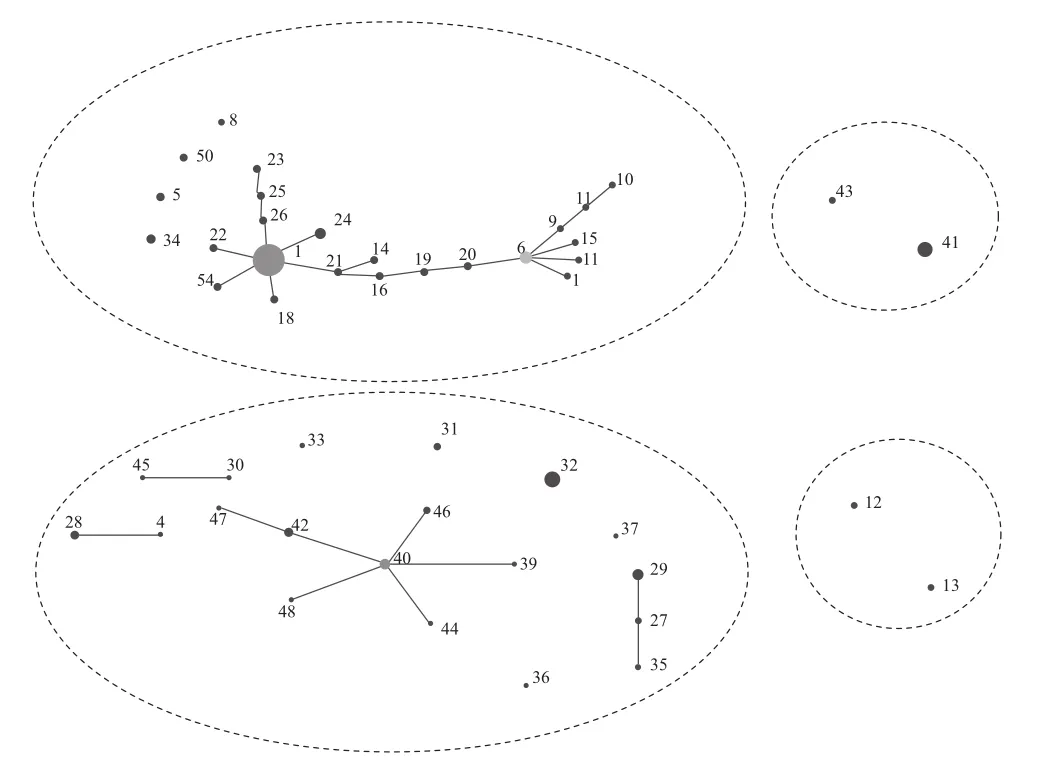
图3 程序eBURST V3在选择共享5/7基因标准时获得的所有供试烟草青枯菌的种群遗传关系图Fig. 3 Population genetic relationship diagram for eBURST V3 sharing 5/7 gene criterion
通过共享5/7基因标准分析,主要亚群(亚群1,亚群2)中都包含了所有采样省区的菌株,且亚群1的核心型ST1包含了除江西省的所有采样地区菌株,虽然亚群2的核心型ST40的两个菌株都来自安徽,但亚群2中各菌株之间的联系比较松散,并没有与核心型菌株紧密联系在一起。这一结果表明我国烟草青枯病的地理分布极为广泛,且各省的烟草青枯病都是由同一ST的菌株发展蔓延的。
本研究采用的93株烟草青枯菌主要采自K326、KRK26、9511、云烟85、云烟87、云烟97、云烟98、南江3号、翠碧一号、鄂烟1号、毕纳1号、牛津2号等12个烟草品种。根据共享5/7基因标准的组群划分,亚群1的核心型ST1包含的菌株分别采自7个不同的烟草品种,亚群1中所有菌株分别采自10个不同的烟草品种;亚群2的核心型ST40的两个菌株都采自同一烟草品种(云烟97),但亚群2中所有菌株来自6个不同的烟草品种。根据ST的划分可以看出,不同烟草品种上分离的菌株可以被划分到同一ST,而同一烟草品种上分离的不同菌株则可以被划分为不同的ST,且烟草品种与ST划分之间并没有规律。这一实验结果表明,烟草青枯菌的组群划分与烟草品种无关。
3 结论与讨论
由于青枯菌寄主范围广泛,危害严重,且到目前为止还没有能有效防治青枯菌的药剂。所以,各国学者一直在尝试了解青枯菌种内遗传变化规律,为选育抗病品种和研制新型防治药剂提供理论依据。在第三届国际青枯病大会上,Fegan和Prior首次提出了演化型分类框架用于描述青枯菌种内差异,该分类框架将青枯菌划分为种、演化型、序列变种和克隆四个不同分类水平,并分别建立了与之对应的鉴定方法。演化型分类框架与传统的小种及生化变种分类方法相比可以更精确地反映青枯菌这一复合种的地理起源及种内的遗传多样性[16]。
对于烟草青枯菌种内遗传多样性的研究,国内外报道的比较少。1982年,Yi等对1980-1981年间采自韩国烟草的14株青枯菌菌株进行分类研究,通过对接种不同寄主的反应分为两个小种,生化型测定分别属于生化变种1和生化变种4[17]。2007年,郑向华等采用RAPD(随机扩增多态性DNA)对广东省的38株烟草青枯菌进行了遗传多样性分析,表明烟草青枯菌组群划分与寄主来源有一定相关性,但与地理区域、生物型和致病型没有明显的相关性[4]。2010年,徐进等对45株福建烟草青枯菌进行演化型分类,结果表明所有菌株均为演化型I型即亚洲分支菌株,其中有43株属于生化变种III,1株属于生化变种IV,1株属于非标准型生化变种[18]。
本研究首次运用了MLST(多位点序列分型)对采自全国11个主要产烟省区12个不同烟草品种的93株烟草青枯菌进行遗传多样性分析,结果表明93株烟草青枯菌具有丰富的种内遗传多样性,所有菌株可以分为4个亚群和4个单一群。但是烟草青枯菌组群划分与寄主的地理来源和品种没有明显相关性。
本研究采用的MLST法已广泛应用于细菌病害的分型研究[6-12],但是还未见用于烟草青枯菌遗传多样性分析的报道。该方法选择高度保守的看家基因为研究对象,分辨率高,更能反映菌株的遗传多样性,且得到的实验数据可以提交到官方网站http://www.mlst.net/,为后续研究者提供参考和依据,有利于研究者全面的了解病害在世界各地的发生和流行趋势,为病害的防控提供理论依据。
[1]Hayward A C. Biology and epidemiology of bacterial wilt caused by Pseudomonas Solanacearum[J]. Annual Review of Phytopathology, 1991, 29(1): 65-87.
[2]Wicker E, Grassart L, Coranson B R, et al. Ralstonia solanacearum strains from Martinique (French West Indies)exhibiting a new pathogenic potential[J]. Applied and Environmental Microbiology, 2007, 71(21): 6790-6801.
[3]孔凡玉. 烟草青枯病的综合防治[J]. 烟草科技, 2003(4):42-43.
[4]郑向华,邓海滨,刘琼光,等. 广东省烟草青枯菌的菌系和遗传多样性[J]. 华中农业大学学报, 2007,26(4): 463-468.
[5]姬小薇,廖亚玲,毛旭虎,等.MLST分析在病原微生物基因分型应用中的研究进展[J].国际检验医学杂志,2011,32(2):246-249.
[6]Scally M, Schuenzel E L, Ctouthamer R, et al. Multilocus sequence type system for the plant pathogen Xylella fastidiosa and relative contributions of recombination and point mutation to clonal diversity[J]. Applied and Environmental Microbiology, 2005, 71(12): 8491-8499.
[7]Homan W L, Tribe D, Poznanski S, et al. Multilocus sequence typing scheme for Enterococcus faecium [J].Journal of Clinical Microbiology, 2002, 40(6): 1963-1971.
[8]Dingle K E, Colles F M, Wareing D R A, et al. Multilocus Sequence Typing System for Campylobacter jejuni [J].Journal of Clinical Microbiology, 2001, 37(1): 14-23.
[9]McCombie R L, Finkelstein R A, Woods D E. Multilocus sequence typing of historical Burkholderia pseudomallei isolates collected in southeast Asia from 1964 to 1967 provides insight into the epidemiology of melioidosis[J].Journal of Clinical Microbiology, 2006, 44(8): 2951-2962.
[10]邓小玲, 管大伟, 黎薇, 等. MLST分型技术应用于脑膜奈瑟菌的分子流行病学研究[J]. 华南预防医学, 2008,34(3): 10-14.
[11]张少敏, 徐建国. 多位点序列分型及其应用[J]. 疾病监测, 2008, 23(10): 648-650.
[12]王新, 周婷, 孟洪江. 禽肉空肠弯曲杆菌的多位点序列分型技术研究[J]. 中国食品学报, 2010, 10(2): 180-186.
[13]Feng J J, Schuenzel E L, Li J Q, et al. Multilocus sequence typing reveals two evolutionary lineages of Acidovorax avenae subsp. citrulli [J]. Phytopathology, 2009, 99: 913-920.
[14]阎莎莎.瓜类细菌性果斑病菌种内遗传多样性的研究[D].北京:中国农业科学院,2011.
[15]Lucas G B. Diseases of Tobacco[M]. Third edition Reteigy North Carolina, 1975, 365-382.
[16]Fegan M, Prior P. How complex is the “Ralstonia solanacearum species complex” [M]. Allen C, Prior P,Hayward AC. Bacterial wilt disease and the Ralstonia solanacearum species complex . St. Paul: APS, 2005: 449-462.
[17]Yi T K,Kim J H, Kang S K,et al.Classification of Pseudomonsa solanacearum isolates from tobacco plants in korea[J]. Korean Journal of Plant Protection, 1982, 21(3):123-127.
[18]徐进, 顾刚, 潘哲超, 等. 福建烟草青枯菌演化型及生化变种鉴定研究[J]. 中国烟草学报, 2010, 16(6): 66-71.
Genetic diversity ofRalstonia solanacearumin tobacco
ZHOU Xunjun1,2, YANG Yuwen1, WANG Jing3, ZHAO Tingchang1, GAO Bida2
1 Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China;2 College of Bio-safety Science and Technology, Hunan Agricultural University, Changsha 410128, China;3 Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China
Genetic diversity was analyzed with data from 93R. solanacearumstrains collected from 11 main tobacco-growing areas by Multilocus Sequence Typingin in order to reveal relationship between tobacco variety, geographical origin and genetic diversity ofR.solanacearum.There were 51 sequence types (STs) out of 93R. solanacearumstrains, and all tested strains were classified into 4 groups and 4 singletons by using eBURST V3 software sharing 5/7 gene criterion. MLST analysis showed thatR. solanacearumwas widely spread in China with rich genetic diversity and no significant correlation was found between geographical area, variety and group classification ofR.solanacearum.
Ralstonia solanacearum;MLST; genetic diversity
10.3969/j.issn.1004-5708.2014.04.014
Q81 文献标志码:A 文章编号:1004-5708(2014)04-0069-06
中国烟草总公司科技重点项目(110201002025,110200902065和110201202002)
周训军(1986—),硕士,研究方向为烟草青枯菌遗传多样性,Email:zhouxj@isa.ac.cn
赵廷昌(1964—),博士,研究员,研究方向为植物细菌病害及植物与病原细菌互作,Email:zhaotgcg@163.com
2013-07-25
