氮素营养水平对衰老期烟叶氮代谢的影响及品种间差异
2014-11-24武云杰李飞杨铁钊张小全
武云杰,李飞,杨铁钊,张小全
河南农业大学烟草学院, 郑州450002
氮素营养水平对衰老期烟叶氮代谢的影响及品种间差异
武云杰,李飞,杨铁钊,张小全
河南农业大学烟草学院, 郑州450002
为揭示品种间烟叶品质的差异和筛选耐氮肥品种,研究了烤烟品种在不同氮素营养条件下氮代谢的差异。结果表明:氮低效与氮高效品种相比,可溶性蛋白和总氮降解量大,谷氨酰胺合成酶(GS)活性低,降幅大,谷氨酸脱氢酶(GDH)活性高,硝酸还原酶(NR)活性低,氨气补偿点高,品种间差异显著。随着施氮量的增加,氮低效品种氮素营养物质降解量百分数高,GS活性降幅大且受施氮量影响较小,GDH活性和氨气挥发潜力增大,与氮高效品种相比差异显著。NC89和豫烟10号分别在施氮量在45.00和60.00 kg·hm-2时氮代谢生理强度最大,而且豫烟10号各处理间差异小于NC89。说明不同氮效率品种烟叶的氮素再同化和转移能力存在差异,氮低效品种对氮素再同化量小,再转移量大,对氮素的应用范围广,调节能力强,而氮高效品种再同化量大,转移量小,对氮素的应用范围小,调节能力弱。烟叶衰老期氮代谢与烟叶衰老速度有关,其中GS对NH4+的再同化能力和质外体对NH4+的转移能力起主导作用。
烤烟;氮效率;氮代谢;氮素营养
氮素是决定烟叶产量和质量的关键因素之一,品种间氮素代谢特性存在差异[1-2]。烟叶衰老期是品质形成的关键时期,氮素尽快转化或降解,才有利于烟叶成熟落黄[3];烤烟对氮素营养十分敏感,增施氮肥可以增加产量,但在高施氮量条件下往往造成烟叶品质下降[4-5],而且氮代谢相关指标也受很大影响[6-7]。谷氨酰胺合成酶(GS)是氮素同化的关键酶,通过影响叶片NH4+浓度来调控NH4+的转移[8-9]。最新研究表明,品种间质外体NH4+浓度和氨气补偿点由品种自身的氮素代谢特征决定[10-11]。目前我国烟区氮素残留量高,土壤的氮素矿化量大等因素使衰老期烟叶的氮素营养难以控制,容易造成贪青晚熟[12-13]。已经研究了不同氮素利用效率基因型烤烟叶片衰老期间氮素代谢差异[14],但是关于烤烟氮素代谢相关指标在不同施氮量情况下的变化趋势报道较少,尤其是对不同氮素利用效率品种在不同氮素营养条件下氮代谢的差异未见报道。本文以品种、施氮量为处理,对烤烟衰老期间氮素代谢相关指标进行测定和分析,为揭示品种间烟叶品质的差异和筛选耐氮肥品种提供理论依据。
1 材料与方法
1.1 试验材料与设计
试验于2012年在许昌禹州进行。试验地前茬作物一致,土壤肥力均匀,供试土壤为褐土,基础土壤肥力为全氮 1.07 g·kg-1,土壤碱解氮 65.25 mg·kg-1,有效磷 5.56 mg·kg-1,速效钾 92.39 mg·kg-1,缓效钾791.00 mg·kg-1, 有机质20.60 g·kg-1,pH 值 8.02。选用烟叶衰老期氮素利用效率差异较大的两个烤烟品种:豫烟10号(衰老期氮低效,表中用YY10表示)和NC89(衰老期氮高效)[10]。采用随机区组设计,每个处理3次重复,共30个小区,每小区植烟50株,株行距为50 cm×110 cm。每公顷施纯氮15.00、30.00、45.00、60.00、75.00 kg共5个处理,分别用N15、N30、N45、N60、N75表示;所有处理均施 P2O560.00 kg·hm-2,K2O 90.00 kg·hm-2,用 NH4NO3满足5个氮素处理,基追肥比7:3,追肥在移栽后25 d施入,按照大田优质烟叶生产管理方法进行管理。选取整齐一致的单株,以第11片叶(自下向上数)为试验对象,在叶龄40、50、60、70、80 d(以幼叶长1 cm,宽0.5 cm时作为叶龄第1 d)取样测定叶片NH4+浓度、总氮和可溶性蛋白含量,GS、谷氨酸脱氢酶(GDH)和硝酸还原酶(NR)活性,质外体NH4+浓度和pH。各项指标测定重复3次。
1.2 测定项目与方法
NR活性测定,叶片NH4+浓度,总氮和可溶性蛋白含量的测定分别用活体法、茚满三酮法、凯氏定氮法、考马斯亮蓝G-250法[15]。
GS和GDH活性测定,质外体提取参照段旺军[11]的方法,并采用苹果酸脱氢酶测定法检验纯度[16],本试验测定值为1.96%(小于3%合格)。用连续流动分析仪测定质外体NH4+浓度。质外体pH用微电极测定。氨气补偿点计算参考文献[17-19]的方法。
1.3 数据处理
采用Microsoft Excel 2003和SPSS 17.0对数据进行处理和方差分析。
2 结果与分析
2.1 施氮量对烟叶衰老期可溶性蛋白和总氮含量的影响
由表1和2可知,烟叶进入衰老期,同一施氮量下,可溶性蛋白均在叶龄50 d达到峰值之后一直下降,NC89均显著高于豫烟10号;豫烟10号总氮含量从叶龄40 d一直下降,NC89除N15处理外均在叶龄50 d后下降。
不同施氮量下,可溶性蛋白含量随施氮量的增加,呈先上升后下降的趋势,豫烟10号在N60处理最高,NC89以N45最高;总氮含量均随施氮量的增加而上升,豫烟10号以N75最大,NC89以N60处理最大。总氮降解百分数(1-最终剩余量/最大积累量)一定程度上反应了烟叶氮素降解和衰老速率。随着施氮量的增加,豫烟10号的总氮降解百分数为69.11%、74.73%、66.775、62.53%和57.33%,NC89为 25.75%、30.46%、38.12%、36.96%和33.72%,整体趋势均为先升高后下降,而且豫烟10号降解百分数显著高于NC89。氮低效品种先于氮高效品种达到高峰并下降;氮低效品种处理间差异较小。

表1 施氮量对烟叶衰老期可溶性蛋白含量的影响Tab. 1 Effects of nitrogen application rate on soluble protein content during tobacco leaf ageing period mg·g-1

表2 施氮量对烟叶衰老期总氮含量的影响Tab. 2 Effects of nitrogen application rate on total nitrogen content during tobacco leaf ageing period %
2.2 施氮量对烟叶衰老期叶片NH4+浓度的影响
由表3可知,同一施氮量下,叶片NH4+浓度除豫烟10号在N15处理下从叶龄40 d持续下降外,其他处理均在叶龄50 d最大,之后缓慢下降,豫烟10号在叶龄40~50 d均显著高于NC89,在60~70 d显著低于NC89,80 d时相差不大。不同施氮量下,叶片NH4+浓度的峰值随施氮量的升高,豫烟10号从叶龄40 d推迟到50 d;而NC89均在叶龄50 d,且随施氮量的增大而增加。
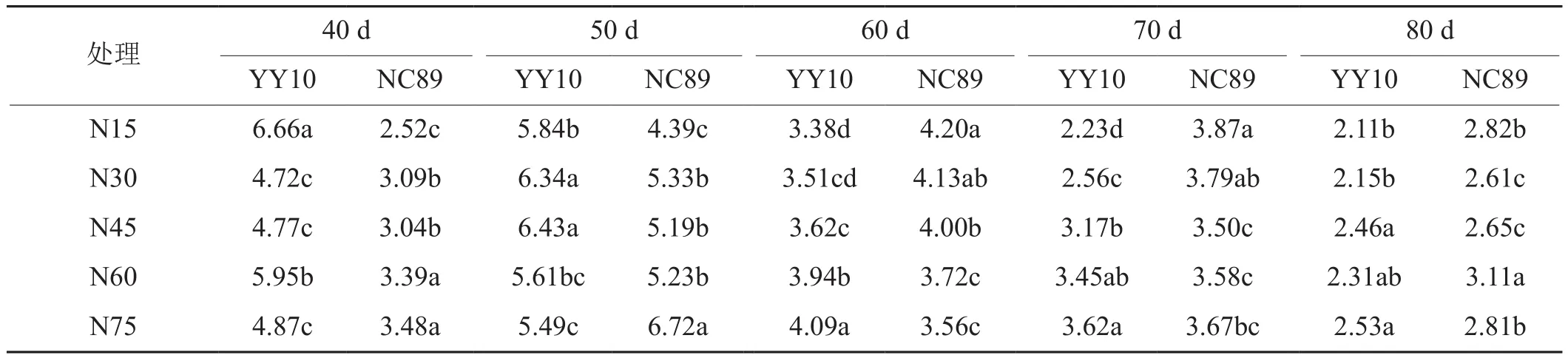
表3 施氮量对烟叶衰老期叶片NH4+浓度的影响Tab. 3 Effects of nitrogen application rate on NH4+ concentration during tobacco leaf ageing period mmol·L-1
2.3 施氮量对烟叶衰老期GS活性的影响
由表4可知,同一施氮量下,两个品种叶片的GS活性存在差异,在叶龄40 d豫烟10号显著高于NC89,在叶龄50 d在N15和N30处理下低于NC89,在N60和N75处理下高于NC89,其中NC89均在叶龄50 d达到峰值。随着施氮量的增加,GS活性显著提高,豫烟10号从GS活性最大到叶龄60 d,其活性随施氮量的增加分别下降了64.20%、66.25%、66.89%、58.75%和54.15%, 而 NC89分别 下 降 了 29.83%、19.03%、21.88%、24.21%和18.86%。
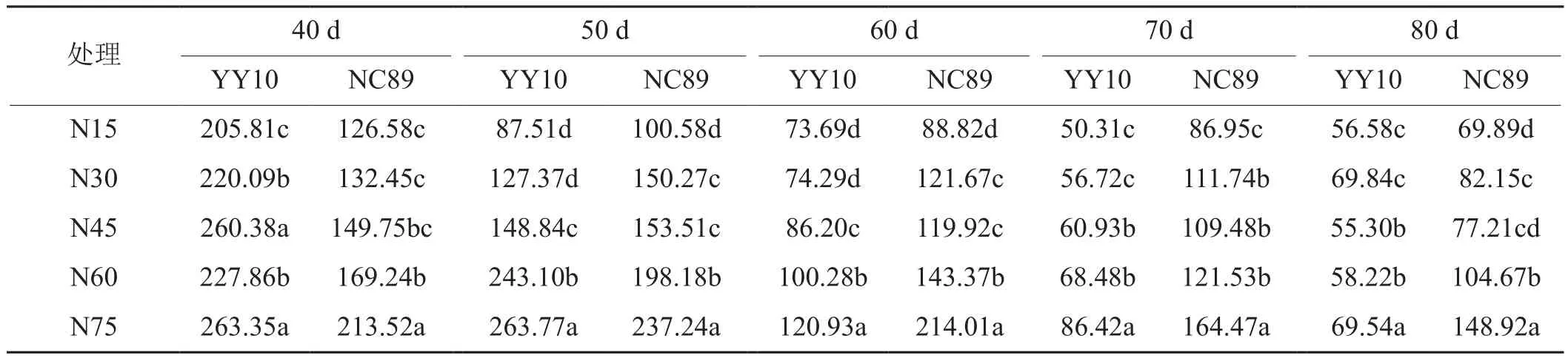
表4 施氮量对烟叶衰老期GS活性的影响Tab. 4 Effects of nitrogen application rate on GS activity during tobacco leaf ageing period nmol·mg-1·min-1
2.4 施氮量对烟叶衰老期GDH活性的影响
由表5可知,同一施氮量下,GDH活性均在50 d达到峰值,叶龄50 d以前活性较小变化平稳,50~60 d之后开始小幅下降,60~70 d GDH降幅变大,70~80 d趋于平稳,并且在40~60 d处于较高水平。豫烟10号的GDH活性显著高于NC89。NC89在各个时期均随施氮量的增加而下降,而豫烟10号除叶龄40 d外均随施氮量的上升而上升。

表5 施氮量对烟叶衰老期GDH活性的影响Tab. 5 Effects of nitrogen application rate on GDH activity during tobacco leaf ageing period nmol·mg-1·min-1
2.5 施氮量对烟叶衰老期NR活性的影响
由表6可知,同一施氮下,随着叶片的衰老,NR活性逐渐下降,并随施氮量的增加在叶龄50 d达到峰值后下降。其中豫烟10号活性低于NC89,在叶龄50~60 d差异显著。不同施氮处理下,豫烟10号除N75处理外NR活性均从叶龄40 d持续下降,而NC89在处理N15和N30下从叶龄40 d开始下降,其他处理均在叶龄50 d达到峰值后下降。

表6 施氮量对烟叶衰老期NR活性的影响Tab. 6 Effects of nitrogen application rate on leaves NR activity during tobacco leaf ageing period NO2-·g-1·h-1
2.6 施氮量对烟叶衰老期质外体NH4+浓度、pH和氨气补偿点的影响
由表7可知,不同品种和施氮量处理的质外体NH4+浓度均呈先上升后下降的趋势,同一处理均在叶龄60 d达到峰值,随着施氮量的增加,豫烟10号和NC89分别以N60和N45处理下最大,但施氮量过大则降低,叶龄40~70 d豫烟10号显著高于NC89。质外体pH均在叶龄50 d达到峰值后下降,NC89在叶龄40 d显著高于豫烟10号,之后各时期均低于豫烟10号(表8)。随着施氮量的增加豫烟10号和NC89的质外体pH分别在N45和N30处理下达到最大,施氮量继续增加则下降。
豫烟10氨气补偿点除叶龄40 d外均显著高于NC89(表9),同一处理两品种均在叶龄50~60 d达到高峰;随着施氮量的增加均以N45处理下最高,品种间差异显著。
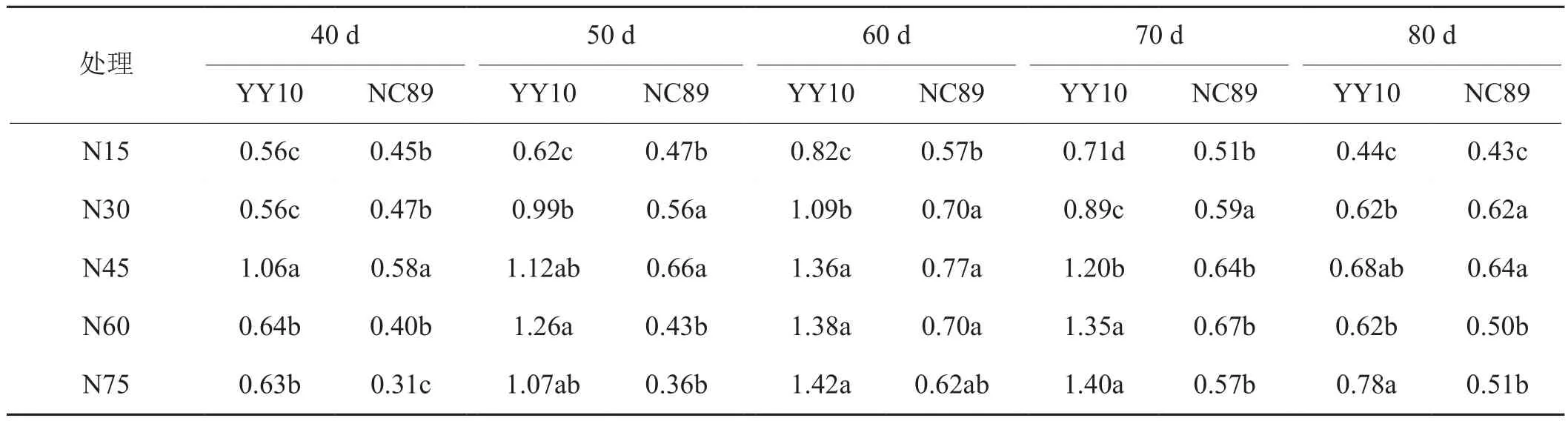
表7 施氮量对烟叶衰老期质外体NH4+浓度的影响Tab. 7 Effects of nitrogen application rate on apoplastic NH4+ concentration during tobacco leaf ageing period mmol·L-1
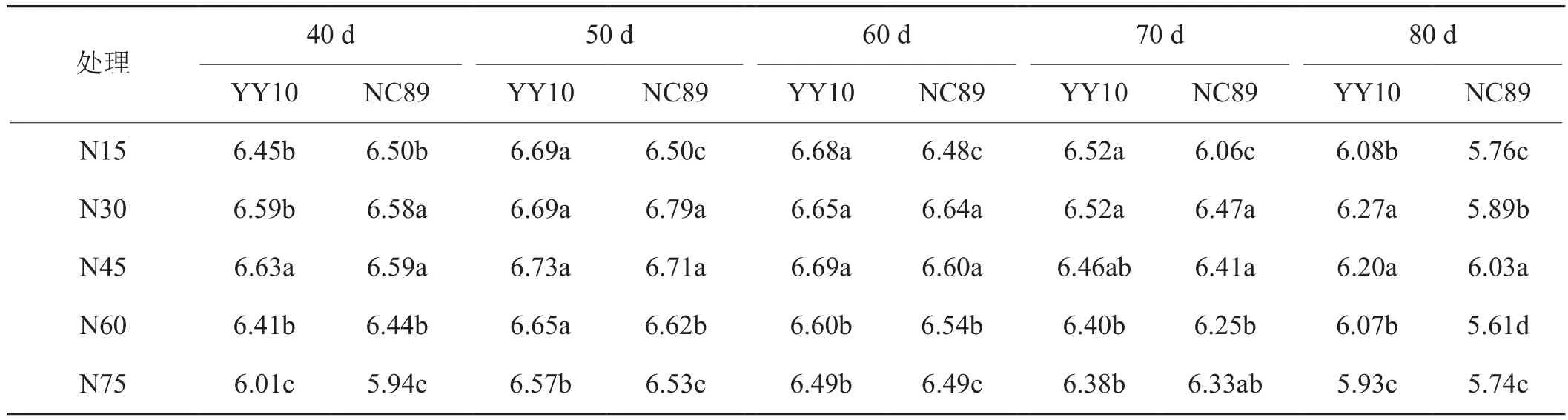
表8 施氮量对烟叶衰老期质外体pH的影响Tab. 8 Effects of nitrogen application rate on apoplastic pH during tobacco leaf ageing period

表9 施氮量对烟叶衰老期氨气补偿点的影响Tab. 9 Effects of nitrogen application rate on NH3 compensation point during tobacco leaf ageing period nmol·mol-1
3 讨论
研究发现,植物在衰老过程中,地上部分营养物质在达到高峰后开始降解[20],营养进行再分配和再利用[21]。由于叶片NH4+主要来自总氮和可溶性蛋白等氮素营养物质的降解以及NR的还原[22-23],豫烟10号氮素营养物质合成量小和降解量大,总氮降解百分数高于NC89,说明豫烟10号在烟叶衰老期间氮素降解能力强,在高氮处理下也能保持较高的降解量。
植物体内的NH4+是氮代谢的核心中间体[24],植物体内95%的NH4+首先通过GS转化为有机氮[25]。豫烟10号GS酶活性下降速度较快,并显著低于NC89,各处理间表现一致。GDH在前期受诱导上升,其作用可能是合成氨,从而补偿氮素同化[26],后期GDH的作用可能转变为脱氨[27],把谷氨酸氧化成α-酮戊二酸,并释放出NH4+,但GDH作用转变的时间尚不明了[20-21]。豫烟10号GS活性降幅大,GDH活性高,NR活性低。说明豫烟10号衰老期氮代谢遗传特性受施氮量多少或土壤氮供应能力大小的影响小于NC89,即使在较高的氮素供应能力下,对叶片NH4+的同化量小,转移量大,保持较快的衰老速度。而NC89却不同,随着施氮量的增加,GS酶活性下降越来越缓慢,GDH活性低,这就是NC89在土壤碱解氮较高下烟叶易贪青晚熟的原因。
由于氮素同化量减少和NH4+的释放,产生大量叶片NH4+,但叶片NH4+在叶龄50 d就表现出下降趋势,说明烟叶可以通过其他氮素转运机制来避免NH4+产生毒害[28-29]。质外体是NH4+的动力池,衰老期质外体pH下降,叶片NH4+通过质外体,使氨挥发加剧[30-31]。本研究结果说明豫烟10号通过质外体挥发氨气等途径使叶片NH4+再转移量增大,减少了积累和毒害;而NC89的GS和NR活性高,GDH活性低,氨气补偿点低,大量的NH4+通过再同化作用,被烟叶再次合成有机物,从而使NH4+浓度下降。施氮量的增加虽然增大了NC89的氨气挥发潜力,但从氮素营养物质的积累和相关酶活性的变化看,其再同化能力对物质积累的作用要大于其对NH4+的转移作用。但是氮素再转移途径不仅由GS等酶活性和氨气补偿点控制,也与库源关系转换,气孔开闭、光照条件、土壤理化性质、气温状况等条件有关,需要做进一步研究[32]。
品种间氮素营养物质降解,氨气补偿点及GS等酶活性的变化反映了品种间衰老速度的差异,氮低效品种衰老速度快,与氮高效品种相比差异显著。豫烟10与NC89相比,氮素营养物质的降解量大,氮素吸收能力和对NH4+的再同化能力弱,对NH4+的转移能力强,增加施氮量使品种间对NH4+的转移特性表现的更加明显,因此要根据烟叶衰老期的氮素再利用效率和再转移能力,以及对不同施氮量的响应选择合适的栽培条件。
4 结论
品种间烟叶NH4+的再同化和再转移存在差异,与氮素营养物质的吸收和降解速率有关。氮低效品种与氮高效品种相比,可溶性蛋白和总氮含量低降解量大,GS活性降幅大,GDH活性高,NR活性低,氨气挥发潜力大。氮用量增加时,氮低效品种对氮素适用范围广,氮素再同化量低,转移量大,衰老速度快,保证了烟叶正常成熟落黄。豫烟10号和NC89分别在施氮量超过 60.00 kg·hm-2和 45.00 kg·hm-2时对烟叶氮素降解和衰老不利,在本地区分别适用60.00 kg·hm-2和 30.00~45.00 kg·hm-2的施氮量。
[1]陈爱国, 王树声, 申国明, 等. 烤烟叶片成熟期间碳氮代谢主要物质流分析[J]. 中国烟草学报, 2010, 16(4): 30-34.
[2]刘卫群, 岳俊芹, 汪庆昌, 等.不同氮素形态及配比对烤烟叶片氮代谢的影响[J]. 河南农业科学, 2004(6):53-55.
[3]陈顺辉, 李文卿, 江荣风, 等. 施氮量对烤烟产量和品质的影响[J]. 中国烟草学报, 2003 , Z1:36-40.
[4]李文卿,陈顺辉, 江荣风, 等. 不同施氮量对烤烟总氮和烟碱积累的影响[J]. 中国烟草学报, 2007, 13(4): 31-35.
[5]李文卿, 江荣风, 陈顺辉, 等. 不同施氮处理对烤烟生长和植物碱积累的影响[J]. 中国烟草学报, 2010, 16(2): 55-60.
[6]李志, 史宏志, 刘国顺. 施氮量对皖南砂壤土烤烟碳氮代谢动态变化的影响[J]. 土壤2010, 42(1): 8-13.
[7]刘国顺, 彭智良, 黄元炯. N、P互作对烤烟碳氮代谢关键酶活性的影响[J]. 中国烟草学报, 2009, 15(5): 33-37.
[8]陈刚, 徐阳春, 沈其荣. 施氮水平对水稻生育后期地上部氨挥发的影响[J]. 应用生态学报, 2008, 19(7): 1483-148.
[9]Edwards J W, Walker E L, Coruzzi G M. Cell-specific expression in transgenic plants reveals nonoverlapping roles for chloroplast and cytosolic glutamine synthetase[J].Proceedings of the National Academy of Sciences of the United States of America, 1990, 87: 3459-3463.
[10]刘化冰, 杨铁钊, 张小全, 等. 不同耐肥烤烟品种质外体NH4+浓度差异和有关指标分析[J]. 中国农业科学, 2010,43(14): 3036-3043.
[11]段旺军, 杨铁钊, 刘化冰, 等. 烟叶氨气补偿点的品种间差异及其与氮素代谢的关系研究[J]. 植物营养与肥料学报, 2011, 17(2): 149-158.
[12]刘青丽, 任天志, 李志宏, 等. 植烟黄壤供氮特征研究[J].中国农业科学,2010,43(1): 87-95.
[13]李春俭, 张福锁, 李文卿, 等. 我国烤烟生产中的氮素管理及其与烟叶品质的关系[J]. 植物营养与肥料学报,2007,13(2): 331-337.
[14]武云杰, 张小全, 段旺军, 等. 不同氮素利用效率基因型烤烟叶片衰老期间氮素代谢差异研究[J]. 中国烟草学报,2012, 18(5): 42-47.
[15]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社,2000: 31-125.
[16]Loubet B, Milford C, Hill PW, et al. Seasonal variability of apoplastic NH4+and pH in an intensively managed grassland[J]. Plant Soil, 2002, 238: 97-110.
[17]Massad R S, Loubet B, Tuzet A, et al. Relationship between ammonia stomata compensation point and nitrogen metabolism in arable crops: Current status of knowledge and potential modeling approaches [J]. Environmental Pollution, 2008, 154: 390-403.
[18]Mattsson M, Hausler R E, Leegood R C, et al. Leafatmosphere ammonia exchange in barley mutants with reduced activities of glutamine synthetase[J]. Plant Physiology, 1997, 114: 1307-1312.
[19]Mattsson M, Husted S, Schjoerring J K. Influence of nitrogen nutrition and metabolism on ammonia volatilization in plants[J]. Nutrient Cycling in Agroecosystems, 1998, 51:35-40.
[20]Miflin B J, Habash D Z. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen assimilation and possibilities for improvement in the nitrogen utilization of crops[J]. Journal of Experimental Botany, 2002, 53(370):979-987.
[21]Brugiere N, Dubois F, Limami A, et al. Glutamine synthetase in the phloem plays a major role in controlling proline production[J]. Plant Cell, 1999, 11: 1995-2011.
[22]刘丽, 甘志军, 王宪泽. 植物氮代谢硝酸还原酶水平调控机制的研究进展[J].西北植物学报, 2004, 24(7): 1355-1361.
[23]Norman R J, Guindo D, Wells B R, et al. Seasonal Accumulation and Partitioning of Nitrogen-15 in Rice [J].Soil Science Society of America Journal, 1992, 56 (5):1521-1527.
[24]Hortensteiner S, Feller U. Nitrogen metabolism and remobilization during senescence[J].Journal of Experimental Botany, 2002, 53: 927-937.
[25]Masclaux D C, Reisdorf C M, Pageau K, et al. Glutamine synthetase-glutamate synthase pathway and glutamate dehydrogenase play distinct roles in the sink-source nitrogen cycle in tobacco[J]. Plant Physiol, 2006, 140: 444–456.
[26]Mae T, Makino A, Ohira K. Changes in the amounts of ribulose biphosphate carboxylase synthesized and degraded during life span of rice leaf [J]. Plant and Cell Physiology,1983, 24: 1079-1086.
[27]Matile P. Chloroplast senescence In: Baker NR, Thomas H (Eds), Crop photosynthesis: spacial and temporal determinants[J]. Elsevier, Amsterdam, 1992, pp: 413-440.
[28]Sutton M A, Schjoerring J K, Wyers P. Plant-atmosphere exchange of ammonia[J]. Philosophical Transactions of the Royal Society of Landon Series A-mathemat, 1995, 351:261–278.
[29]Farquhar G D, Firth P M, Wetselaar R, et al. On the gaseous exchange of ammonia between leaves and the environment.Determination of the ammonia compensation point[J].Plant Physiology, 1980, 66: 710- 714.
[30]Frechilla S, Lasa B, Aleu M, et al. Short-term ammonium supply stimulates glutamate dehydrogenase activity and alternative pathway respiration in roots of pea plants[J].Journal of Plant Physiology, 2002, 159: 811-818.
[31]Mattsson M, Schjoerring J K. Senescence-induced changes in apoplastic and bulk tissue ammonia concentrations of ryegrass leaves[J]. New Phytologist 2003, 160 (11): 489-499.
[32]吴小庆, 徐阳春, 沈其荣. 植物叶片氨挥发研究进展[J].生态与农村环境学报2006, 22(2): 80-84.
Effect of nitrogen nutrition on nitrogen metabolism in ageing tobacco leaf and variation between varieties
WU Yunjie, LI Fei, YANG Tiezhao, ZHANG Xiaoquan
Collage of Tobacco, Henan Agricultural University, Zhengzhou 450002, China
Differences of nitrogen (N) metabolism under different nitrogen nutrition were investigated to select nitrogen-resistant tobacco varieties. Results showed that, compared with N efficient variety, N inefficient variety had large amount of soluble protein and total N degradation, low glutamine synthetase (GS) and nitrate reductase (NR) activity, high glutamate dehydrogenase (GDH) activity and ammonia compensation point. With the increase of N application, N inefficient variety displayed high percentage of nitrogen nutrient degradation,big decrease of GS activity, and increased GDH activity and ammonia volatilization potential. NC89 and Yuyan10 reached the largest N metabolism physical strength at the N application rate of 45.00 and 60.00 kg·hm-2and Yuyan10 showed less changes under different treatments as against NC89. It was concluded that varieties of different N efficiency on N assimilation and transfer ability were different for N inefficient and N efficient varieties, with the former boasting large re-assimilation rate, small amount of retransfer, wide scope of N application and strong adjustment ability. N metabolism was associated with tobacco leaf aging speed with GS for NH4+assimilation and apoplast for NH4+transfer playing the leading role.
flue-cured tobacco; nitrogen efficiency; nitrogen metabolism; nitrogen nutrition
10.3969/j.issn.1004-5708.2014.04.009
S572.01 文献标志码:A 文章编号:1004-5708(2014)04-0041-07
中国烟草总公司特色优质烟叶开发重大专项(Ts-01-2011003);中国烟草总公司项目(110201602008)
武云杰(1987—),在读博士研究生,研究方向为烟草遗传育种与品质改良,Email:wuyunjie6@163.com
杨铁钊(1956—),教授,研究方向为烟草遗传育种与品质改良,Tel:0371-63558030;Emal1:yangtiezhao@126.com
2013-03-14
