江苏人群MICA 基因多态性与乙型肝炎源性肝癌的相关性研究
2014-11-21苗祥宇徐丽刘红张硕伟吴情江苏省宿迁市人民医院感染科223800
苗祥宇,徐丽,刘红,张硕伟,吴情(江苏省宿迁市人民医院感染科 223800)
全球范围内原发性肝细胞癌(HCC)发病率位居恶性肿瘤第5位,约55%的病例发生在国内[1]。多项研究已证实慢性乙型肝炎病毒(HBV)感染是导致HCC 的重要原因之一,约有10%~25%HBV 感染患者最终发展为HCC[2]。在国内,90%以上HCC患者伴有HBV 感染[3]。近年来,越来越多的证据显示,单核苷酸多态性(SNP)与肿瘤的遗传易感性相关[4]。主要组织相容性复合体(MHC)-Ⅰ类链相关基因A(MICA)编码一种应激诱导性配体,主要与自然杀伤细胞(NK 细胞)活化型受体NKG2D 特异性结合,在NK 细胞活化和免疫监视中发挥作用。研究发现,MICA 多态性与恶性肿瘤、感染性疾病以及自身免疫性疾病等的易感性有密切关系。本研究旨在探讨MICA 基因多态性以及血清中可溶性MICA 抗原含量与乙型肝炎源性HCC的相关性。
1 资料与方法
1.1 一般资料将2009年9月至2013年6月本院收治并经病理确诊的HCC患者161例纳入患者组,所有患者均为首次发病入院,未经过放射、化学治疗的患者;其中男131例,女30例,患者年龄22~80岁,平均(47.2±12.5)岁;所有患者乙型肝炎表面抗原(HBsAg)均为阳性。将同期无血缘关系、在本院体检健康者162例纳入健康对照组,其中男130例,女32例;年龄24~74岁,平均(45.6±11.8)岁。两组受试者性别、年龄等一般资料比较,比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 基因组DNA 提取基因组DNA 提取采用Wizard基因组DNA 纯化试剂盒(美国Promega公司),操作严格按照说明书进行。分光光度计分析DNA 浓度和纯度,将浓度调整为50ng/μL。
1.2.2 基因分型运用聚合酶链式反应(PCR)产物直接测序法对MICA 基因多态性位点rs2596542进行基因分型。引物序列为:上游5′-TCG TCT CCC AAA GAA CAG CTA C-3′,下游5′-CCA GTC TCT GGA GTC ACT GTC-3′。PCR 总反应体系为25μL,含DNA 模板1μL,2×PCR mix 12.5μL,上、下游引物各1μL,DNA 聚合酶0.5μL,去离子水9μL。PCR 预变性94℃5min,变性94℃30s、退火60℃30s、延伸72℃30s,35个循环,72℃延伸7min。PCR 扩增产物片段为492bp。
1.2.3 血清MICA 水平检测采用酶联免疫吸附法(ELISA)、人MICA 检测试剂盒(美国Sigma-Ald rich公司),操作按照说明书进行操作。所有样品均设3个复孔,设置酶标仪波长450nm,读取吸光度值,根据MICA 标准品检测结果绘制标准曲线,计算样品浓度。
1.3 统计学处理采用SPSS13.0软件对数据进行处理及统计学分析,计量资料采用表示,组间比较采用t检验;计数资料采用百分率表示,组间比较采用卡方检验。Logistic回归分析法计算比值比(OR)及95%置信区间(95%CI),以α=0.05为检验水准,P<0.05为比较差异有统计学意义。
2 结果
2.1 既往史与家族史比较患者组中有吸烟史、饮酒史、HCC家族史者明显高于健康对照组,差异有统计学意义(P<0.05),见表1。
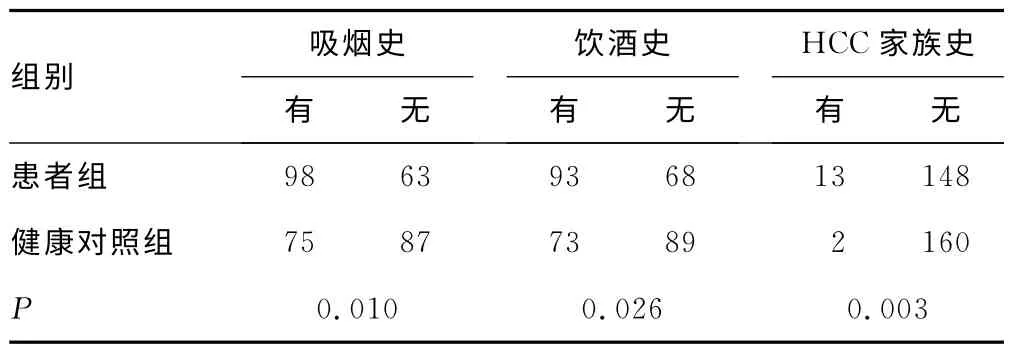
表1 患者组和健康对照组的既往史与家族史比较(n)
2.2 MICA 基因多态性与HCC风险经Hardy-Weinberg平衡检验,健康对照组和患者组MICA 基因位点rs2596542基因型实际值与预测值比较,均符合Hardy-Weinberg 平衡(χ2=2.344,P=0.125和χ2=3.420,P=0.064)。患者组中GG 基因型的分布频率为23.6%,明显高于健康对照组的16.0%,比较差异有统计学意义(P<0.05),见表2。进一步分析发现,GG 基因型携带者HCC 发病风险是AA 基因型携带者的1.860倍(OR=1.860,95%CI:1.009~3.428)。携带G 等位基因者HCC 发病风险高于A 等位基因携带者(OR=1.412,95%CI:1.030~1.936)。
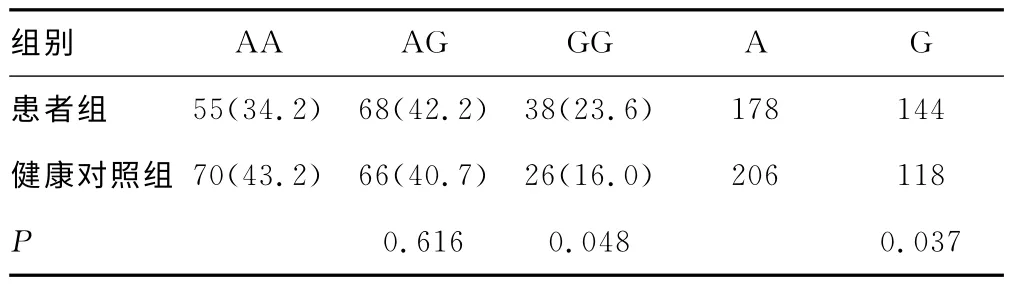
表2 rs2596542基因型在患者组与健康对照组的分布[n(%)或n]
2.3 MICA 基因多态性与血清MICA 水平本研究采用ELISA 方法对HCC患者和健康体检者血清MICA 水平进行检测,发现患者组MICA 水平为(55.1±21.3)pg/mL,明显高于健康对照组的(9.7±4.3)pg/mL,比较差异有统计学意义(P<0.05)。进一步分析MICA 基因多态性与血清MICA 水平的关系,结果显示,GG 基因型患者血清MICA 水平为(89.1±41.7)pg/mL,明显高于AA 基因型的(18.2±9.5)pg/mL和AG 基因型的(35.8±17.4)pg/mL,比较差异有统计学意义(P<0.05)。
3 讨论
MICA 基因是MIC基因家族的成员之一。MICA 是功能基因,在人体正常组织细胞表达量极低[5]。研究发现,MICA基因在大多数上皮来源的原发性肿瘤,如肝癌、肺癌、乳腺癌、前列腺癌等细胞上表达,被认为与恶性转化有关[6]。NK 细胞活化受体NKG2D 可以识别表达在肿瘤细胞表面的MICA/B。这些识别无须抗原处理和递呈,并且无MHC 限制性。MICA/B与NKG2D 结合刺激NK 细胞的活化。膜MICA 可上调效应细胞NKG2D 的表达,而膜MICA 可被基质金属蛋白酶水解释放入血液。可溶性MICA 的释放不仅降低肿瘤细胞表面MICA 的表达,降低肿瘤的免疫原性,也能影响免疫效应细胞表面NKG2D 的表达,进而影响NK 细胞和细胞毒性T 淋巴细胞(CTL细胞)抗肿瘤效应的发挥。张彩等[7]的研究也表明,可溶性MICA 通过降低NKG2D 的表达下调机体的抗肿瘤免疫效应。上述研究表明,NKG2D-MICA 的相互作用可有效调节NK 细胞和CTL细胞的杀肿瘤作用。本研究发现,乙型肝炎源性HCC 患者血清MICA 水平明显高于健康对照组(P<0.05),说明可溶性MICA 在肝癌发生中发挥重要作用,这种作用与肿瘤免疫逃逸作用机制有关。
人类MHC基因域位于6号染色体短臂,共含有224个基因座,包含MIC家族7个成员的编码基因,其中MICA 位于经典MHC-Ⅰ类基因域着丝粒的末端,具有6个外显子,由5个内含子隔开[8]。Kumar等[9]发现MICA 上游4.7kb的变异位点与丙型肝炎病毒引起的HCC 相关。Paulisally等[10]研究了MICA 基因多态性与丙型肝炎源性肝癌的关系,发现SNP rs2596538与丙型肝炎源性肝癌易感性相关。有研究发现,另一个MICA SNP位点rs2596542与乙型肝炎源性HCC 易感性相关,G 等位基因携带者HCC发病风险明显大于A 等位基因携带者[11]。本研究结果与Kumar等[9]的研究类似,GG 基因型携带者比AA 基因型携带者乙型肝炎源性HCC发病风险高;或至少携带1个G 等位基因者比携带A 等位基因者更易患乙型肝炎源性HCC。SNP rs2596538G 等位基因携带者血清MICA 水平高于A 等位基因携带者,rs2596542G 等位基因携带者高于A 等位基因的携带者。本研究也发现,GG 基因型HCC患者血清MICA 水平明显高于AA 基因型和AG 基因型患者(P<0.05)。回归分析结果显示,GG 基因型携带者比AA 基因型携带者乙型肝炎源性HCC发病风险要高。上述研究结果表明,MICA 基因多态性可能通过提高可溶性MICA 水平,从而影响HCC易感性。
综上所述,随着分子生物学、细胞生物学和人类基因组学、蛋白质组学等基础学科向癌症研究领域的延伸,HCC 分子诊断方法取得了长足的进展[12]。MICA 基因多态性和血清MICA 有可能成为乙型肝炎源性HCC 的生物学标记。其在临床诊断中的作用有待进一步研究。
[1]覃彦平,秦雪.白介素-23R基因多态性与肝癌易感性研究[J].重庆医学,2012,41(30):3138-3141.
[2]Coffin CS,Fung SK,Ma MM.MaManagement of chronic hepatitis B:Canadian Association for the Study of the Liver consensus guidelines[J].J Hepatol,2000,32(Suppl 1):89-97.
[3]Thakur V,Guptan RC,Kazim SN,et al.Profile,spectrum and significance of HBV genotypes in chronic liver disease patients in the Indian subcontinent[J].J Gastroenterol Hepatol,2002,17(2):165-170.
[4]Akkiz H,Bayram S,Bekar A,et al.Relationship between functional polymorphism in the Aurora A gene and susceptibility of hepatocellular carcinoma[J].J Viral Hepati,2010,17(9):668-674.
[5]Bahram S,Bresnahan M,Geraghty DE,et al.A second lineage of mammalian major histocompatibility complex classⅠgenes[J].Proc Natl Acad Sci USA,1994,91(14):6259-6263.
[6]丁军颖,王润田.人MICA 基因多态性和表达特性与肿瘤的关系[J].现代免疫学,2007,27(2):165-168.
[7]张彩,冯进波,王郡甫,等.膜型分泌型MICA 对NK 细胞受体NKG2D 的相反调节效应及其对NK 细胞受体谱的影响[J].中华微生物学和免疫学杂志,2004,24(2):107-111.
[8]Shiina T,Tamiya G,Oka A,et al.Molecular dynamics of MHC genesis unraveled by sequence analysis of the 1,796,938-bp HLA classⅠregion[J].Proc Natl Acad Sci USA,1999,96(23):13282-13287.
[9]Kumar V,Kato N,Urabe Y,et al.Genome-wideassociation study identifies a susceptibility locus for HCV-induced hepatocellular carcinoma[J].Nat Genet,2011,43(5):455-458.
[10]Paulisally Hau Yi Lo,Yuji Urabe,Vinod Kumar,et al.Identification of a functional variant in the MICA promoter which regulates MICA expression and increases HCV-related hepatocellular carcinoma risk[J].PloS one,2013,8(4):61279.
[11]Kumar V,Yi Lo PH,Sawai H,et al.Soluble MICA and a MICA variation as possible prognostic biomarkers for HBV-induced hepatocellular carcinoma[J].PloS one,2012,7(9):44743.
[12]董良仓,柴丽.原发性肝癌的分子诊断[J].中国医学检验杂志,2011,12(3):134-135.
