提取方法对仙茅多糖提取率及抗肿瘤活性的影响
2014-11-04唐健波
彭 梅,唐健波,肖 雄,杨 娟
(贵州省中国科学院天然产物化学重点实验室,贵州贵阳 55002)
仙茅为仙茅属植物仙茅Curculigo orchioides Gaertn.的干燥根状茎。具温肾阳、壮筋骨、治阳痿精冷等功效[1],有很好调节免疫功能的作用[2]。本课题组前期工作中发现仙茅中富含多糖,且仙茅多糖有良好的抗肿瘤功效[3],有很好的开发利用前景。目前,有关仙茅多糖的研究较少,提取工艺对其提取率及抗肿瘤活性的影响未见文献报道。本实验利用均匀设计方法,该方法具有试验点分布均匀[4-5],特别适合多因素、多水平的实验,其实验次数比正交设计明显减少[6-7],对热水浸提和超声波辅助提取仙茅多糖工艺参数进行优化,比较两种提取方法对仙茅多糖提取率的影响;同时比较最佳工艺条件下提取的仙茅多糖抗肿瘤活性,旨在为仙茅多糖的开发利用提供理论依据。
1 材料与试药
1.1 仪器 JA-2003精密电子天平 (上海恒平科技有限公司);R220型旋转蒸发器 (瑞士Buchi公司);HP-8453紫外可见分光光度计 (美国HP公司);SB25-12DTD型超声波 (宁波新芝生物科技有限公司),恒温水浴锅。
1.2 材料与试药 仙茅药材于2012年9月购自贵阳市万东桥药材市场,经贵阳中医学院孙庆文副教授鉴定为仙茅Curculigo Orchioides Gaertn的根。S180腹水瘤为贵州大学杨再昌教授惠赠,环磷酰胺粉针剂 (江苏恒瑞医药股份有限公司),羧甲基纤维素钠 (郑州顺达化工有限公司)。
2 方法与结果
2.1 实验方法与设计
2.1.1 原料预处理 将新鲜仙茅根块切碎晒干,适当粉碎后用75%~80%的乙醇回流提取6次,以除去脂溶性成分及单糖、低聚糖,乙醇提取后的残渣经风干后得脱脂的仙茅根干粉,保存备用。
2.1.2 热水浸提工艺设计 称取脱脂处理的仙茅干粉5 g,加入蒸馏水后水浴加热提取一定时间。提取液抽滤,收集滤液,残渣按上述方法重复提取2次。滤液合并,减压浓缩至一定体积后,加入食用酒精沉淀 (酒精最终体积分数不低于80%)。抽滤,沉淀物分别用90%酒精和丙酮洗涤,真空干燥后即为粗多糖。
选取提取时间、提取温度、液料比为多糖提取率的影响因素,按(5×5×5)均匀设计表安排实验 (表1)。
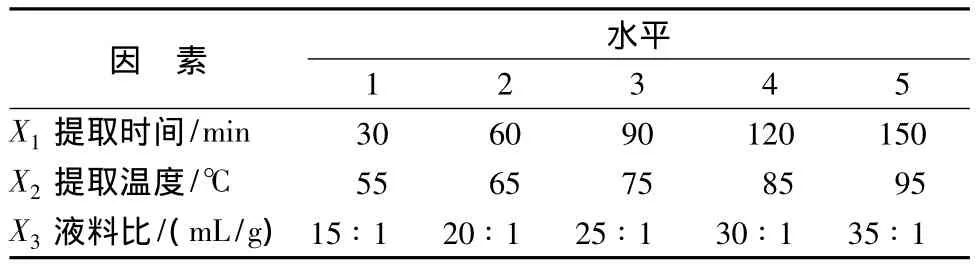
表1 热水浸提试验因素水平
2.1.3 超声波辅助提取工艺 称取脱脂处理的仙茅干粉5 g,加入蒸馏水后置于超声波中提取。提取液抽滤,收集滤液,残渣按上述方法再重复提取1次。合并滤液,减压浓缩至一定体积后,加入食用酒精沉淀 (酒精最终体积分数不低于80%)。抽滤,沉淀物分别用90%酒精和丙酮洗涤,真空干燥后即为粗多糖。
实验选取时间、提取温度、液料比、超声波功率为多糖提取率的影响因素,按(6×6×6×6)均匀设计表安排实验,见表2。
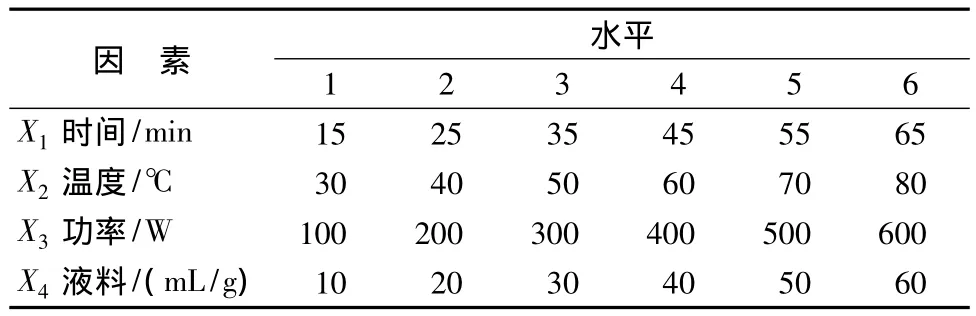
表2 超声波提取试验因素水平
2.1.4 多糖提取率计算 用葡萄糖做标准曲线,硫酸-苯酚法测定多糖的量[8]计算仙茅多糖提取率。

2.1.5 多糖抗肿瘤试验 将热水浸提法和超声波辅助提取法最佳工艺条件下制备的仙茅多糖进行抗肿瘤活性试验。将96只昆明种小鼠适应性饲养3 d后,每只小鼠接种0.2 mL S180腹水液于右腋下,按体质量随机分为8个组,每组12只,雌雄各半。分别为空白组、超声波提取仙茅多糖低(100 mg/kg)、中 (200 mg/kg)、高 (400 mg/kg)剂量组;热水浸提仙茅多糖低 (100 mg/kg)、中 (200 mg/kg)、高(400 mg/kg)剂量组及阳性对照环磷酰胺组 (100 mg/kg)。仙茅多糖用0.5%的CMC-Na配制成上述给药剂量,按体质量 (0.1 mL/10 g)每天灌胃给予小鼠多糖 (灌胃前小鼠空腹1 h,不禁水);空白组及阳性对照组给予等体积生理盐水,阳性对照组采用一次最大剂量法,即在接种肿瘤后次日每只小鼠注射0.1 mL环磷酰胺 (100 mg/kg)后不再给药[9]。给药期间小鼠自由饮水、进食,自然光照,饲养环境温度 (18±2)℃,湿度为 (50±5)%。小鼠连续给药10 d后处死,取出胸腺、脾脏及肿瘤,并以胸腺、脾脏指数及抑瘤率为指标,考察多糖的抗肿瘤活性。

2.1.6 数据处理 采用DPS v7.50版数据处理系统对提取工艺结果进行二次多项式回归分析;SPSS 17.0对抗肿瘤试验数据进行分析。
2.2 实验结果
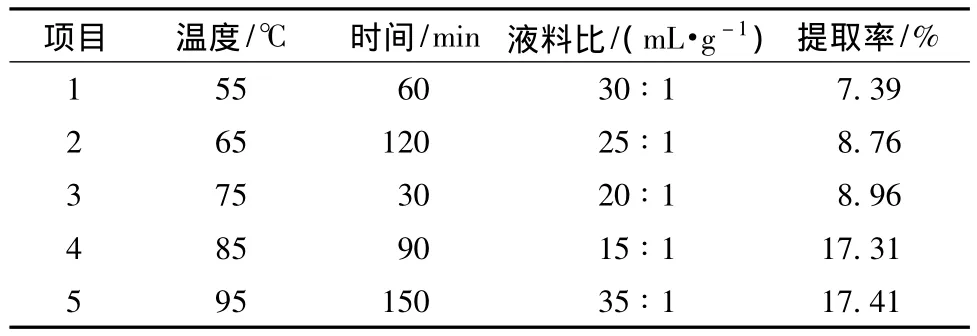
表3 均匀设计法热水浸提仙茅多糖试验的安排及结果

表4 均匀设计法超声波提取仙茅多糖试验安排及结果
2.2.3 两种提取方法制备的多糖对S180实体瘤小鼠的抗肿瘤作用 将两种提取方法最佳工艺条件下制备的仙茅多糖进行抗肿瘤活性比较。以空白组为阴性对照,环磷酰胺为阳性对照,以小鼠抑瘤率为考察指标,结果如表5所示。当抑瘤率达到40%以上,说明药物具有一定的抗肿瘤作用[10],从表5中可以看出,两种提取方法制备的多糖给药组,除超声波提取的高剂量组外,其余各组抑瘤率均大于40%,具有抗肿瘤作用。超声波提取的仙茅多糖随剂量的增加,抑瘤率反而下降;热水浸提的仙茅多糖随剂量的增加抑瘤率增加,且高剂量组达到64.50%,具有较好的抗肿瘤作用。除超声波提取低剂量组外,在同等剂量下,热水浸提的仙茅多糖的抑瘤率显著优于超声波提取的抑瘤率。
表5 两种方法提取的多糖抗肿瘤作用 (,n=12)

表5 两种方法提取的多糖抗肿瘤作用 (,n=12)
组 别 剂量/(mg·kg-1) 抑瘤率/%空白组 - -阳性对照组 100 86.54超声提取低剂量 100 51.11超声提取中剂量 200 42.21超声提取高剂量 400 31.43热水浸提低剂量 100 42.79热水浸提中剂量 200 51.83热水浸提高剂量400 64.50
3 小结与讨论
本实验利用均匀设计通过提高试验点“均匀分散”的程度,使试验点具有更好的代表性及能用较少的试验获得较多信息的优点[11],分别对热水浸提法和超声波辅助提取法提取仙茅多糖的工艺条件进行优化,比较两种方法对多糖提取率和抗肿瘤活性的影响。结果显示,热水浸提提取时间长、消耗能量较多,但热水浸提具有提取温和,不易破坏多糖的结构特点;超声波作为一种新型的提取手段,应用机械效应、热学效应、湍流效应等能提高提取率、省时省能量,但有报道超声波辅助提取会使多糖的结构被破坏[12-13]。同时超声波具有较强的机械剪切作用,长时间作用也会使杂质溶出[14]。本实验中超声波辅助提取的仙茅多糖抗肿瘤活性随着剂量增加,抑瘤率反而降低,推测可能是因为超声波破坏了仙茅多糖的结构,使抗肿瘤活性下降,其具体的机制有待进一步研究。
[1]曹大鹏.仙茅抗骨质疏松化学成分及品质评价研究[D].长春:吉林农业大学,2008.
[2]周 勇,张 丽,赵离原,等.仙茅多糖对小鼠免疫功能调节作用实验研究[J].上海免疫学杂志,1996,16(6):336-338.
[3]彭 梅,张振东,杨 娟,等.14种多糖对小鼠S180肉瘤抑制活性筛选[J].山地农业生物学报,2011,30(1):56-59.
[4]Kshirsagarac,Singhal R S.Optimization of starch oleate derivatives from nativecorn and hydrolyzed corn starch by responsesurface methodology[J].Carbohydrate Polymers,2007,69(3):455-461.
[5]Li Weihong,Liu Lijuan,Gong Weiguo.Uniform design and its applications in chemistry and chemical engineering[J].Expert Syst App,2010,38(6):6689-6695.
[6]贾邵千,吴彩娥,范龚健,等.均匀设计优化碱法提取银杏蛋白工艺[J].食品科学,2011,10(32):18-20.
[7]陈丹红.均匀设计优化鸡腿菇多糖提取工艺的研究.[J].食品科技,2011,36(2):154-156.
[8]张惟杰.复合多糖生化研究[M].上海:科学技术出版社,1987:6.
[9]陈 奇.中国药学研究方法[M].2版,北京:人民卫生出版社,2006.
[10]陈 奇.中药药效研究思路与方法[M].北京:人民卫生出版社,2005.
[11]芦 鑫,张 晖,姚惠源.不同提取方法对粳米淀粉结构的影响[J].食品科学,2009,29(1):102-106.
[12]严碧歌,赵 凯,杜 柯.超声波提取对麦冬多糖结构和抗氧化活性的影响[J].压电与光,2011,33(6):859-862.
[13]罗巅辉.均匀设计法优化超声波提取牛蒡多糖工艺的研究[J].河南师范大学学报:自然科学版,2008,36(1):115-117.
[14]王 博.超声萃取对茯苓菌核多糖提取率及结构影响的研究[D].陕西:陕西师范大学,2008.
