细胞膜相联钙结合蛋白的结构和功能研究进展
2014-10-27何伟王斐闫海芳
何伟,王斐,闫海芳
东北林业大学 生命科学学院,黑龙江 哈尔滨 150040
植物细胞中存在多种多样的Ca2+信号,Ca2+信号几乎介导了植物生长发育中的所有过程,包括种子萌发、植株生长、开花、结实、衰老、死亡及对环境的适应。Ca2+结合蛋白是Ca2+信号的受体,包括钙调素蛋白(calmodulin,CaM)、Ca2+依赖蛋白激酶(Ca2+-de⁃pendent protein kinases,CDPK)和膜联蛋白,它们各自定位于特定的细胞器中,通过与配体蛋白结合而改变Ca2+浓度来传输信号[1]。磷脂酰肌醇3-磷酸(phosphatidylinositol 3-phosphate,PtdInsP)也是主要的胞内信号通路的组件,是细胞众多生命活动不可缺少的辅助因子,各种蛋白质通过与PtdInsP作用来实现它们的生理作用[2]。PtdInsP信号能够通过调控许多离子通道开关来调节下游信号,控制植物的生长发育[3],如网格蛋白依赖性的胞吐作用、非网格蛋白依赖性的胞吐、Ca2+依赖的神经递质和激素的分泌作用、细胞骨架肌动蛋白的重排、细胞迁移和整联蛋白介导的细胞基质黏附作用等[4]。
细胞膜相联钙结合蛋白(plasma-membrane as⁃sociated cation-binding protein,PCaP)是一类新的钙离子结合蛋白,目前在拟南芥中已发现了2个,命名为AtPCaP1和AtPCaP2(简称为PCaP1和PCaP2),它们以独特的N端十四(烷)酰化(N-myristoylation)稳定地结合在细胞膜上[5-6]。PCaP能与Ca2+/CaM复合体和PtdInsP结合,调节Ca2+和PtdInsP信号通路,参与调控植物的生长发育。
微管(microtubule,MT)是由α-、β-微管蛋白异二聚体通过非共价键形成的管状结构。它与微丝、中间纤维共同构成真核生物的细胞骨架。微管在植物生长发育中起重要作用,如维持细胞形态与结构、参与胞质流动、调节细胞有丝分裂、控制细胞极性生长、细胞壁构建、细胞分化调控、信号转导等[7]。微管结合蛋白是指可以直接与微管结合,对微管具有调控作用的一类蛋白[8],它们在植物细胞的形态、分化和植物的生长、发育、适应逆境等生理过程中起作用。PCaP是一类微管结合蛋白,并属于微管去稳定因子。微管去稳定因子对微管的调控主要是改变微管端部结构使微管去稳定,或者直接将微管切割成较小的片端而使微管去稳定[7]。
迄今,对PCaP的研究主要集中在其调节Ca2+/PtdInsP信号通路、调控微管去稳定等方面,这些研究揭示了PCaP在植物顶端生长极性中的调控作用[9-13]。我们主要介绍近年来对PCaP蛋白结构与功能,及其调控植物顶端生长极性的研究进展。
1 PCaP的发现
Ide等于2007年在拟南芥中发现了一个新的定位于细胞膜上的Ca2+结合蛋白,命名为PCaP1。它富含谷氨酸、赖氨酸残基,能在高浓度Mg2+的存在下结合45Ca2+,在细胞内Ca2+信号通路中起重要作用。PCaP1在大多数植株器官中表达,Cu2+、山梨糖醇、鞭毛蛋白寡肽的处理能增强其转录水平[14-15]。自然条件下PCaP1能与细胞膜结合,并在高浓度Ca2+或Mg2+条件下从膜上脱离进入细胞质中[5]。PCaP1还能与微管结合而抑制微管蛋白的装配并解聚微管蛋白,所以也被称为微管去稳定蛋白25(microtubule-de⁃stabilizing protein 25,MDP25),其破坏微管稳定的能力受Ca2+浓度调控。PCaP1参与许多植物生长发育过程,如在下胚轴细胞伸长中具有负调节作用[10]。
2010年,Kato等在拟南芥中又发现了PCaP2。它具有结合并解聚微管的能力,在之前的研究中也被称为微管结合蛋白18(miscotube associated pro⁃tein 18,MAP18)[9]。PCaP2定位于细胞膜上,并在根毛和延伸花粉管的表皮细胞中特异表达。该蛋白富含脯氨酸、谷氨酸、缬氨酸和赖氨酸残基(PEVK-rich域),在 Mg2+、K+存在下能与 Ca2+结合。用 K+、Mn2+、Zn2+、Na+、脱落酸(ABA)和赤霉酸处理,或者寒冷和干旱胁迫均能提高其转录水平[6]。PCaP2的细胞膜定位也与Ca2+水平有关,并且Ca2+浓度上升能促进微管解聚[9]。据报道,MAP18参与ABA对拟南芥花粉萌发的调控[16],能够通过抑制肌动蛋白(微丝)的组装来调节花粉管的极性生长方向[13],同时在根毛的发育中起重要作用[13]。
2 PCaP的结构特点
2.1 PCaP的序列特点
PCaP1和PCaP2分别包含225和168个氨基酸残基,相对分子质量分别为25×103和18.5×103。蛋白序列分析表明PCaP1和PCaP2没有已知的功能性酶基序及跨膜结构域,它们是细胞膜上的非酶性的蛋白质[6]。如图1,2个蛋白质只有28%的序列相同,但都有相似的由23个氨基酸残基构成的N端域(N23域),并在中央和C端区域(CC域)存在PEVK-rich域。N23域是细胞膜结合区域,并具有结合Ca2+和PtdInsP的能力,而CC域存在大量V-V-E-K-KN/E-E的不完全特征重复序列,这些重复序列是与微管结合的区域[12]。
2.2 N23域的结构与功能
2.2.1 N23域的二位甘氨酸十四(烷)酰化与细胞膜稳定结合 PCaP可以稳定地结合在细胞膜上,在NaCl、尿素、Na2CO3处理下也不会从膜上脱离。2种蛋白都有相同的酰基化潜在序列MET-GLY-X-XX-SER-LYS。用网络程序 ScanProsite(http://kr.ex⁃pasy.org/tools/scanprosite/)分析发现,PCaP1具有2个可能的十四(烷)酰化位点分别为N端(图2)和内部第77~82氨基酸残基[14]。后续研究发现,在第2个氨基酸位点用丙氨酸代替甘氨酸会导致PCaP在细胞质中分布,这表明PCaP是在二位的Gly位点发生十四(烷)酰化,并通过十四(烷)酰化部分与细胞膜稳定结合的[17]。
2.2.2 N23域特异结合PtdInsP、Ca2+/CaM复合体
PCaP最重要的生理性质是与PtdInsP结合的能力。植物细胞中的PtdInsP2是PCaP的合适配体,包括Pt⁃dIns(3,4)P2、PtdIns(3,5)P2、PtdIns(4,5)P2[18]。许多蛋白质的细胞膜定位和其与PtdInsP结合相关[19]。研究发现,N端部分23个残基对PCaP1与PtdInsP的结合作用至关重要,因为缺失这部分的PCaP1突变体完全没有结合PtdInsP的能力[5]。PCaP2的N23域与PCaP1的非常相似(23个残基中有18个相同)。PCaP是通过N23域与PtdInsP相互作用的,同时N23域与PtdInsP的结合还决定细胞膜定位。

图1 PCaP全长结构图
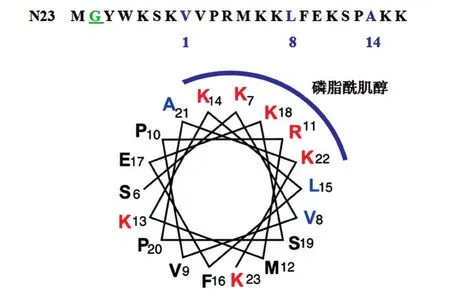
图2 PCaP2的N端域螺旋结构模型
N23域还能与另一种配体Ca2+/CaM复合体特异结合,但N23域并不能与自由的CaM结合。PCaP与Ca2+/CaM复合体结合会改变本身结构,导致PtdInsP从PCaP上解离[17]。由于N23域不能与自由CaM结合,PCaP和PtdInsP的结合能力与Ca2+浓度密切相关。静止水平细胞内Ca2+浓度较低,不能形成Ca2+/CaM复合体,PCaP与PtdInsP稳定结合。而当Ca2+浓度增高时,大量Ca2+/CaM形成,竞争性地结合PCaP。PCaP和PtdInsP、Ca2+/CaM复合体竞争性结合是细胞Ca2+/PtdInsP信号转导通路的重要机制[12]。
2.2.3 N23域的螺旋结构模型 PCaP的N23域决定细胞膜定位,并且能与Ca2+和PtdInsP相互结合,这与其结构密切相关。如图2所示,N23域的第2个氨基酸残基是细胞膜结合位点。PCaP2的N23域蛋白螺旋模型中5个正电荷残基(Lys7、Arg11、Lys14、Lys18和Lys22)位于模型的同一表面,它们通过静电作用与带负电荷的PtdInsP在其肌醇环结合;而中性残基Val8、Leu15和Ala21以α-螺旋结构构成1-8-14基序,是Ca2+/CaM结合位点[20]。N23域在与Ca2+/CaM结合后改变PCaP的三级结构[21],从而改变其与PtdInsP的结合能力,这种竞争是Ca2+/PtdInsP之间的信号通路转导的关键机制[12]。
2.3 CC域的结构与功能
2.3.1 CC域的无序区结合自由Ca2+PCaP的CC域含PEVK-rich域。值得注意的是,PCaP1的CC区中存在内在无序区域[5]。内在无序(ID)蛋白定义为拥有超过50个内在无序或没有折叠结构的氨基酸残基序列的蛋白。大多数ID蛋白质富含谷氨酸、赖氨酸、脯氨酸、丝氨酸或谷氨酰胺残基[22]。ID蛋白或ID域具有一个灵活结构,能与配体或伴侣蛋白没有结构障碍地结合。ID区赋予了CC区与多种蛋白及配体相互结合的能力,例如PCaP的CC区可以结合大量的Ca2+[23]。ID蛋白和配体结合能使其转变为高度有序的结构,这种结合后结构的改变可以维持ID蛋白的功能[21]。
2.3.2 CC域结合微管微丝 PCaP具有结合并调节微管微丝的能力,这种能力与其CC域的PEVK-rich域和V-E-E-K-K域密切相关。PCaP的CC域富含富含脯氨酸、谷氨酸、缬氨酸和赖氨酸残基,与肌联蛋白的PEVK域非常相似,PEVK域能够结合肌动蛋白[24]。并且CC域存在大量V-E-E-K-K序列重复,V-E-E-K-K域是与微管结合的一个重要功能域[9]。PCaP的CC域能够调控植物的生长极性,这与其调节微管微丝的能力有关。
3 PCaP调节Ca2+和PtdInsP信号通路的分子机制
植物细胞中,PtdInsP组成总膜脂质的一小部分。在细胞膜上,PCaP1蛋白的量与PtdInsP2蛋白量是平衡的。PCaP和PtdInsP、Ca2+/CaM复合体竞争性地结合,是细胞Ca2+/PtdInsP信号转导通路的重要机制,在植物生长发育中发挥重要作用。
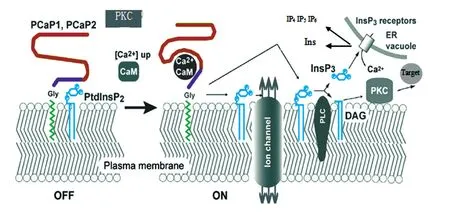
图3 PCaP调节的Ca2+信号通路模型
Kato等提出一个PCaP调节PtdInsP和CaM介导的Ca2+信号通路的模型[17]。如图3,在静止期,细胞质Ca2+浓度较低,细胞膜上PCaP结合在PtdInsP肌醇环的磷酸根上;当胞质Ca2+浓度增高时,Ca2+形成大量Ca2+/CaM复合体,促使PtdInsP2与PCaP解离,释放的自由PtdInsP2能够促进膜运输,并可调节细胞膜上特定的离子通道和蛋白泵的开关[25]。细胞膜上自由的PtdInsP2能与蛋白激酶C(PKC)相互作用,并影响PKC在细胞膜上的分布[26]。PtdInsP2通过磷脂酶C(PLC)水解产生1,4,5-磷酸化肌醇(InsP3)和甘油二酯(DAG)第二信使分子。InsP3受体导致Ca2+通道激活,促进Ca2+从内质网(ER)和液泡中释放。之后,InsP3通过2条代谢途径:一是被去磷酸化迅速失活转变为肌醇二酯(IP2),再被脱去一个磷酸基并与6-磷酸葡萄糖结合形成肌醇磷酸(InsP),其进一步脱磷酸形成自由肌醇(Ins);InsP3失活的另一条途径就是被进一步磷酸化生成 InsP4、InsP5、InsP6等多磷酸肌醇。甘油二酯可以作为信号介导分子,它激活PKC结合Ca2+。激活的PKC能磷酸化特定的目标蛋白分子,从而激活下游信号,调节和控制植物一系列生理过程。
4 微管去稳定因子调节微管稳定性
微管具有聚合和解聚的动力学特性,MAP通过控制微管的聚合和解聚来调节其稳定性[27]。微管去稳定因子属于MAP,动物中有多个微管去稳定因子,如剑蛋白(katanin)、Op18和MACK/KinI kinesin蛋白家族。这些蛋白对微管的调控主要是改变微管端部结构使微管去稳定,或直接将微管切割成较小的片端而使微管去稳定。植物微管去稳定因子目前发现了2类,拟南芥中剑蛋白的同源蛋白[8]和PCaP。
4.1 AtKTN1切割微管
剑蛋白是最初在动物中发现的一种能够切割微管的蛋白。Burk等从拟南芥基因组中克隆到一个基因,其编码的蛋白被命名为AtKTN1,与动物中的剑蛋白p60亚基同源。拟南芥野生型植株G1期细胞中的微管从细胞核上脱离并迅速解聚,而在AtKTN1缺失突变体的G1期细胞中,微管从细胞核上脱离后可以存在很长时间[28]。进一步研究发现,该蛋白在体外能够与微管结合,在ATP存在的条件下能够切割微管。在体内,AtKTN1具有切割微管的作用,使微管去稳定。另外,AtKTN1在体内能够影响细胞壁物质的合成,并在许多植物生长发育的过程中起作用,如细胞极性生长、激素的信号传递和根毛的发育等。AtKTN1是植物中发现的第一个使微管片段化的蛋白。
4.2 PCaP破坏微管端部稳定
拟南芥PCaP是一类微管去稳定因子,它能解聚微管并抑制微管蛋白聚合。PCaP在微管上呈点状分布,说明PCaP可能只与微管的某些部位结合。PCaP表达主要在扩增的细胞中,并且浓度越高,抑制微管聚合的作用越明显。Li等研究发现,PCaP过表达的纯合转基因植株中的微管比野生型微管不稳定,并且大部分细胞的形态均发生异常,如子叶的砌砖式细胞、根表皮细胞、下胚轴表皮细胞和皮层细胞。这些细胞形态的改变都与细胞生长极性相关。研究发现,PCaP过表达和通过RNAi下调表达的细胞中微管结构都发生显著改变。当PCaP过表达时,微管对微管破坏药物更敏感;而当PCaP下调表达时,对微管破坏药物有抵抗性[9]。
虽然PCaP过表达突变体中细胞内微管遭到破坏,但细胞的微管密度没有明显减少,这是因为PCaP并不像剑蛋白会切割微管。它诱导的微管解聚作用发生在微管两端,并且微管的正负两端具有相似解聚速率,这样只会导致微管的长度不均匀[10]。
4.3 Ca2+对PCaP破坏微管能力的影响
许多微管结合蛋白的活性是依赖Ca2+浓度的,它们在调节微管动力学上起重要作用[11]。PCaP能结合微管抑制微管蛋白的装配,并且解聚微管,其解聚能力与Ca2+浓度密切相关。研究发现,在缺乏Ca2+时,PCaP1的浓度增加并不影响微管蛋白解聚;而存在Ca2+时,PCaP1的浓度增加会影响上清液微管蛋白的数量。这表明,Ca2+浓度除了调节PCaP的细胞定位,还能大大提高PCaP破坏微管蛋白的能力[10]。
5 PCaP在植物生长发育中的功能
在植物中,Ca2+、PtdInsP是主要的胞内信号通路的组件,这些信号分子参与植物细胞的多种生理过程。作为Ca2+/PtdInsP信号通路的调控蛋白,PCaP在植物生长发育中起重要作用,并且PCaP通过调节微管的组装方式,在植物顶端生长极性中起重要的调控作用。
5.1 PCaP1抑制下胚轴细胞伸长
下胚轴伸长的调控对植物生长和发育至关重要。下胚轴细胞的伸长受到内部和外部信号影响:光、植物激素、转录因子、微管细胞骨架对下胚轴细胞伸长具有调控作用[10]。微管在细胞伸长中起着至关重要的作用。微管结合蛋白能够调控微管稳定、组装和动力学。微管的组装方式及稳定与下胚轴细胞伸长相关,研究表明,破坏微管稳定可能导致对下胚轴细胞伸长的抑制作用[28]。微管调节蛋白通过调节微管的稳定性来调控下胚轴伸长,PCaP1可以通过破坏微管的稳定性来抑制下胚轴伸长。研究发现,过表达PCaP1的植株下胚轴异常短小并且微管遭到破坏,这表明PCaP1通过破坏微管稳定,在下胚轴细胞伸长中起着关键的负调节作用。
5.2 PCaP2在叶片衰老过程中破坏微管蛋白
叶片的衰老伴随着微管蛋白网络的降解,PCaP2在微管蛋白网络降解中起重要作用。衰老叶片中PCaP2的表达大量增加,说明PCaP2在衰老过程中微管蛋白降解中可能发挥重要的生理作用[29]。研究发现,编码PCaP2的基因在自然衰老和黑暗诱导衰老的叶片中都被大量诱导表达,但黑暗诱导衰老的叶片中微管并没有被破坏,表明PCaP2的大量表达并不足以诱导微管的解聚,它更可能是Ca2+依赖的信号机制的一部分。该结论已被其他研究者证实,PCaP2破坏微管的能力是受Ca2+浓度调控的[13]。
5.3 PCaP2对根毛及花粉管顶端生长极性的影响
PCaP2主要表达在根毛和延伸花粉管的顶端生长细胞中,它对根毛及花粉管的极性生长发育有重要作用。在花粉管和根毛中存在Ca2+浓度梯度,Ca2+信号在这些组织顶端极性生长中起重要作用[30-31]。PtdIns(4,5)P2能调节细胞骨架组织、气孔开放和膜运输[18],在植物组织中,许多离子通道和转运蛋白,如 Ca2+、K+通道和 Na+/H+交换泵,通过与 PtdIns(4,5)P2相互作用来调节其生理功能,例如PtdIns(4,5)P2能够抑制烟草细胞细胞膜上K+通道;PtdIns(4,5)P2能诱导根毛顶端生长[32-33],并调节膜囊泡的胞外分泌来调控植物顶端极性生长[34]。PCaP可以通过N23域调节Ca2+/PtdInsP信号而调控植物顶端极性生长。
微管微丝与植物顶端极性生长有关。细胞中微管微丝的装配、解聚方式能决定植物细胞的生长方向[35]。PCaP能够结合微管并破坏微管稳定性来调节植物顶端生长的方向。PCaP的CC域中PEVK-rich是微管微丝结合区域,CC域与细胞极性生长有关。研究表明,PCaP破坏微管微丝细胞骨架的能力依赖于Ca2+的浓度。PCaP的N23域调控的Ca2+/PtdInsP信号通路与CC域调节微管微丝装配存在交互,它们共同参与植物的顶端极性生长。
5.3.1 PCaP2控制根毛顶端生长极性并抑制根毛伸长 根毛的伸长是一个极性的过程,受许多因素的影响。研究表明,PCaP2基因对根毛伸长有负调控作用,它能抑制根毛增长,其抑制程度与PCaP2的N23域表达水平有关,PCaP2是通过N23域在细胞膜上结合PtdIns(4,5)P2来定量抑制根毛顶端生长的。PCaP2的过表达会导致出现分叉根毛和根毛异常,这是因为PCaP2表达水平的变化会影响根毛生长方向,从而导致一根根毛形成多个生长点,出现分叉根毛的现象[35]。
微管骨架在根毛发育中也起重要作用[36]。PCaP的CC区PEVK-rich域能与微管相互作用。PCaP2的CC域能通过调节微管骨架来控制细胞增长的方向,从而导致根毛顶端极性生长。另外,PCaP2对微管稳定性的破坏作用能抑制根毛伸长。因此,异常根毛形态可能是PCaP2的PEVK-rich域与微管相互作用引起的。
5.3.2 PCaP2控制花粉管极性生长 花粉管通过其末端细胞极性扩增进行生长,肌动蛋白(微丝)细胞骨架在花粉管生长中起重要作用[37-38]。在生长的花粉管中,花粉管柄中的胞质Ca2+浓度很低,而在花粉管顶端却很高。这种Ca2+浓度梯度决定肌动蛋白的组装方式,从而控制花粉管的极性生长方向[30]。Zhu等的研究揭示了Ca2+浓度梯度影响花粉管极性生长的机制:细胞中,PCaP2破坏微丝的活性取决于Ca2+浓度,当Ca2+浓度达到一定高度时,其具有破坏微丝的能力。因此,MAP18可以在顶端区域破坏肌动蛋白,而不影响花粉管底部的肌动蛋白,从而导致花粉管顶端极性生长[13]。
另一方面,Ca2+浓度的增高会导致Ca2+/CaM竞争性地与PCaP2结合,从而使PtdIns(4,5)P2从PCaP2上解离下来,激活下游信号,控制植物生长。PtdIns(4,5)P2已被证明能调控花粉管的极性生长。PCaP2调控的Ca2+/PtdInsP信号也参与调节花粉管极性生长。花粉管的生长极性受这2种机制的共同调节。
6 结语
PCaP既属于Ca2+结合蛋白又属于微管结合蛋白,它的多功能性在植物顶端生长极性中起重要调控作用。通过近几年来的不断研究,人们对PCaP的功能有了一定的认识,但仍有许多未知功能和未知的PCaP等待挖掘。PCaP解聚微管的能力受Ca2+调节,但Ca2+调节PCaP解聚微管活性的确切机制并不明确。大量研究已证实,PCaP调节的Ca2+/PtdInsP信号与其调节微管微丝在控制植物顶端生长极性中存在交互,其具体机制需要更多的研究去解析,这为阐释植物组织顶端极性生长提供了新的思路和方法。随着生物技术的不断发展,相信不久的将来对PCaP的研究会有更多、更新的发现。
[1]汪澈,张立军,樊金娟,等.植物钙结合蛋白[J].植物生理学通讯,2009,45(3):209-216.
[2]Kaadige M R,Ayer D E.The polybasic region that follows the plant homeodomain zinc finger 1 of Pf1 is necessary and sufficient for specific phosphoinositide binding[J]. J Biol Chem,2006,281:28831-28836.
[3]Suh B C,Hille B.PIP2 is a necessary cofactor for ion chan⁃nel function:how and why[J].Annu Rev Biophys,2008,37:175-195.
[4]陈兴娟,张熙东,张璇,等.蛋白激酶C和磷脂酰肌醇4,5二磷酸之间相互调节作用的研究进展[J].中国药理学通报,2012,28(11):1497-1499.
[5]Nagasaki N,Miyano M,Maeshima M.Protein chemical proper⁃ties of plasma membrane associated cation-binding protein At⁃PCaP1 in Arabidopsis thaliana[J].J Biochem,2008,144:487-497.
[6]Kato M,Nagasaki N,Ide Y,et al.An Arabidopsis hydrophil⁃ic Ca2+binding protein with a PEVK-rich domain,PCaP2,is associated with the plasma membrane and interacts with calmodulin and phosphatidylinositol phosphates[J].Plant Cell Physiol,2010,51:366-379.
[7]张少斌,刘曦,张立军,等.植物微管结合蛋白[J].植物生理学通讯,2009,45(3):291-298.
[8]Hamada T.Microtubule-associated proteins in higher plants[J].J Plant Res,2007,120:79-98.
[9]Wang X,Zhu L,Liu B,et al.Arabidopsis microtuble-associat⁃ed protein 18 functions in directional cell growth by destabi⁃lizing cortical microtubules[J].Plant Cell,2007,19:877-889.
[10]Li J,Wang X,Qin T,et al.MDP25,a novel calcium regula⁃tory protein,mediates hypocotyl cell elongation by destabiliz⁃ing cortical microtubules in Arabidopsis[J].Plant Cell,2011,23:4411-4427.
[11]Qin T,Li J,Yuan M,et al.Characterization of the role of calcium in regulating the microtubule-destabilizing activity of MDP25[J].Plant Signal Behav,2012,7(7):708-710.
[12]Kato M,Aoyama T,Maeshima M.The Ca2+-binding protein PCaP2 located on the plasma membrane is involved in root hair development as a possible signal transducer[J].Plant J,2013,74:690-700.
[13]Zhu L,Zhang Y,Kang E,et al.MAP18 regulates the direc⁃tion of pollen tube growth in Arabidopsis by modulating fac⁃tin organization[J].Plant Cell,2013,25:851-867.
[14]Ide Y,Nagasaki N,Tomioka R,et al.Molecular properties of a novel,hydrophilic cation-binding protein associated with the plasma membrane[J].J Exp Bot,2007,58:1173-1183.
[15]Nagasaki N,Miyano M,Maeshima M.A plasma membrane-as⁃sociated protein of Arabidopsis thaliana AtPCaP1 binds cop⁃per ions and changes its higher order structure[J].J Biochem,2008,144:487-497.
[16]林坤,周生波,王超,等.MAP18参与ABA调控拟南芥花粉生长的研究[J].安徽农业科学,2012,40(13):7629-7630.
[17]Kato M,Nagasaki N,Ide Y,et al.PCaPs,possible regulators of PtdInsP signals on plasma membrane[J].Plant Signal Be⁃hav,2010,5:848-850.
[18]Meijer H J G,Munnik T.Phospholipid-based signaling in plants[J].Annu Rev Plant Biol,2003,54:265-306.
[19]Heo W,Inoue T,Park W,et al.PI(3,4,5)P3 and PI(4,5)P2 lipids target proteins with polybasic clusters to the plasma membrane[J].Science,2006,314:1458-1461.
[20]Rhoads A,Friedberg F.Sequence motifs for calmodulin recog⁃nition[J].FASEB J,1997,11:331-340.
[21]Kleerekoper Q,Putkey J.PEP-19,an intrinsically disordered regulator of calmodulin signaling[J].J Biol Chem,2009,284:7455-7464.
[22]Ishijima J,Nagasaki N,Maeshima M,et al.RVCaB,a calci⁃um-binding protein in radish vacuoles,is predominantly an unstructured protein with a polyproline type II helix[J].J Bio⁃chem,2007,142:201-211.
[23]Patil A,Nakamura H.Disordered domains and high surface charge confer hubs with the ability to interact with multiple proteins in interaction networks[J].FEBS Lett,2006,580:2041-2045.
[24]Labeit S,Kolmerere B.Titins:giant proteins in charge of mus⁃cle ultrastructure and elasticity[J].Science,1995,270:293-296.
[25]Liu K,Li L,Luan S.An essential function of phosphatidylino⁃sitol phosphates in activation of plant shaker-type K+channels[J].Plant J,2005,42:433-443.
[26]Marin-Vicente C,Nicolas F E,Gomez-Fernandez J C.The Pt⁃dIns(4,5)P2ligand itself influences the localization of PKCal⁃pha in the plasma membrane of intact living cells[J].J Mol Biol,2008,377(4):1038-1052.
[27]Li J N,Jiang J D.Biological characteristics of microtubule and related drug research[J].Acta Pharm Sin,2003,38:311-315.
[28]Le J,Vandenbussche F,De Cnodder T,et al.Cell elongation and microtubule behaviour in the Arabidopsis hypocotyl:Re⁃sponses to ethylene and auxin[J].J Plant Growth Regul,2005,24:166-178.
[29]Keech O,Pesquet E,Gutierrez L,et al.Leaf senescence is accompanied by an early disruption of the microtubule net⁃work in Arabidopsis[J].Plant Physiol,2010,154:1710-1720.
[30]Holdaway-Clarke T L,Weddle N M,Kim S,et al.Effect of extracellular calcium,pH and borate on growth oscillations in Lilium formosanum pollen tubes[J].J Exp Bot,2003,54:65-72.
[31]Monshausen G B,Messerli M A,Gilroy S.Imaging of the yel⁃low cameleon 3.6 indicator reveals that elevations in cytosolic Ca2+follow oscillating increases in growth in root hairs of Ara⁃bidopsis[J].Plant Physiol,2008,147:1690-1698.
[32]Kusano H,Testerink C,Vermeer J E M,et al.The Arabidop⁃sis phosphatidylinositol phosphate 5-kinase PIP5K3 is a key regulator of root hair tip growth[J].Plant Cell,2008,20:367-380.
[33]Lee Y,Bak G,Choi Y,et al.Roles of phosphatidylinositol 3-kinase in root hair growth[J].Plant Physiol,2008,147:624-635.
[34]Heilmann I.Using genetic tools to understand plant phos⁃phoinositide signalling[J].Trends Plant Sci,2009,14:171-179.
[35]Bibikova T,Blancaflor E B,Gilroy S.Microtubules regulate tip growth and orientation in root hairs of Arabidopsis thaliana[J].Plant J,1999,17:657-665.
[36]Pei W,Du F,Zhang Y,et al.Control of the actin cytoskele⁃ton in root hair development[J].Plant Sci,2012,187:10-18.
[37]Gibbon B C,Kovar D R,Staiger C J.Latrunculin B has dif⁃ferent effects on pollen germination and tube growth[J].Plant Cell,1999,11:2349-2363.
[38]Fu Y.The actin cytoskeleton and signaling network during pollen tube tip growth[J].J Integr Plant Biol,2010,52:131-137.
