组织培养获得的海黍子幼孢子体的营养盐吸收和生长特性的研究*
2014-10-16顾玲玲张俊涛宫庆礼李景玉
顾玲玲,张俊涛,刘 岩,宫庆礼,李景玉
(中国海洋大学水产学院,山东 青岛266003)
海黍子(Sargassum muticum)隶属于褐藻门(Phaeophyta)、褐 藻 纲 (Phaeophyceae)、墨 角 藻 目 (Fucales)、马尾藻科(Sargassaceae)、马尾藻属(Sargassum),是我国黄、渤海沿岸比较常见的种类,是北太平洋西部特有的暖温带性海藻,除我国外还分布于千岛群岛、萨哈林岛南岸和日本沿岸[1-3]。海黍子作为潮下带的马尾藻属海藻对于鱼类、贝类及蟹类等海洋生物的产卵、育苗和摄食具有非常重要的作用[4]。同时,海黍子还具有重要的经济价值、医用价值和生态价值,它是生产褐藻胶的原料之一[5],具有较强的抗氧化活性和抗菌活性[6-7],并可以很好的吸附重金属[8-9]。为了保护其野生资源并满足栽培业发展的需求,海黍子人工育苗与栽培技术的研究显得尤为重要[10]。
海黍子人工育苗与栽培的成败与环境因子对海黍子生长和成熟的影响密切相关。不同生长阶段的海黍子对于环境因子的需求不同,由海黍子受精卵发育而来的海黍子幼体也被称为幼孢子体。Norton发现水温对海黍子幼孢子体的发育具有重要作用[11];Steen研究了培养密度、营养物浓度及温度对海黍子幼孢子体生长和生存的影响[12];Hales等研究了温度、光照强度和盐度对海黍子幼孢子体的影响[13];Wei等研究了盐度和温度对海黍子成体铵吸收的影响[14]。
关于海黍子的组织培养,Polne-Fuller通过研究得到了其深褐色愈伤组织细胞,并成功分化成了正常的幼小植株[15],通过组织培养直接产生不定芽(从通常不形成芽的部位生出的芽)的方法在海蒿子、羊栖菜、任氏马尾藻中已见报道[16]。利用组织培养方法获得海黍子不定芽的技术对于保护海黍子野生资源和人工苗种的规模化生产具有重要意义,但相关研究目前还未有报道。另外,水温及氮、磷浓度等环境因子对海黍子幼孢子体生长和成熟的影响与海黍子人工苗种与栽培的成败密切相关,但相关研究也未见报道。
本研究首先通过组织培养方法获得海黍子的不定芽,再将不定芽培养至成熟藻体,然后利用成熟藻体通过人工采苗获得幼孢子体。以该幼孢子为研究对象,研究了温度和氮、磷浓度对其营养盐吸收和生长的影响,不仅填补了相关领域的空白,也为利用组织培养方法进行海黍子的人工繁育提供了理论指导。
1 材料与方法
1.1 组织培养和幼孢子体的获得
1.1.1 海黍子不定芽的诱导和培养 2011年9月16日于山东省青岛市太平角(36°02′N;120°21′E)沿岸潮间带石沼中采集海黍子,以其假根和茎为外植体,切除表皮并切至约2mm×1mm×1mm的规格后在20℃,光照强度50μmol·m-2·s-1,光周期12L∶12D,培养液为灭菌过滤海水的条件下诱导不定芽的生成,7d更换1次培养液。不定芽诱导实验第45天时,将最长叶片可达10mm的较大的不定芽从外植体上切离,移至3 000mL的三角锥形瓶中充气培养,每个锥形瓶中放置3个不定芽,在20℃,光照强度90μmol·m-2·s-1,光周期12L∶12D,培养液为1/8PESI[17],每5d更换一次培养液的条件下,经过120d的充气培养获得海黍子的成熟藻体。
1.1.2 成熟藻体的采苗 2012年3月31日~4月2日对利用组织培养获得的成熟藻体进行了采苗。将载玻片平铺在5 000mL烧杯的底部,并向烧杯中缓慢注入灭菌过滤海水4 000mL。将成熟的藻体轻轻放入该容器中,微量充气,采苗期间不更换培养液。烧杯置于光照培养箱(GXZ-280D,宁波江南仪器厂)中,采苗条件为水温20℃,光照强度50μmol·m-2·s-1,光周期12L∶12D。
1.1.3 幼孢子体的培养 4月2日~17日,移除成熟藻体和培养液后,用镊子将附着有幼孢子体的载玻片取出并移至玻璃培养皿中,置于光照培养箱中进行静置培养。培养条件为水温20℃,光照强度50μmol·m-2·s-1,光周期12L∶12D,培养液为1/8 PESI,其浸没载玻片但不溢出培养皿即可,每3d更换一次培养液。静置培养15d后,幼孢子体长度约为1mm。4月17日~6月6日用1/8PESI培养液将幼孢子体从载玻片上冲刷剥离下来,置于3 000mL的三角锥形瓶中进行充气培养,每个锥形瓶中放置约50个幼孢子体。培养条件同静置培养。充气培养结束时,藻体长出3~5枚初生叶片,叶片长度达5~10mm。
1.2 幼孢子体的营养盐吸收特性
向100mL的锥形瓶中加入100mL的培养液,然后随机选取5~8个生长状态良好的幼孢子体(湿重(0.043±0.003)g)移入锥形瓶中作为实验组。只加培养液未加藻体的锥形瓶作为对照组。将各处理组的锥形瓶置于振荡器(TS-1,海门市其林贝尔仪器制造有限公司)上,连同振荡器移入光照培养箱中振荡反应2h。反应结束后,收集水样于-80℃冷冻保存。水样中的NO-3-N、NH+4-N和PO3-4-P浓度按《海洋监测规范》(GB 17378.4—2007)[18]的方法测定。
1.2.1 温度对幼孢子体氮磷吸收速率的影响 实验设置了10、15、20、25和30℃等5个温度处理,每个处理4个平行。实验的培养液为1/4PESI,光照强度为50μmol·m-2·s-1。实验从低温至高温依次进行,每个温度处理更换培养液,但不更换藻体。每个温度实验前,培养液需置于设定温度下预冷或预热1h。
1.2.2 氮、磷浓度对幼孢子体氮、磷吸收速率的影响实验设置了1/4PESI(NO-3-N、NH+4-N、PO3-4-P浓度分别为2 834、2 686和61μg·L-1)、1/8PESI(NO-3-N、NH+4-N、PO3-4-P浓度分别为1 796、1 454和33μg·L-1)、1/16PESI(NO-3-N、NH+4-N、PO3-4-P浓度分别为954、265和16μg·L-1)、1/32PESI(NO-3-N、NH+4-N、PO3-4-P浓度分别为133、144和10μg·L-1)和灭菌过滤海水(NO-3-N、NH+4-N、PO3-4-P浓度分别为27、4和6μg·L-1)等5个营养盐浓度处理,每个处理4个平行。其他实验条件同温度对幼孢子体氮磷吸收速率的影响实验。每个处理使用不同的藻体进行。
1.3 幼孢子体的生长特性
向500mL通气培养瓶中加入500mL培养液,随机选取4个生长状态良好的幼孢子体称量湿重后移入培养瓶中,将培养瓶置于光照培养箱中进行充气培养。培养条件为光照强度50μmol·m-2·s-1,光周期12L∶12D,培养周期12d,每3d更换一次培养液并观察记录藻体衰败和死亡情况。
培养实验设置了10、15、20、25、30℃等5个温度处理和富含 N、P的1/4PESI培养液和去 N、P的ASS2培养液[19]等2个营养盐浓度处理,共计10个处理,每个处理3个平行。
培养实验结束后,测定每个处理组所有存活个体的湿重,根据下列公式计算特定生长率(SGR)。
SGR=(ln Wt-ln W0)/t×100%,
其中:W0为实验初始时幼孢子体的湿重(g);Wt为实验
结束时幼孢子体的湿重(g);t为实验周期(d)。
1.4 幼孢子体的叶绿素含量的测定
生长实验结束后对各处理组的幼孢子体的叶绿素a、c含量进行了测定。提取方法、测定方法以及计算方法参照张俊涛等[20]。
1.5 数据处理与分析
数据使用统计软件SPSS 17.0进行处理和分析。由于所得数据不具备正态分布和方差齐性,因此采用非参数的Kruskal-Wallis检验法及Scheffé多重比较法对不同温度和氮磷浓度间的营养盐吸收速率、不同温度间的特定生长率SGR及叶绿素含量的差异显著性进行分析,采用非参数的 Mann-Whitney检验法[21]对不同培养液间的特定生长率和叶绿素含量的差异显著性进行分析。检验以P<0.05作为差异显著水平。
2 结果
2.1 幼孢子体的营养盐吸收特性
2.1.1 温度对幼孢子体的氮吸收速率的影响 温度对幼孢子体的吸收速率影响显著(见图1,P<0.05),而对N吸收速率影响不显著(P>0.05)。的吸收速率在25~30℃范围内达到8.50~9.16μg·g-1·h-1,显著高于其它温度下的吸收速率。的吸收速率除了在10℃时为-11.74μg·g-1·h-1外,在其它温度下均保持在20.25~29.58μg·g-1·h-1,且吸收速率在温度间没有显著差异(P>0.05)。
2.1.2 温度对幼孢子体的磷吸收速率的影响 温度对幼孢子体的PO34--P吸收速率影响不显著(见图1,P>0.05)。在10~30℃范围内,其吸收速率随着温度的升高而增大,10℃时其吸收速率为最小值-0.09 μg·g-1·h-1,25℃时达到最大值0.97μg·g-1·h-1。
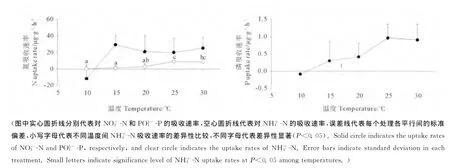
图1 组织培养获得的海黍子幼孢子体在不同温度下的氮、磷吸收速率Fig.1 Uptake rates of ,,and at different temperatures ofyoung sporophytes of S.muticumobtained by tissue culture
2.1.3 氮浓度对幼孢子体氮吸收速率的影响 氮浓度对NH+4-N的吸收速率影响显著(P<0.05),而对NO-3-N的吸收速率影响不显著(见图2,P>0.05)。幼孢子体对NO-3-N和NH+4-N的吸收速率均随着氮浓度的升高而增大,且NO-3-N的吸收速率高于NH+4-N的吸收速率,在实验浓度下两者的吸收速率均未达到饱和。NH+4-N的吸收速率在NH+4-N浓度为2 686 μg·L-1时达到最大值8.02μg·g-1·h-1。而NO-3-N的吸收速率在NO-3-N浓度为2 834μg·L-1时达到最大值28.76μg·g-1·h-1。
2.1.4 磷浓度对幼孢子体磷吸收速率的影响 磷浓度对幼孢子体的PO3-4-P吸收速率影响显著(见图2,P<0.05)。当磷浓度为6~16μg·L-1时,PO3-4-P的吸收速率随着磷浓度的升高而增大,并在16.0μg·L-1时达到饱和值3.53μg·g-1·h-1。随着磷浓度的继续增大,PO3-4-P的吸收速率急剧减小,当PO3-4-P浓度为61μg·L-1时,吸收速率降至-2.31μg·g-1·h-1,显著低于饱和值(P<0.05)。
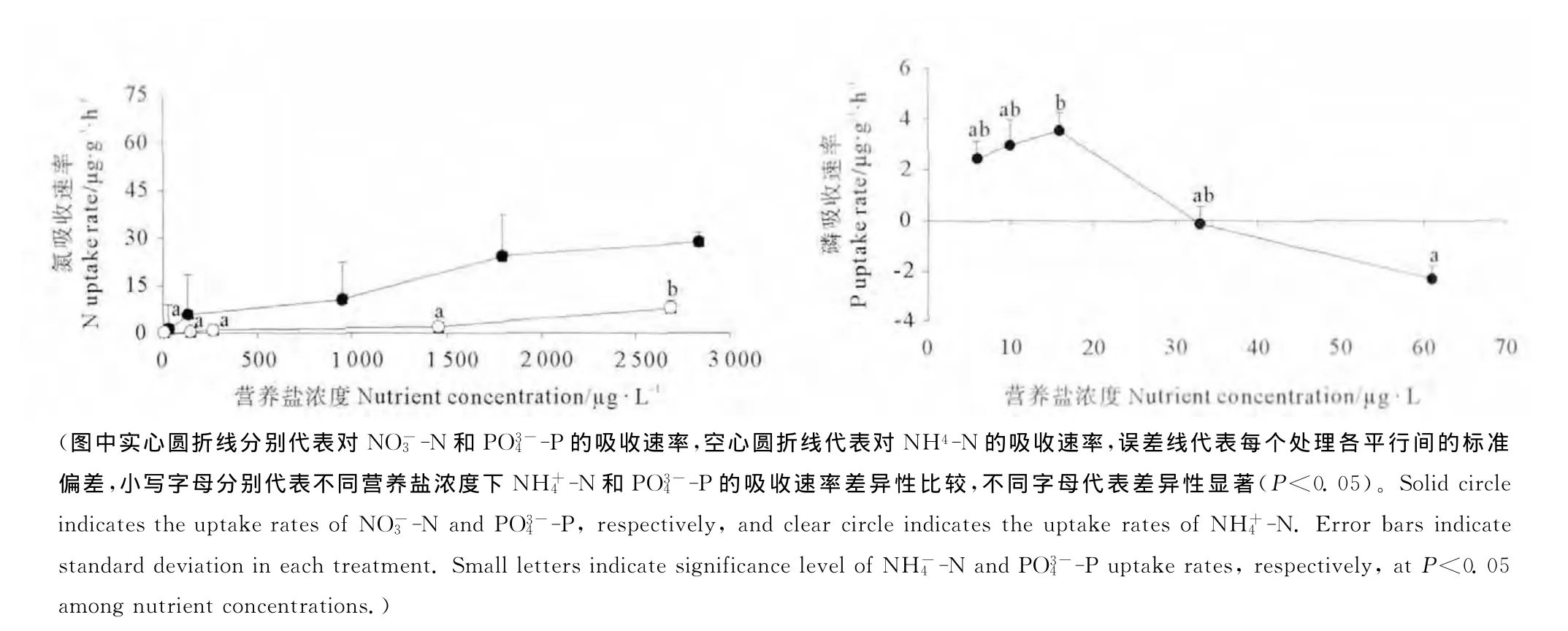
图2 组织培养获得的海黍子幼孢子体在不同氮、磷浓度下的氮、磷吸收速率Fig.2 Uptake rates of NO-3-N,NH+4-N,and PO3-4-P under different nutrient levels of young sporophytes of S.muticumobtained by tissue culture
2.2 幼孢子体的生长特性
温度和氮磷浓度对幼孢子体的特定生长率影响显著(见图3,P<0.05),两者的交互作用同样显著(P<0.05)。实验期间,无论富含氮磷组还是去除氮磷组,幼孢子体均能维持正常生长。对于富含氮磷组,当温度为15~25℃时,其SGR为16.51%·d-1~19.58%·d-1,显著高于10℃和30℃下的SGR(P<0.05)。对于去除氮磷组,当温度为15~30℃时,其SGR为13.08%·d-1~14.58%·d-1,显著高于10 ℃下的SGR(P<0.05)。在温度为15~25℃范围内,富含氮磷组的SGR显著高于去除氮磷组(P<0.05)。
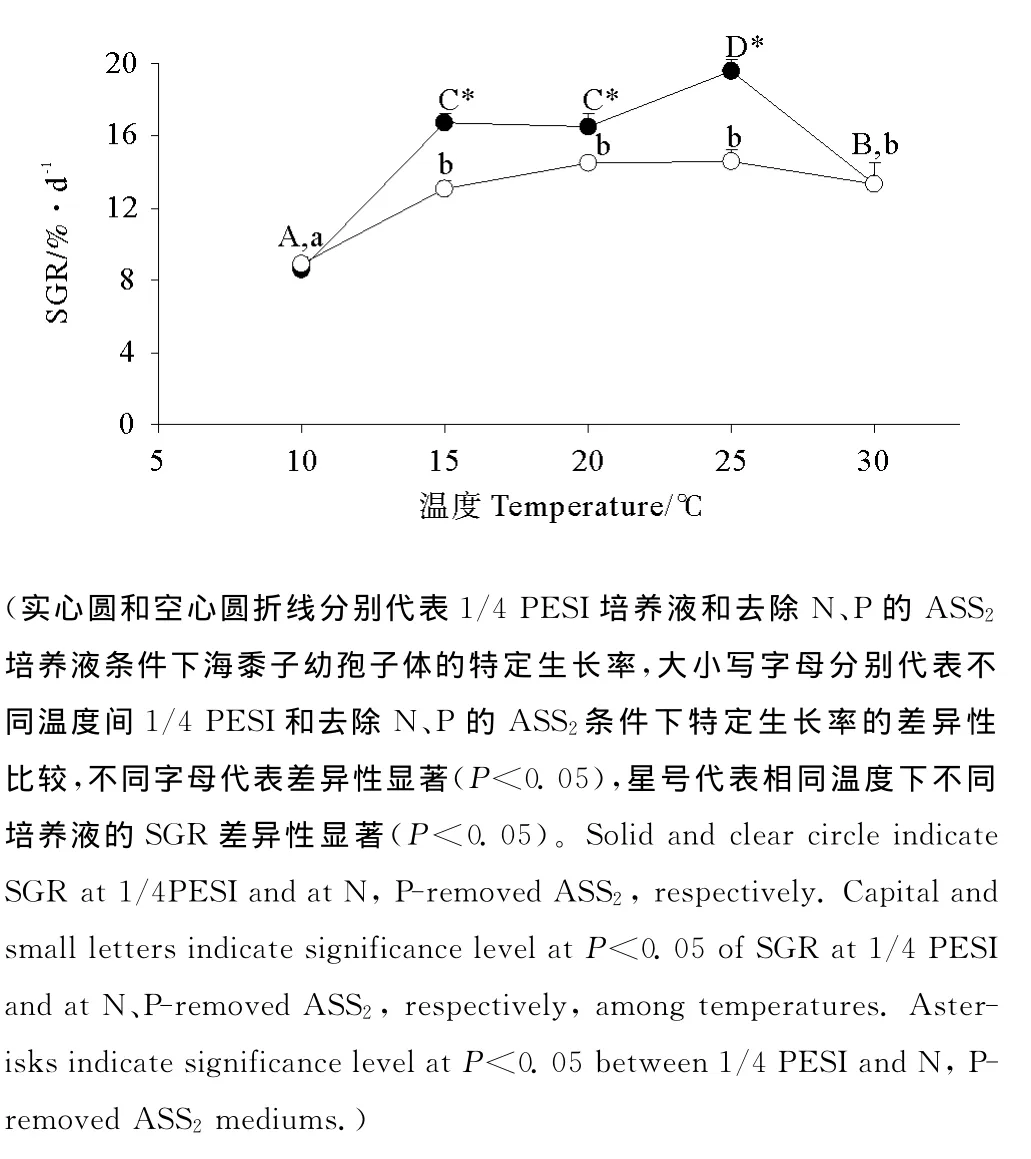
图3 组织培养获得的海黍子幼孢子体在不同温度和培养液条件下培养12d后的特定生长率Fig.3 Specific growth rate after 12dculture at different1 temperatures and mediums of young sporophytes of S.muticumobtained by tissue culture
2.3 幼孢子体的叶绿素含量
氮磷浓度对叶绿素a含量影响显著(见图4,P<0.05),温度对富含氮磷组条件下的叶绿素a含量影响显著(P<0.05),对去除氮磷组的叶绿素a含量影响不明显(P>0.05),温度和氮磷浓度的交互作用影响不显著(P>0.05)。富含氮磷组的叶绿素a含量在10~25℃时为0.54~0.62mg·g-1,而当温度上升为30℃时显著增至最大值0.75mg·g-1(P<0.05)。去除氮磷组的叶绿素a含量在10℃时为0.48mg·g-1,15~25℃时降低至0.33~0.35mg·g-1,30℃时回升至0.51 mg·g-1。在15~30℃范围内,富含氮磷组的叶绿素a含量显著高于去除氮磷组(P<0.05)。图4中的虚线代表培养前的叶绿素含量。由图发现,与培养前的叶绿素a含量相比,富含氮磷组的叶绿素a含量没有明显变化,而去除氮磷组的叶绿素a含量则明显低于培养前。
叶绿素c含量受温度影响不显著(见图4,P>0.05),而受氮磷浓度的影响显著(P<0.05)。而两者的交互作用对叶绿素c含量的影响不显著(P>0.05)。富含氮磷组的叶绿素c含量在10℃时为0.36mg·g-1,15~25℃时降低至0.22~0.24mg·g-1,30℃时回升至0.30mg·g-1。去除氮磷组的叶绿素c含量在10~25℃范围内随着温度的上升由最大值0.26mg·g-1降至最小值0.12mg·g-1,30℃时回升至0.19mg·g-1。在20~30℃范围内,富含氮磷组的叶绿素c含量显著高于去除氮磷组(P<0.05)。与培养前的叶绿素c含量相比,富含氮磷组的叶绿素c含量明显高于培养前,而去除氮磷组的叶绿素c含量无明显变化。
3 讨论
3.1 通过组织培养间接获得海黍子人工苗种的优势
对于自然海区的野生海黍子藻体,一般在9、10月间生出新的主枝,直至翌年1、2月间生长缓慢,3、4月间生长迅速,生殖托一般在5月开始出现,7~8月间繁殖[1]。利用海黍子的自然繁殖进行人工采苗,一年中只限于一季,而且苗种的海上培育期恰逢秋、冬季节,藻体生长缓慢,这是海黍子人工苗种规模化生产的瓶颈之一。本研究中,2011年9月16日开始利用野生海黍子的假根和茎作为外植体诱导不定芽,2012年3月31日由不定芽成功培育出成熟的藻体,2012年6月6日由成熟藻体通过人工采苗和培育获得具有3~5枚初生叶,长度达5~10mm的幼孢子体。此外,作者还于2011年10和12月、2012年2和3月分别进行了4次海黍子不定芽的诱导实验,均成功诱导出不定芽。因此根据本研究的结果,利用组织培养的方法可以使海黍子的人工采苗不受季节限制。
另一方面,水温对于海黍子幼苗的生长具有重要作用。根据Norton的研究,海黍子幼苗在5~10℃范围内生长速率仅为0.011~0.016mm·d-1,在15~25℃范围内随着温度的升高其生长速率急剧增加[11];曹淑青等报道,海黍子幼苗在水温低于22℃时能很好的生长,但当水温达到23℃后幼苗的死亡率较高[10]。根据二者的报道,作者推测海黍子幼苗的最适生长温度约为15~22℃。6~8月青岛太平角海区的水温根据作者实测的结果为17~22℃,此时将利用组培方法间接获得的海黍子幼苗移至自然海区培养,必能取得较高的育苗成功率。通过组培方法间接获得的海黍子幼孢子体具有与母体一样的遗传特性,尽管它的出现比通过自然繁殖获得的幼孢子体提早了2个月,但其生理生态学特性应与母体具有相似之处。因此,研究利用组培方法间接获得的海黍子幼孢子体的营养盐吸收特性和生长特性具有重要意义。
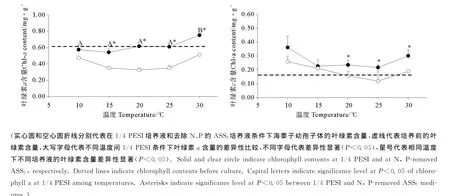
图4 组织培养获得的海黍子幼孢子体在不同温度和培养液条件下培养12d后的叶绿素含量Fig.4 Contents of chlorophyll a and chlorophyll c after 12-day culture at different temperatures and mediums of young sporophytes of S.muticumobtained by tissue culture
3.2 海黍子幼孢子体的氮吸收特性
本研究结果显示,在15~30℃范围内海黍子的幼孢子体均可吸收NO-3-N和NH+4-N,对NO-3-N的吸收速率在15℃时达到最大值29.58μg·g-1·h-1,与鼠尾藻幼孢子体相同[20]。而对NH+4-N的吸收速率在25℃时达到最大值9.16μg·g-1·h-1,与海黍子成体一致[14]。在10℃时二者的吸收速率降至零或负值。温度对海黍子幼孢子体的氮吸收的影响可能与藻体的生活环境、生长阶段以及相关酶的活性有关。用于组织培养的海黍子成体采自青岛太平角沿岸潮间带的石沼中,根据作者观察,青岛太平角海区海黍子的幼孢子体一般出现在6~9月份,期间的水温实测结果为17~24℃,长期的温度变化剧烈的环境可能是导致幼孢子体在较大的温度范围(15~30℃)内均可进行氮吸收得主要原因。另外,根据徐智广的报道,温度降低可能影响海藻对氮的吸收能力[22],过低的温度(10℃)可能通过抑制硝酸还原酶的活性从而影响了幼孢子体对的吸收。
实验结果显示,在实验氮浓度范围内(0~2 834 μg·L-1),海黍子幼孢子体对NO-3-N和NH+4-N的吸收速率随着氮浓度的升高而增大,氮浓度-氮吸收速率曲线均呈开放型吸收模式。这可能是由于幼孢子体阶段对氮的需求量较高,而开放型的吸收模式可以提高对氮的利用率。
不同形式氮的可利用性影响幼孢子体对氮的吸收。本研究中,在实验温度(15~30℃)和实验氮浓度(0~2 834μg·L-1)范围内,海黍子幼孢子体对NO-3-N的吸收速率均大于对NH+4-N的吸收速率。根据Dortch和Flynn的研究,许多大型海藻和微藻从环境中会优先吸收NH+4-N,并且NH+4-N的存在会抑制对NO-3-N的吸收[23-24]。Wei研究了温度对海黍子成体吸收NH+4-N的影响,结果也显示海黍子成体对NH+4-N的吸收能力很强,最大值可达77.5μg·g-1·h-1[14],这些与本实验的研究结果有差异。但是Mai等评估了某马尾藻类在藻—虾混养系统中去除营养盐的能力,结果显示比起NH+4-N该马尾藻属海藻对于NO-3-N的吸收能力更强[25]。有学者也发现米氏凯伦藻对硝酸钠及亚硝酸钠的利用率高于氯化铵[26],硝酸钠和尿素比起氯化铵更利于利玛原甲藻的生长[27]。本研究中NO-3-N的吸收速率大于NH+4-N的吸收速率,这可能与海藻种类及其对不同形式的氮的利用率有关。对NO-3-N的利用率较大可能与海黍子幼孢子体内的硝酸还原酶含量和活性较高有关;同时幼孢子体阶段的海黍子对营养盐的需求量较大,外界的NH+4-N含量不足以满足其生长的需要,藻体必须依靠NO-3-N来补充生长的需要[28]。
3.3 海黍子幼孢子体的磷吸收特性
自然界中的藻体主要利用无机态磷,但其在细胞体内不能直接合成,故藻类必须从外界吸收磷酸盐以满足生长需求,藻体内通常会有一套应急的磷供应体系及相应的调节过程来适应环境的变化[29]。本研究的结果显示,尽管温度对幼孢子体的PO3-4-P吸收速率影响不显著,但在10~25℃范围内,PO3-4-P的吸收速率随着温度的升高由负值增至最大值,而在30℃时又有所下降,这说明幼孢子体对PO3-4-P的吸收具有一定的温度耐受限度。这可能是因为温度能改变细胞膜的生理特性,低温下膜转运蛋白质构象的变化可能会被阻碍[30],或是相关酶的活性受到抑制,从而蛋白质无法携带可溶性营养分子通过,进而降低了对营养盐的吸收速率[31]。根据包杰的研究,鼠尾藻对PO3-4-P的吸收速率在温度10~25℃范围内随着温度的上升而升高[32],Powell等也发现25℃对于栅藻类的PO3-4-P吸收有积极的影响[33],这与本实验结果相符。这可能与藻类利用磷酸盐的量有关,当温度升高时藻类的光合磷酸化和氧化磷酸化过程都加快,所以当磷酸盐浓度相同时,随着温度的升高藻类会加快对磷酸盐的吸收[34]。
本实验中,当培养液中PO34--P浓度在16μg·L-1以下时,而增大,而当的吸收速率则随着浓度的升高而急剧减小,甚至出现了负值。根据徐智广的报道,在一定范围内提高PO34--P的浓度增大了海藻对其吸收的底物浓度,导致其对的同化作用增强,从而刺激了一定范围内对的吸收[22],当的浓度继续增大并超过一定量时,就会对植物产生毒害作用,植物体内的代谢过程将会出现紊乱,甚至导致植物死亡[35]。因此本研究中过大浓度的反而降低了藻体对的吸收甚至出现负吸收的情况。
3.4 温度和氮磷浓度对海黍子幼孢子体生长的影响
本实验结果显示,不管是在富含氮磷条件下还是在去除氮磷条件下,温度对于幼孢子体SGR的影响均显著。藻类的光合作用和呼吸作用都受温度的影响,温度过高或过低都会影响其光合作用与呼吸作用酶的活性,所以温度是藻类生长发育的重要因素[36]。本研究结果显示,海黍子幼孢子体的最适生长温度为25℃,这与 Norton和 Hales等的研究结果一致[11,13]。Eno发现海黍子成体的最适生长温度也为25℃[37],这说明海黍子幼孢子体和成体在最适生长温度上不存在差异。
当温度为15~25℃时,富含氮磷组的SGR明显高于去除氮磷组,这说明外源氮磷的适当供给更利于幼孢子体的生长。Steen也证明了富含氮磷的培养液可以促进海黍子幼孢子体的快速生长[12]。另一方面,去除氮磷组的幼孢子体在12d内仍能保持较高的正生长率,由此推测海黍子幼孢子体生长所需的氮磷主要来源于藻体内部的积累,而一少部分来源于外界的供给。Chapman的实验证明有些多年生褐藻从营养盐含量较高的冬季海水中将大量的氮储存在细胞内,从而保证在营养盐含量较低的冬季藻体也能快速生长[38]。Pedersen也证实墨角藻Fucus vesiculosus在氮缺乏的条件下能依靠体内储存的氮来维持生长[39]。张俊涛的研究也表明温度15~30℃范围内鼠尾藻幼孢子体在没有外界氮供给的条件下仍能维持较高的生长率[20]。
本研究发现,幼孢子体的SGR与藻体内叶绿素a、c含量呈负相关关系,尤其是去除氮磷组的叶绿素a含量实验后明显低于实验前。由此推测叶绿素a可能是藻体内重要的氮库之一,当环境条件适宜藻体快速生长时,为了满足生长对氮的需求,藻体内的叶绿素a分解并通过一定的途径转化为藻体生长所需要的氮,以致藻体内叶绿素a含量减少。而叶绿素c含量即使在去除氮磷条件下实验前后变化也不大,说明叶绿素c对于海黍子幼孢子体是一种重要的光合色素,而它作为氮库的功能较弱。这种现象在鼠尾藻的幼孢子体上已有报道[20]。
3.5 通过组织培养间接获得海黍子苗种技术的实用性
本研究首次报道了应用海黍子外植体诱导不定芽,后经室内培养获得成熟藻体,并利用成熟藻体成功进行了采苗的事实,验证了通过组织培养技术提供稳定、充足的海黍子苗种供应的可能性。作为多年生的海藻,海黍子的假根和茎全年存在[2],即全年都可利用海黍子进行组织培养。尽管海黍子的假根和茎的体积较小,但根据本研究结果,每株海黍子的假根和茎可以产生约10个外植体,而每个外植体上可以产生约10个不定芽,这些不定芽切离后经过培养即可长成新的成熟藻体,而切除了不定芽的外植体在一定的培养条件下还可再生出不定芽。根据Norton等人的报道,海黍子藻体上的每个生殖托可产生超过300个受精卵,一株15g的藻体在它的第一个繁殖期就可放散约50万个受精卵[40],这些受精卵经过培养即可成为生产用的苗种。由此推算,仅一株海黍子藻体的假根和茎就可产生约5 000万株新的幼苗。组织培养方法具有经济实用,技术要求低,出芽时间短,出苗效率高等特点。此方法除了在海黍子人工苗种规模化生产上具有应用前景外,在海黍子等马尾藻属海藻的室内种质保存方面也具有重要的应用价值。
[1] 曾呈奎.中国黄渤海海藻 [M].北京:科学出版社,2009:395.
[2] 曾呈奎.中国经济海藻志 [M].北京:科学出版社,1962:86-88.
[3] Yoshida T.Marine Algae of Japan[M].Tokyo:Uchida Rokakuho Publishing Co.,Ltd,1998:394.
[4] Shinji K,Yoshikazu F,Masahiro N.Axenic tissue culture of Sargassum confusumC.Agardh(Phaeophyta)as a source of seeds for artificial marine forests[J].Marine Biotechnology,1997,5:142-146.
[5] 李宝华,杜素兰,赖冰心.青岛岩沿海海域马尾藻属藻类植物的研究 [J].海岸工程,2004,23(3):74-78.
[6] 于广利,吕志华,王曙光,等.海黍子提取物对不饱和脂质抗氧化作用 [J].青岛海洋大学学报:自然科学版,2000,30(1):75-80.
[7] 徐年军,范晓,韩丽君,等.海藻乙醇提取物抗菌活性的研究 [J].海洋与湖沼,2002,33(3):265-270.
[8] 冯咏梅,王文华,常秀莲,等.生物吸附剂-海黍子吸附镍 [J].城市环境与城市生态,2003,16(6):4-6.
[9] 林荣根,黄朋林,周俊良.两种褐藻对铜和镉的吸着及洗脱研究[J].海洋环境科学,1999,18(4):8-13.
[10] 曹淑青,张泽宇,王国书,等.海黍子室内人工育苗技术的研究[J].大连水产学院学报,2008,23(5):359-363.
[11] Norton T A.The growth and development of Sargassum muticum (Yendo)Fensholt[J].Journal of experimental marine biology and ecology,1977,26:41-53.
[12] Steen H.Intraspecific competition in Sargassum muticum (Phaeophyceae)germlings under various density,nutrient and temperature regimes[J].Botanica Marina,2005,46(1):36-43.
[13] Hales J M,Fletcher R L.Studies on the recently introduced brown algaSargassum muticumIV.The effect of temperature,irradiance and salinity on germling growtn[J].Botanica Marina,2009,32(2):167-176.
[14] Wei H f,Liu C F,Cai H J,et al.Effects of temperature and salinity on ammonium uptake by Sargassum muticum [C].//Proceeding of International Conference on E-Product E-Service and EEntertainment.Henan:[s.n.],2010:1-3.
[15] Polne-Fuller M,Gibor A.Calluses and callus-like growth in seaweeds:Induction and culture[J].Hydrobiologia,1987,151/152:131-138.
[16] 能登谷正浩.有用海藻的生物技术 [M].东京:恒星社厚生阁,1997:21.
[17] Tatewaki M.Formation of a crustaceous sporophyte with unilocular sporangia in Scytosiphon lomentaria [J].Phycologia,1966,6(1):62-66.
[18] 中华人民共和国.GB17378.4-2007海洋环境监测规范 [S].北京:中国标准出版社,2008.
[19] Nakanishi K,Nishijima M.Bacteria that induce morphogenesis in Ulva pertusa(Chlorophyta)grown under axenic conditions [J].Journal of Phycology,1996,32:479-482.
[20] 张俊涛,顾玲玲,刘岩,等.温度和氮浓度对鼠尾藻幼孢子体的但吸收和生长的影响 [J].中国海洋大学学报:自然科学版,2012,42(增刊):264-269.
[21] 郝黎仁.SPSS实用统计分析 [M].北京:中国水利水电出版社,2003:155-264.
[22] 徐智广.2种大型经济海藻对海水中营养盐供应的生理相应[D].汕头:汕头大学,2007.
[23] Dortch Q.The interaction between nitrate and ammonium uptake in phytoplankton[J].Marine Ecology Progress Series,1990,61:183-201.
[24] Flynn K J.Algal carbon-nitrogen metabolism:a biochemical basis for modeling the interactions between nitrate and ammonium uptake[J].Journal of Plankton Research,1991,13:373-387.
[25] Huong M,Ravi F,Jane F.Evalution of Sargassum sp.As a nutrient-sink in an integrated seaweed-prawn (ISP)culture system[J].Aquaculture,2010,310(1-2):91-98.
[26] 吕颂辉,黄凯旋.米氏凯伦藻在三种无机氮源的生长情况 [J].生态环境,2007,16(5):1337-1347.
[27] 钟娜,杨维东,刘洁生,等.不同氮源对利玛原甲藻生长和产毒的影响 [J].环境科学学报,2008,28(6):1186-1191.
[28] 张俊涛.鼠尾藻的生理生态学特性及组织培养技术的初步研究[D].青岛:中国海洋大学,2012.
[29] Chae H L,Ozkanca R,Flint K P.The effects of osmotics stress on survival and alkaline phosphatase activity of Aeromonas hydrophila [J].FEMS Microbiology Letters,2006,137(1):19-24.
[30] Long S P,Woodward F I.Plants and Temperature[M].Cambridge,United Kingdom:Company of Biologists,1988:237-258.
[31] Lomas M W,Glibert P M,Flint K P.Interactions betweenand NO-3uptake and assimilation:Comparison of diatoms and dinoflagellates at several growth temperatures[J].Marine biology,1999(133):541-551.
[32] 包杰,田相利,董双林,等.温度、盐度和光照强度对鼠尾藻氮、磷吸收的影响 [J].中国水产科学,2008,15(2):293-300.
[33] Powell N,Shilton A N,Pratt S,et al.Factors influencing luxury uptake of phosphorus by microalgae in waste stabilization ponds[J].Environment Science Technology,2008,42:5958-5962.
[34] 黄邦钦,洪华生.几种藻类吸收磷酸盐动力学的初步研究 [J].厦门大学学报,1994,33(增刊):7-11.
[35] 彭开琴,苏胜齐.不同浓度磷对阿根廷蜈蚣草生长的影响[C].//水产健康养殖与质量安全研讨会论文集.重庆:[s.n.],2009:102-105
[36] 徐宁,吕颂辉.温度和盐度对锥状斯氏藻生长的影响 [J].海洋环境科学,2004,23(3):36-38.
[37] Eno,C N,Clark R A,Sanderson,W G.Non-native Marine Species in British Waters:A Review And Directory[M].Peterborough,U K:Joint Nature Conservation Committee,1997.
[38] Chapman A R O,Craigie J S.Seasonal growth in Laminaria longicruris:relations with dissolved inorganic nutrients and internal reserves of nitrogen[J].Marine Biology,1977,40:197-205.
[39] Pedersen M F,Brorum J.Nutrient control of algal growth in estuarine waters.Nutrient limitation and the importance of nitrogen requirements and nitrogen storage among phytoplankton and species of macroalgae[J].Marine Ecology Progress Series,1996,142:261-272.
[40] Norton T A,Deysher L E.The reproductive ecology of Sargassum muticumat different latitudes[M].//Ryland J S,Tyler P A.Reproduction,Genetics and Distributions of Marine Organisms.Fredensborg Denmark:Olsen & Olsen Publishers ang Printers,1989:147-152.
