濒危植物延龄草初代培养中无菌培养物的建立
2014-10-09李群,王丽
李 群, 王 丽
(1.四川师范大学 生命科学学院,四川 成都610101; 2.四川大学 生命科学学院,四川 成都610064)
延龄草(Trillium tschonoskii Maxim),俗名头顶一颗珠,为百合科多年生草本植物,主要分布在中国及日本[1],生长在海拔1 600~3 200 m的阴湿环境里.根茎含薯蓣皂苷,叶片含黄酮类化合物等有效成份,具杀菌、止血、解毒等功效,主治头晕目眩、高血压、神经衰弱症,是传统名贵中药之一[2-3].近年来,由于生长环境恶化和过度采挖,加之延龄草种子休眠期长、发芽率低等生物学特性,导致种群数量急剧下降,已被国家列为三级保护植物[4].为了拯救资源,近年来一些单位对其进行迁地保护栽培研究,但由于延龄草对环境条件要求较为特殊,异地栽培繁殖亦相当困难.采用离体培养快速繁殖来挽救其种质资源是较为理想的方法.离体快繁中关键步骤之一是建立无菌培养物.本文拟对延龄草离体培养中初代培养物进行微生物分离与鉴定,采用抗生素抑制微生物生长,旨在获得大量无菌培养物.该研究为延龄草离体繁殖奠定了基础.
<1),且各件产品是否为不合格品相互独立.
1 材料和方法
1.1 植物材料本研究实验材料采自峨眉山雷洞坪(海拔2 750 m).将延龄草植株根和根茎以上部分去掉,用毛笔刷净根茎上的棕褐色物质,用流水冲洗24 h.取出根茎,用5 g/L洗衣粉水浸泡30 min,用蒸馏水清洗后,放入超净工作台上的无菌广口瓶中,用体积分数75%的乙醇浸泡30 s,无菌水冲洗1次,再用质量分数0.1%的升汞消毒8 min,无菌水冲洗4次,每次停留3 min.将消毒后的实验材料用无菌滤纸吸干水分,切成0.5 cm3大小后接种,培养基为MS[5],不添加任何激素.然后将接种材料放在20℃、2 000 Lx光照条件下,每天进行16 h光照培养.15 d后观察外植体污染情况.
1.2 菌种的分离纯化挑取植物组织上的微生物作为分离纯化和鉴定的菌种材料.具体方法如下:用接种环挑取植物组织上的微生物,接种于牛肉膏蛋白胨培养基上[6],37℃倒置培养,直至长出菌斑,分别挑取不同形态特征的菌落,划线于牛肉膏蛋白胨平板上进行分离,挑选典型单菌落,反复纯化,直到菌落形态一致,在显微镜下观察无显著差别为止.
1.3 菌种的形态学鉴定和生理生化鉴定根据文献[6-7]的方法进行.生理生化测试项目见表1.
1.4 对污染材料进行抑菌处理
1.4.1 在培养基中添加抗生素 在菌种鉴定基础上,选择几种抗生素按质量浓度梯度加入培养基中(见表2),培养基激素组合为MS+6-苄基嘌呤(BA)2.0 mg/L+吲哚酸乙酸(IAA)1.0 mg/L.然后将外植体接种到培养基上,20 d后观察外植体的污染情况.
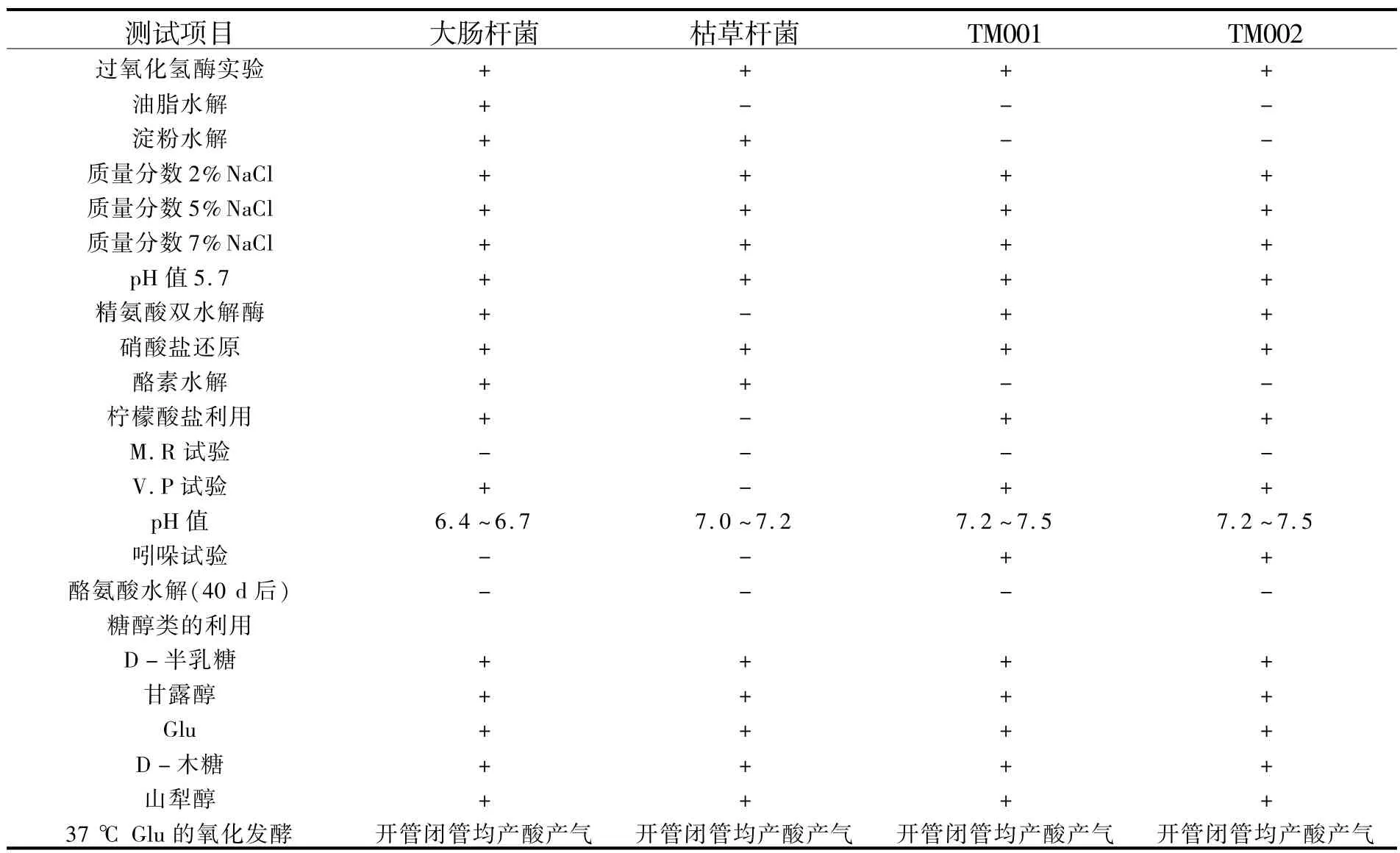
表1 延龄草初代培养物感染菌种的生理生化鉴定结果Table 1 Results of the biochemical and physiological identification of the infected bacterium of the initiation culture of Trillium tschonoskii Maxim
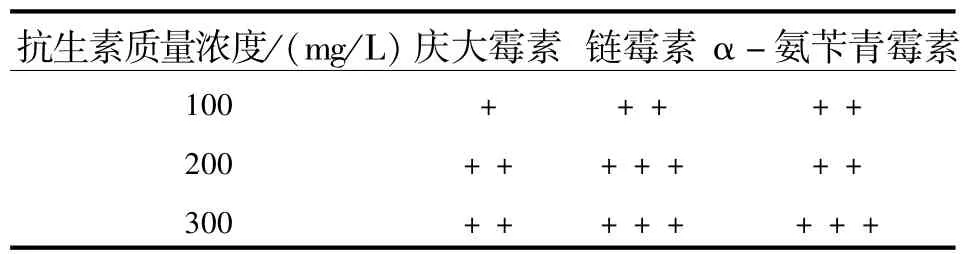
表2 培养基中添加不同种类、质量浓度抗生素的抑菌效果Table 2 Effects of antibacteria by the supplementation of different antibiotic in different concentration into the medium
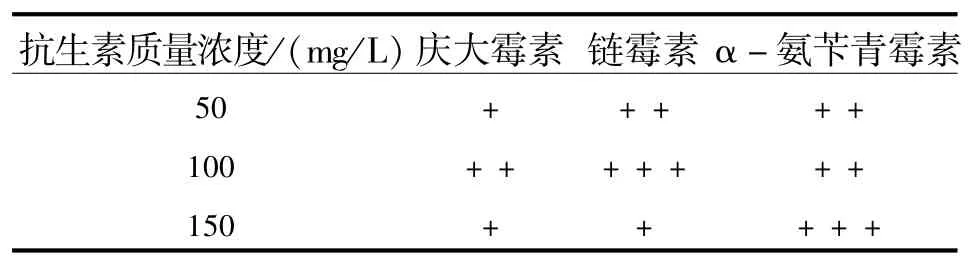
表3 不同种类、质量浓度抗生素溶液处理污染外植体的效果Table 3 Effects of different kinds and concentration antibiotic solution treatment to explants contamination
1.4.2 对污染材料直接进行浸泡处理 接种初期,观察到外植体或培养基出现粘液状或泡沫发酵状物质或真菌菌丝时(污染特别严重的应丢弃),将外植体取出,用无菌水清洗,抗生素溶液中浸泡并置于恒温摇床上振荡培养(120 r/min)6 h(见表3),之后再接种到新鲜培养基中继续培养.20 d后观察材料污染及萌动情况.
2 结果
2.1 植物材料中菌株的获得接种半个月后的植物材料经观察,发现98%以上的植物组织都被微生物感染且材料很少萌动.外植体周围感染红色粘状微生物,从植物组织蔓延至培养基中,污染严重时使培养基发黄且组织褐变致死.观察中还发现,微生物在培养基上生长缓慢,1~2月没有明显的生长和繁殖.植物材料表现出一种慢性感染的状态.多次试验结果都如此.从感染的植物组织中分离纯化获得2株形态单一的菌株,分别命名为TM001和TM002.
2.2 菌种的形态学鉴定
2.2.1 群体特征 以伊红美蓝琼脂培养基(EMB)为培养基[6],37 ℃培养.“TM001”菌株和“TM002”菌株及对照的大肠杆菌12 h菌龄时为粉红色,24 h之后菌苔边缘粉红色,中间已变成紫色,菌苔常较粘稠.
2.2.2 个体特征 取“TM001”菌株和“TM002”菌株用吕氏美蓝单染色,镜检,菌体形态均一.各测20个菌体计算平均值:长 0.5 μ m,宽 <0.5 μ m.
2.2.3 革兰氏染色 以3点平行法涂片,以大肠杆菌(G-)和枯草杆菌(G+)为对照,结果显示2株菌均为G-球杆菌.
2.2.4 芽孢染色 经芽孢生成培养基培养均无芽孢生成.
2.3 菌种的生理生化鉴定根据以上各项实验结果,待定菌株均属于肠杆菌科,且“TM001”菌株和“TM002”菌株生理生化实验参数完全一致,两者应属于同一属.进一步结合文献资料[7]得出:它们应属于埃希氏菌属(Escherichia).只是待定菌株在产生吲哚的实验中与对照大肠杆菌的结果不同,用振荡和不振荡2种培养方法进行了多次实验,结果均呈阳性反应.
2.4 对污染材料进行抑菌处理
2.4.1 在培养基中加抗生素 在培养基中加抗生素结果见表2(表2和表3中,每个处理20支,重复3次.“+”表示抑菌效果差(大部分外植体被微生物感染,外植体生长状态差,外植体未萌动);“++”表示抑菌效果较好(少部分外植体被微生物感染,外植体生长状态一般,外植体有萌动迹象);“+++”表示抑菌效果最好(大部分外植体未被微生物感染,外植体生长状态良好,部分外植体萌动)).
从表2可以得出,链霉素在培养基中的抑菌效果最好,在质量浓度为200和300 mg/L时都达到了很好的抑菌效果.且在观察中发现,即使质量浓度高达300 mg/L时,外植体生长状态仍较好,仅发现极少外植体轻微褐变,且少部分外植体已开始萌动;其次,α-氨苄青霉素的抑菌效果也不错,外植体损伤较小,且有萌动趋势;而庆大霉素抑菌效果最差,外植体带菌较多并表现出较差的生长状态,组织看起来处于一种失水状态,褐变也较为严重,几乎没萌动.
2.4.2 对污染材料直接进行抗菌处理 抗菌处理结果见表3.
从表3可看出,不同质量浓度的抗生素处理均可获得一定的抑菌效果,以100 mg/L的链霉素和150 mg/L的α-氨苄青霉素效果最好,而50和150 mg/L的庆大霉素、150 mg/L的链霉素效果最差.可见,在高质量浓度(150 mg/L)时,庆大霉素和链霉素的抑菌效果反而较差,这可能是由于抗生素对材料的副作用太大,导致材料的抵抗力降低所致.据报道,抗生素对植物材料的副作用主要是对植物细胞产生毒性,甚至杀死植物细胞[8-9].这种毒性导致植物材料抵抗所感染微生物的能力减弱.除此之外,在观察中还发现,所有生长状态较好的外植体都有萌动趋势,污染的外植体都有轻微的褐变,并处于一种轻微失水状态.
3 讨论
从最初对外植体的培养中观察到,外植体污染是植物组织自身带菌所致.众所周知,在植物组织培养研究中,相对于操作污染和环境条件污染,外植体自身带菌污染是不易控制和消除的[10],况且对延龄草这种长期生长在高寒地带的植物来说,带菌情况复杂,可用来离体培养的组织器官少.因此,在离体培养中能有效控制和消除外植体自身带菌造成的污染显得尤为重要.据文献报道,控制外植体自身带菌污染最有效的措施是对所感染微生物进行分离鉴定,选择有效的抑菌剂,抑制微生物的生长,同时兼顾外植体的生长状态,最终达到既控制微生物生长,又不影响材料生长繁殖的目的[11-12].如 P.M.Young 等[13]在苹果和杜鹃的污染茎段组培苗中加入25 mg/L头孢霉素、25 mg/L四环素、6 mg/L利福平和6 mg/L多粘菌素B的混合物后,可培养细菌被完全去除;B.M.Reed等[14]研究发现1 000 mg/L链霉素处理薄荷组培苗10 d后去除内生细菌效果最为显著.卢跃敏等[15]研究表明,将青霉素和庆大霉素以30或15 mg/L的质量浓度加入盐桦培养基中,对抑制污染菌的生长有一定作用,同时可促进盐桦萌芽和生长.杨元等[16]研究表明,将庆大霉素作为竹芋组织培养中的抑菌剂效果最好,使用质量浓度范围控制在500~1 000 mg/L.综合大多文献资料,常用的抑菌剂主要为头孢霉素、利福平、庆大霉素、链霉素、α-氨苄青霉素等抗生素.因此,本研究也首先考虑使用其中的几种抗生素.
本研究对感染的微生物进行了形态学和生理生化鉴定,结果表明感染的菌株均属于肠杆菌科埃希氏菌属.选用3种单一的抑菌剂来抑菌,结果表明,无论是在培养基中直接加抑菌剂还是用抑菌剂溶液直接浸泡外植体,只要选择好有效的抑菌剂种类、适宜的处理质量浓度、恰当的处理时间,都能获得较好的抑菌效果.本研究在培养基中加200 mg/L链霉素或300 mg/L α-氨苄青霉素能获得较好的抑菌效果;用100 mg/L链霉素或150 mg/L α-氨苄青霉素浸泡污染外植体6 h也能获得较好的抑菌效果.在后期培养中是否还继续使用抑菌剂及抑菌剂对材料的影响,还有待进一步观察研究.
[1] Samejima K,Samejima J.Studies on the eastern Asiatic Trillium(Liliaceae)[J].Acta Hort Gotob,1962,25:157-257.
[2] Embley T M,Hirt R P,Williams D M.Biodiversity at the molecular level:the domain,kingdo-ms and phyla of life[J].Phil Trans R Soc Lond,1994,B345:21-34.
[3] Templeton A R.Biodiversity by the genetic level:experiences from disparate macroorganisms[J].Phil Trans R Soc Lond,1994,B345:59-64.
[4] Lovejoy T E.The quantification of biodiversity:an esoteric quest or a vital component of sustainable development? [J].Phil Trans R Soc Lond,1994,B345:81-87.
[5]陈振光.园艺植物离体培养学[M].北京:中国农业出版社,1996.
[6]周德庆.微生物学实验手册[M].上海:上海科学出版社,1986.
[7]张纪忠.微生物分类学[M].上海:复旦大学出版社,1987.
[8] Okkels F T,Pederson M G.The toxicity to plant tissue and to agrobacterium tumefaciens of some antibiotics [J].Acta Horticulturae,1983,225:199-207.
[9]杜建中,王景雪,孙毅,等.植物转化过程中影响转化成功的因素分析[J].山西农业科学,2004,32(2):3-7.
[10]李群,陈丽萍,石轶松.马蹄莲组培过程中真菌和细菌污染的消除方法研究[J].四川师范大学学报:自然科学版,2001,24(6):607-609.
[11] Reed B M,Mentzer J,Tanprasert P,et al.Internal bacteria contamination of micropropogated hazelnut:identification and antibiotic treatment[J].Plant Cell,Tissue and Organ Culture,1998,52:67-70.
[12] Kritizinger E M,Vuuren R J V,Woodward B,et al.Plant Cell,Tissue and Organ Culture,1998,52:61-65.
[13] Young P M,Hutchins A S,Canfield M L.Use of antibiotics to control bacteria in shoot cultures o f woody plants[J].Plant Sci Lett,1984,34:203-209.
[14] Reed B M,Buckley P M,De Wilde T N.Detection and eradication of endophytic bacteria from micropropagated mint plants [J].In Vitro Cellular and Developmental Biology,1995,31:53-57.
[15]卢跃敏,郭刚,付习科.三种抗生素对盐桦组织培养初代外植体内生菌的抑制作用[J].农村科技,2010,9:52-53.
[16]杨元,吴兴杰,陈建月.抗生素对两种竹芋组织培养的影响[J].天津农业科学,2012,18(6):121-124.
