Kiss-1对结肠癌SW480细胞增殖的影响
2014-10-04刘迪群吴雪艳
刘迪群,吴雪艳,钟 华
(南华大学附属第一医院消化内科,湖南 衡阳 421001)
结肠癌是我国最常见的消化系统恶性肿瘤之一,其发病率位居第二位,仅次于胃癌,且近年呈现年轻化及上升趋势。转移作为恶性肿瘤的重要生物学特性之一,是涉及到多种生物分子参与的复杂过程,直接关系到肿瘤的分级及分期。目前由于肿瘤患者早期检出率低,大部分患者明确诊断时已发生转移,错过了手术治疗的最佳时期。作为肿瘤的辅助治疗方式之一,放射治疗对改善患者的5年生存率无明显意义[1]。因此,早期诊断结肠癌对提高患者的生存率至关重要。Kiss-1是继nm23之后,由Lee等[2]应用微细胞介导的染色体杂交技术及差减杂交技术在人黑色素瘤细胞株中发现的一种肿瘤转移抑制基因,其定位于染色体1q32-q41,基因序列中包含4个外显子,编码的蛋白kisspeptin是由145个氨基酸组成的亲水性多肽。有研究[3]表明Kiss-1基因与人黑色素瘤、膀胱癌、乳腺癌及肾细胞癌的转移能力呈负相关,直接影响着肿瘤的侵袭与转移。本研究在体外构建高表达Kiss-1的结肠癌SW480细胞株,旨在探讨Kiss-1基因对结肠癌增殖的影响,为结肠癌患者创造新的治疗靶点提供理论依据。
1 材料与方法
1.1 材料
人结肠癌细胞株SW480由湘雅医学院肿瘤研究所惠赠;质粒pEGFP-N1-Kiss-1及空载质粒由上海吉凯公司合成,2种质粒均含有GFP绿色荧光,经测序鉴定无误;质粒小提试剂盒为康为公司产品,脂质体转染试剂盒Lipofectamine2000购自美国invitrogen公司,G418及CCK8试剂盒购自北京索莱宝生物科技有限公司,兔抗人Kiss-1一抗购自武汉博士德生物工程有限公司、二抗购自美国Epitomics公司。
1.2 质粒扩增与提取
LB肉汤2.5 g加入100 mL一级水中配置成25 mg·mL-1的LB液态培养基,高温蒸汽消毒备用。培养基中加入卡那霉素,使其终浓度为30 μg·mL-1。质粒pEGFP-N1-Kiss-1及空载质粒各100 μL分别加入 5 mL LB 培养基中,37 ℃、180 r·min-1震荡 16 h。提取纯化质粒并进行琼脂糖凝胶电泳及分光光度计测量质粒浓度。
1.3 细胞培养、分组与转染
将人结肠癌细胞株SW480培养于含10%胎牛血清的1640培养基中,置于37℃,5%CO2饱和湿度培养箱中培养,细胞生长至90%~95%融合度时将其随机分为3组。1)空白对照组未进行转染。2)实验组用pEGFP-N1-Kiss-1进行转染:用无血清1640培养基将 8 μg pEGFP-N1-Kiss-1 质粒和 10 μL Lipofectamine2000分别稀释至总体积为250 μL,室温下静置5 min;轻轻混匀2种溶液,室温下静置20 min,将混合液加入SW480细胞中,37℃,5%CO2饱和湿度培养箱中培养6 h;吸去培养基,PBS液洗2遍,加入含10%胎牛血清的1640培养基终止转染;42 h 后更换完全培养基,加入 500 μg·mL-1G418筛选,培养3~4 d待细胞大量死亡时,降低浓度至300 μg·mL-1维持筛选4周左右,获得稳定转染细胞。3)阴性对照组用空载体pEGFP-N1进行转染,方法同实验组。
1.4 Western-blot鉴定Kiss-1在SW480细胞中的表达
分别提取空白对照组、阴性对照组及实验组中SW480细胞总蛋白,用BCA试剂盒测定各组样本蛋白浓度,用15%SDS聚丙烯酰胺凝胶跑电泳,每孔上样蛋白量为30 μg,半干转至 PVDF膜,丽春红染色验证后用含5%血清的TBST封闭,依次结合对应一抗及辣根过氧化物酶标记的二抗,最后暗室曝光显像,检测Kiss-1表达的变化。
1.5 CCK8法检测细胞增殖情况
已处对数生长期的各组细胞用0.25%胰酶消化,制成细胞悬液接种于 96孔板内(2×103孔-1)定容至100 μL培养,每组细胞设3个复孔,同时设置3个空白孔(只含细胞培养基)。分别于0、24、48及72 h每孔加入5 μL CCK-8溶液,5%CO2及饱和湿度培养基继续孵育2 h,检测450 nm光谱下的吸光度,根据每天吸光值的均数绘制细胞生长曲线。
1.6 统计学方法
2 结果
2.1 SW480细胞转染质粒及筛选
SW480细胞转染质粒后24 h,在荧光显微镜下观察细胞,可见绿色荧光。经过4周的G418筛选,G418 维持浓度为 300 μg·mL-1,视野里几乎所有细胞都带有绿色荧光蛋白。停用G4181周,荧光显微镜下观察绿色荧光基本保持不变。稳定转染细胞株筛选成功。
2.2 Kiss-1在SW480细胞中的表达
Kiss-1在空白对照组、阴性对照组与实验组中的表达见图1,结果显示:Kiss-1在实验组中高表达,而在空白对照组及阴性对照组中低表达,3组比较差异有统计学意义(P<0.05)。结果提示,Kiss-1 基因在SW480-Kiss-1细胞中能稳定、高效地表达。
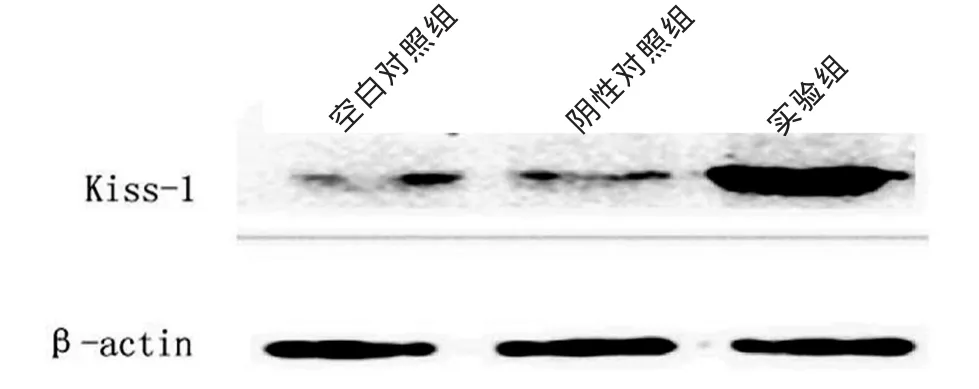
图1 稳定转染后Western-blot检测Kiss-1在SW480细胞中的表达
2.3 Kiss-1对SW480细胞增殖的影响
3组培养各时段SW480细胞数比较见表1,3组SW480细胞生长曲线见图2。结果显示:培养0、24 h时各组SW480细胞数差异无统计学意义(P>0.05),48 h 后,随着培养时间延长,实验组 SW480细胞数明显低于空白对照组与阴性对照组(P<0.05),而空白对照组与阴性对照组SW480细胞数差异无统计学意义(P>0.05)。 结果提示,Kiss-1 可抑制SW480细胞的增殖。
表1 3组培养各时段SW480细胞数比较 ,×104个
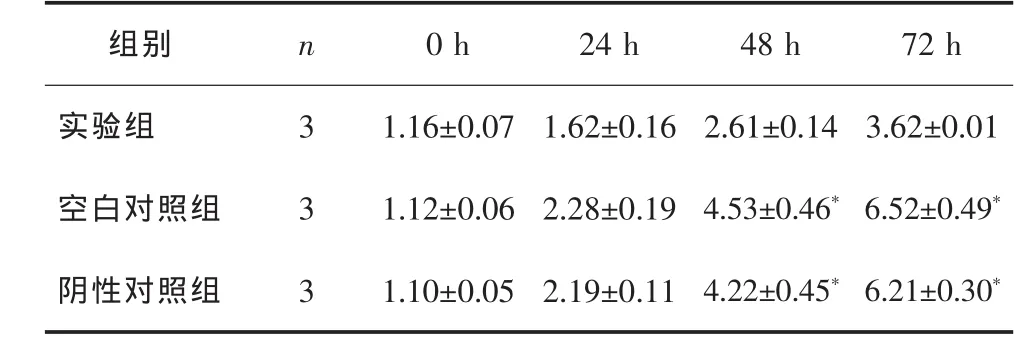
表1 3组培养各时段SW480细胞数比较 ,×104个
﹡P<0.05 与实验组比较。
组别 n 0 h 24 h 48 h 72 h实验组 3 1.16±0.07 1.62±0.16 2.61±0.14 3.62±0.01空白对照组 3 1.12±0.06 2.28±0.19 4.53±0.46*6.52±0.49*阴性对照组 3 1.10±0.05 2.19±0.11 4.22±0.45*6.21±0.30*

图2 3组SW480细胞生长曲线
3 讨论
肿瘤转移是一个涉及到肿瘤细胞与宿主细胞相互作用的多级过程。肿瘤细胞从原发肿瘤中分离,经血循环及淋巴循环系统转移至远处,黏附于内皮细胞、分解基质、外渗,最终在转移部位无限制增殖,导致转移性肿瘤发生[4]。多种癌基因与抑癌基因参与肿瘤的发生与发展过程。Kiss-1是近来颇受关注的一种肿瘤转移抑制基因,其在多种人体组织中发挥转移抑制作用[5]。它的基因结构由4个外显子区域组成,外显子Ⅰ与外显子Ⅱ为非编码区,外显子Ⅲ的结构依次为翻译起始位点、38个非编码碱基及103个编码碱基,外显子Ⅳ含335个翻译碱基、翻译终止点、多腺苷酸化信号和121个非编码碱基[3]。Kisspeptin作为一种145个氨基酸残基组成的亲水性多肽进一步水解成多种小分子多肽,其中一种水解产物kisspeptin-54又名metastin,是G-蛋白偶联受体的配体。Ringel等[6]发现Metastin及其受体有着调节甲状腺癌细胞生物学活性的作用。在转移性膀胱癌组织中,Kiss-1的表达水平明显低于浅表膀胱癌[7]。研究表明相对于Kiss-1高水平表达的胃癌患者,低表达患者更容易发生远处转移和复发,且其死亡率明显增高[8]。 可见,Kiss-1 表达水平高者,肿瘤发展慢,预后好。
本研究结果发现,Kiss-1重组质粒转染SW480细胞后,SW480细胞的体外增殖能力从细胞周期的48 h开始明显下降,差异有统计学意义。因此,推测Kiss-1基因能有效抑制结肠癌SW480细胞的增殖能力,从而影响结肠癌的发展。但其具体作用机制有待进一步研究证明,以便为今后结肠癌患者的早期诊断及靶向基因治疗提供理论依据。
[1]Zong X Y,Shi Y Q.An audit of outcomes in colorectal cancer in China[J].Eur J Surg Oncol,2007,33:169-173.
[2]Lee J H,Miele M E,Hicks D J,et al.KiSS-1,a novel human malignant melanoma metastasis-suppressor gene[J].J Natl Cancer Inst,1996,88:1731-1737.
[3]West A,Vojta P J,Welch D R,et al.Chromosome localization and genomic structure of the KiSS-1 metastasis suppressor gene[J].Genomics,1998,54:145-148.
[4]Perlikos F,Harrington K J,Syrigos K N,et al.Key molecular mechanisms in lung cancer invasion and metastasis:acomprehensivereview[J].Crit Rev OncolHematol,2013,87:1-11.
[5]Pentheroudakis G, Kostadima L, Dova L,et al.A twisted kiss:in vitro and in vivo evidence of genetic variation and suppressed transcription of the metastasis-suppressor gene KiSS-1 in early breast cancerI[J].Neoplasma,2010,57:47-54.
[6]Ringel M D,Hardy E,Bernet V J,et al.Metastin receptor is overexpressed in papillary thyroid cancer and activates MAP kinase in thyroid cancer cells[J].J Clin Endocrinol Metab,2002,87:2399.
[7]Sanchez Carbayo M,Capodieci P,Cordon Cardo C,et al.Tumor suppressor role of KiSS-1 in bladder cancer:loss of KiSS-1 expression is associated with bladder cancer progression and clinical outcome[J].Am J Pathol,2003,162:609-617.
[8]Dhar D K, Naora H, Kubota H,et al.Downregulation of KiSS-1 expression is responsible for tumor invasion and worse prognosis in gastric carcinoma[J].Int JCancer,2004,111:868-872.
