水系锂离子电池电极材料研究进展
2014-09-21刘未未王保峰
刘未未,王保峰,李 磊
(1上海交通大学化学化工学院,上海 201100;2上海电力学院环境与化学工程学院,上海 200082)
随着经济的发展和人口的增长,矿物燃料日益枯竭,带来了能源危机,新能源的开发利用迫在眉睫,可再生能源(风能、太阳能等)的研究受到了广泛关注,然而这些可再生能源却受时间和季节的限制。因此,需要研究开发储能系统以便高效利用能源,锂离子电池装置是实现储能的技术之一。在电池的发展历程中,锂离子电池以其优异的性能逐渐胜出。锂离子电池拥有最高的能量密度,约为120~200 W·h/kg[1]。然而现在商业化的锂离子电池基本上都采用有机体系做电解液,有机溶剂的毒性和易燃性给其应用带来了很多负面影响,在不恰当的使用条件下(如过充、过放、短路等)会导致着火甚至爆炸等事故的发生。因此,国内外科研工作者把目光转向了水系锂离子电池。水系锂离子电池具有以下优点:①功率较高,水系锂离子电池的电导率一般比有机体系高一到两个数量级;②成本较低,有助于工业化生产;③环境污染小。但由于水本身分解电压低(1.23 V),导致能量密度降低,并且考虑到氢氧析出的过电位,其稳定的工作电压很难超过2 V,所以工作电压应在1.3~2.0 V。水系锂离子电池的容量在充放电循环中衰减很快,至于衰减机理和正负极材料的适用性,科研界尚未达成共识。
1994年,Dahn等[2]首次提出水系锂离子电池的概念。在这种新型水系锂离子电池中,Li2SO4或LiNO3水溶液作为电解质,负极采用 VO2,正极采用LiMn2O4。虽然在正极发生的析氧反应导致电池的实际能量密度接近40 W·h/kg,但依然大于铅酸电池,与镍镉电池相当。但由于电极材料在水溶液里的分解以及电极材料的结构变化,导致电池性能快速衰减,循环性能很差。近年来,随着科研工作者的不断努力,一些新的材料被运用到水系锂离子电池中。图1为水在不同pH值条件下的析氢电位和 析氧电位以及一些电极材料在c(Li+)=1 mol/L时的锂离子嵌入电位。原则上讲,低于氧气析出电位的材料可作阴极,因此电位在3~4 V之间的材料,如LiCoO2、LiNiO2和LiFePO4等可用作阴极;高于氢气析出电位的材料可作阳极,因此电位在2~3 V之间的材料可作阳极,如VO2和LiV3O8等。

图1 水在不同pH值下的稳定电位区间(左)和几种嵌锂化合物嵌锂电位(右) Fig.1 H2O stability region for the entire pH range (left)and the potentials for Li+ de/intercalation for some selected oxide compounds relative to Li metal (right)
近年来,开发新型高性能水系锂离子电池的电极材料已经成为国际研究的热点。本文介绍了目前各国研究者在开发新型电极材料方面的研究进展,主要分为负极材料、正极材料和对电极材料进行改性的方法三部分。
1 水系锂离子电池负极材料
考虑电池的工作电压和水溶液的稳定,常用的负极材料有 VO2和 LiV3O8等,但是通常情况下这些材料的稳定性较差,限制了电池的比容量和循环性能,因此改善负极材料的稳定性是提高水系锂离子电池性能的关键之一。表1是文中各种负极材料的主要类型及性能。
1.1 LiV3O8
研究者发现,影响水系锂离子电池循环性能的主要原因在于负极材料的选择,LiV3O8相对稳定且成本较低,引起研究者的广泛兴趣,尤其是国内研究者更是对负极材料 LiV3O8的研究投入了大量精力。
2000年,Toki等[3]报道了负极采用LiV3O8,正极采用LiNi0.81Co0.19O2,电解液为Li2SO4溶液的水系锂离子电池(正负极配比为 1∶1)。当电压上限设为1.3 V时,放电容量约为 20 mA·h/g,30次充放 电循环后,放电容量保持率为80%,100次充放电循环后,放电容量保持率为40%;而当电压上限设为1.9 V 时,放电容量为 40~45 mA·h/g,30 次充放电循环后,放电容量保持率为70%,100次充放电循环后,放电容量保持率为25%。他认为电池的循环性能受正极和负极尤其是负极性能的影响。X射线衍射表明多次循环后,LiV3O8的晶体衍射峰强度降低,出现了新物质(如LiV2O5、V2O5)的衍射峰,表明负极材料LiV3O8有额外损耗,从而导致了循环性能的下降。
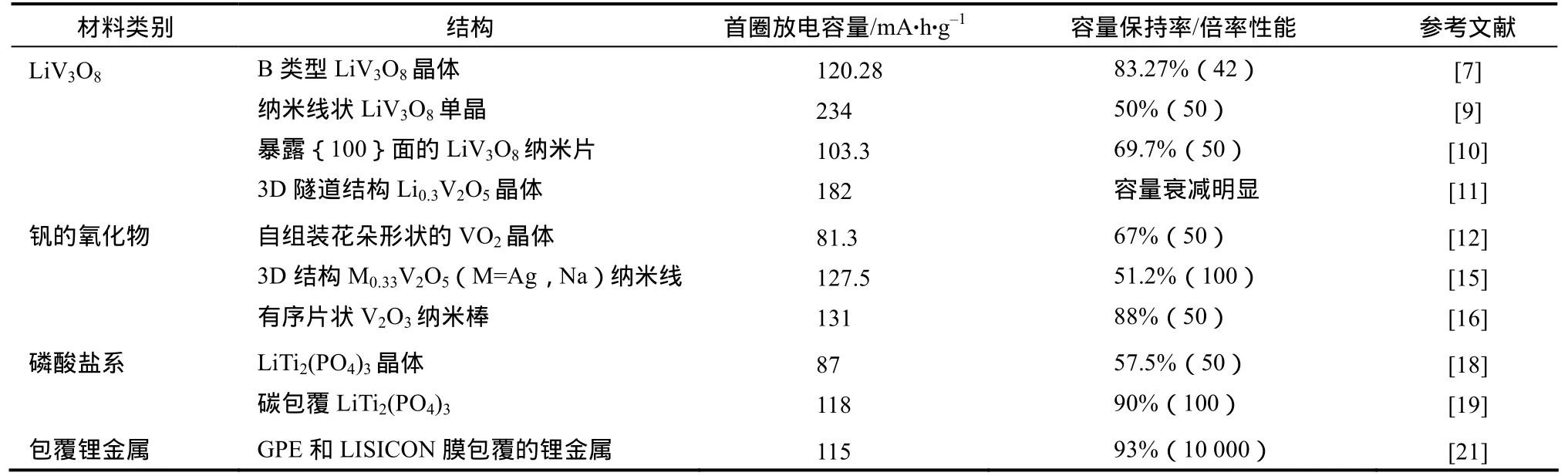
表1 水系锂离子电池负极材料的主要类别和性能 Table 1 The major categories and performance of anode materials in aqueous lithium ion battery
2007年,Wu等[4]报道了一种采用LiV3O8作负极,LiCoO2作正极,电解液为LiNO3饱和溶液的水系锂离子电池。电池放电电压为1.05 V,起始放电容量约为 55 mA·h/g,比在相应非水电解液锂离子电池中低,然而比容量与铅酸、镍镉电池相当,输出电压与镍氢电池相当,比镍镉电池高。40次充放电循环后,放电容量保持率为65%;100次充放电循环后,放电容量保持率为36%。作者认为水中的副反应很少,水系锂离子电池的容量衰减可通过调整电解液的组成以及选择不同的电极材料等方法来改善。同年,Wu等[5]又研究了一种水系锂离子电池,采用 LiV3O8作负极、LiMn2O4作正极、电解液为2mol/L 的 Li2SO4溶液,放电电压为 1.04 V。在 0.2 C倍率下充放电,初始放电容量为55.1 mA·h/g,100次充放电循环以后,容量保持率为53.5%;200次充放电循环以后,容量保持率为36.7%;400次充放电循环以后,放电容量仍然保持在10 mA·h/g以上。作者认为该体系电池能量密度与镍镉、铅酸可充电池相当,使用的材料却比镍镉、铅酸电池环保,可作它们的替代品。最重要的是该体系电池尽管比容量比相应的非水体系锂离子电池低,但却具有良好的循环性能。
2010年,Li等[6]报道了一种水系锂离子电池,负极采用Li1.2V3O8,正极采用传统的LiMn2O4,电解液为1.0 mol/L的 Li2SO4溶液。负极材料是一种含有介孔结构的Li1.2V3O8纳米材料,其起始放电容量在 0.1 C、0.5 C、1.0 C 时分别达到了 189 mA·h/g、140 mA·h/g、101 mA·h/g;10 次循环以后,Li1.2V3O8材料放电容量在 0.1 C、0.5 C、1.0 C 时分别为 136 mA·h/g、112 mA·h/g、85 mA·h/g,分别为起始放电容量的72%、80%、84%;100次循环以后,Li1.2V3O8材料放电能量在 0.1 C、0.5 C、1.0 C 时分别为起始放电容量的 36%、38%、37%。他们认为负极材料的介孔结构一方面促进了锂离子的嵌入,另一方面也加速了负极材料Li1.2V3O8在电解液中的分解,从而导致容量的衰减。
2011年,Zhao等[7]报道了一种水系锂离子电池,正极采用LiMn2O4,负极采用LiV3O8,电解液采用饱和LiNO3溶液。分别用两种方法制备了两种正极材料(LiMn2O4),用 Li2CO3和 MnO2以 0.51︰2的配比,350 ℃烧结 12 h,然后 800 ℃烧结 24 h,制得LiMn2O4(样品A);同样的原料配比,加入质量分数为20%的C12H22O11,制得LiMn2O4(样品B)。负极材料LiV3O8采用Li2CO3和V2O5以1.02︰6 的配比,680 ℃烧结 12 h,然后 350 ℃继续烧结8 h制得。正负极材料在电解液中稳定,不发生析氧析氢反应,实验结果表明,正极材料为LiMn2O4的水系锂离子电池比容量与普通有机体系锂离子电池比容量相当,这是比较大的突破。此外,电池循环性能良好,对于 LiV3O8/LiMn2O4(A)体系,第一个充放电循环的充电容量为134.3 mA·h/g,放电容量为 113.5 mA·h/g;25次充放电循环后,放电容量为100.29 mA·h/g,容量保持率为88.1%;42次充放电循环以后,放电容量为90.33 mA·h/g,容量保持率为 78.7%。对于 LiV3O8/LiMn2O4(B)体系,第 一个充放电循环的充电容量为127.46 mA·h/g,放电容量为120.28mA·h/g;24次充放电循环后,放电容量为 110.66 mA·h/g,容量保持率为 92%,库仑效 率达到 94%;42 次充放电循环以后,放电容量 为 100.16 mA·h/g,容量保持率为 83.27%,库仑效率为85.96%。
然而,Morales等[8]却认为 LiV3O8不适合作电极材料。他们在保证研究结果与 Dahn的观察结果一致的基础上发现,尽管层状结构LiV3O8有利于锂离子发生可逆的嵌入、脱出反应,但恰恰是这种层状结构的 LiV3O8与水接触后导致电极材料额外损耗,进而导致循环性能差,说明这种材料在通常的电池环境中是不稳定的。他们认为锂离子水合作用趋势强,水分子可能会协同插入LiV3O8层状结构,从而导致电极材料膨胀,导致LiV3O8材料的分解,所以Morales认为LiV3O8不适合做电极材料。
近年来,采用特殊方法合成的具有规整结构的纳米LiV3O8晶体受到科研人员的青睐。结构的规整性可以提供稳定的离子通道,有利于锂离子在电极中可逆运动,可以同时提高电极的比容量和循环可逆性。2010年,Zhou等[9]首次用水热法一步合成了纳米线状LiV3O8单晶,其结构如图2所示。由图可以看出,所合成的LiV3O8晶体结构较为规整,宽度均在50 nm左右。实验表明,锂离子在其中有很好的可逆性。以 5 mol/L的 LiNO3和 0.001 mol/L的LiOH溶液作为电解液,在0.1 A/g的电流密度下可获得234 mA·h/g的放电容量,且循环50次后依然有超过70%的容量保持率,说明其比容量和循环性能明显优于其它钒的氧化物。同年,Heli等用低温柠檬酸溶胶-凝胶燃烧法合成了具有紧密纳米层状结构的LiV3O8晶体,晶片厚度为2~5 µm。晶片是由VO6八面体和VO5三角双锥两种晶胞组成的,具有很好的结构稳定性。电池的充放电容量为 63 mA·h/g,比一般结构的LiV3O8高出35%左右。
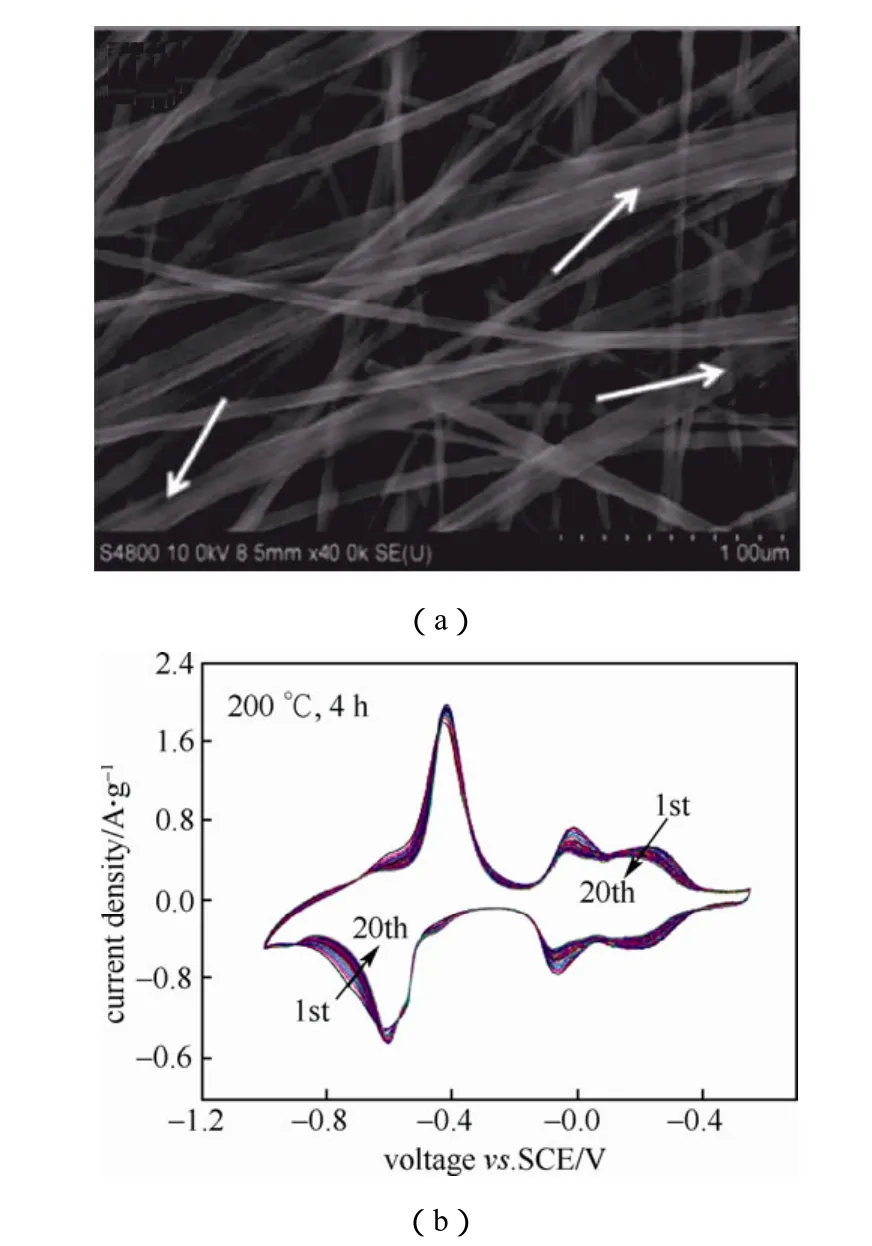
图2 单晶LiV3O8纳米线的SEM图(a)及氩气下200 ℃热处理4 h所得LiV3O8纳米线的CV曲线(b) Fig.2 SEM image of the synthesized LiV3O8nanowires(a) and CV curves of the sample after heat treatment at 200 ℃for 4 h under pure Ar (b)
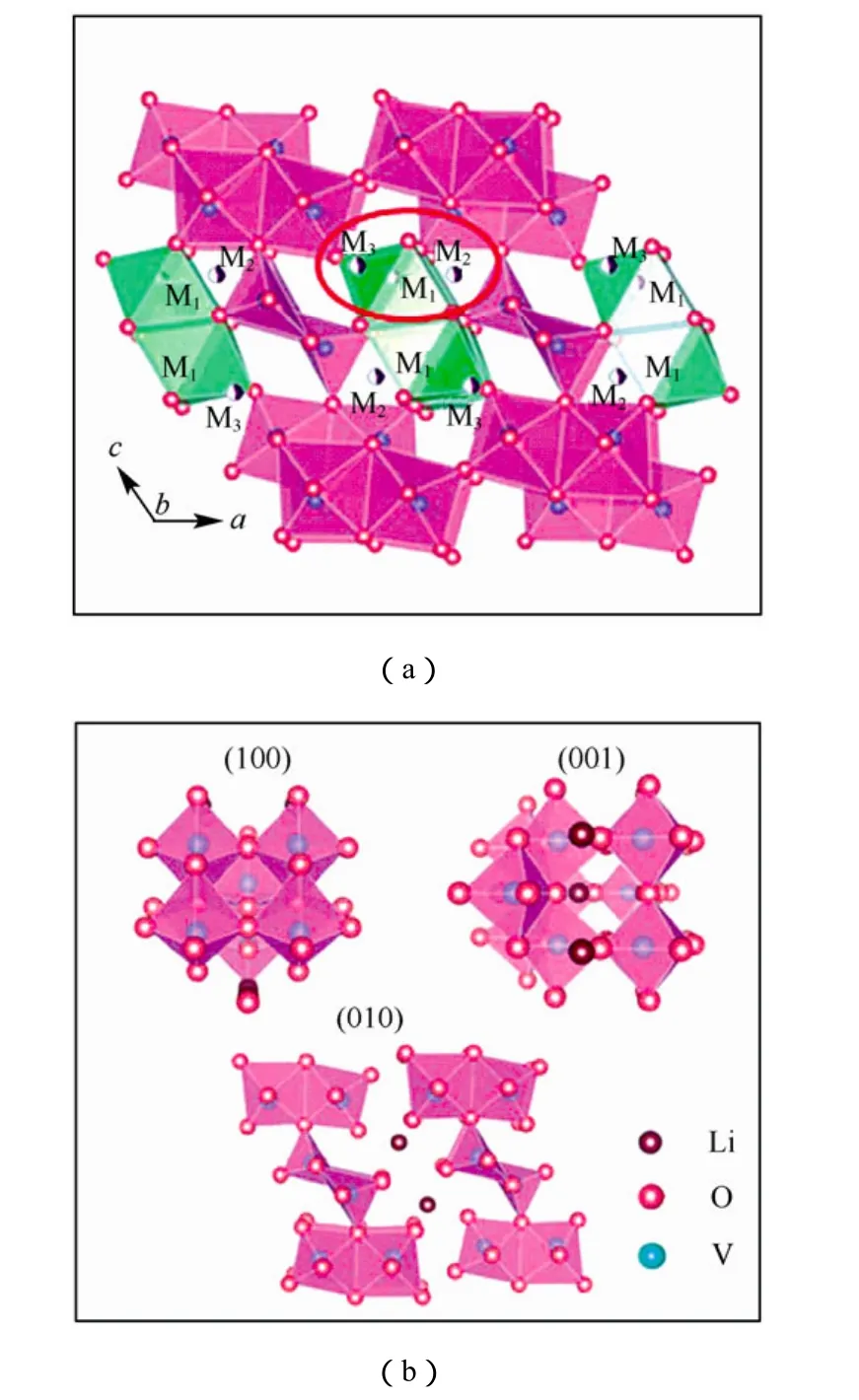
图3 Li0.3V2O5晶体结构的投影以及嵌入的阳离子可能存在的位置(a)与Li0.3V2O5晶体不同表面的原子结构(b) Fig.3 Projection of the crystal structure of Li0.3V2O5on the ac plane and possible positions of the inserted cations (a)and the surface atomic configurations for the different facets in Li0.3V2O5(b)
2012年,Xie等[10]用静电纺丝技术纺出的聚乙烯醇为模板,合成了以暴露(100)面的LiV3O8纳米片组成的层状纳米纤维,其结构如图3所示。聚 乙烯醇在合成过程中具有双重作用,作为模板的同时也防止了LiV3O8纳米粒子的团聚,使电极具有较好的稳定性。这种材料的优点在于LiV3O8纳米片的(100)面具有较少且更细的离子通道,有效阻止了H+的进入,从而具有更大的放电容量和更好的循环稳定性。以LiMn2O4为阴极组装电池,最高放电容量达到103.3 mA·h/g,且50次容量保持率为69.7%,比其它方法合成的LiV3O8性能更优。
2013年,Xie等[11]通过简单的全固态法合成了具有刚性的 3D隧道晶体结构 Li0.3V2O5晶体。在Li0.3V2O5晶体中,每4个VO6八面体共用棱和角以形成连续的[V4O11]n层,五连的方锥体以及 VO5链作为支柱连接相邻的两层,从而形成刚性的隧道结构。他们认为,隧道结构为锂离子插入提供了不同的位点,并且为其提供快速的扩散通道,因此有助于提高电池的比容量和倍率性能。此外,由于Li0.3V2O5具有较好的导电性和离子传导性,因此在高倍率下依然可以保持较高的比容量。用 LiCoO2作正极与其组成的电池在60 mA/g的电流密度下首次充放电容量达到 182 mA·h/g,在 120 mA/g 的电流密度下放电容量为180 mA·h/g,比其它钒的氧化物比容量高很多。但是在不同倍率下的测试结果表明,高倍率下其比容量有较大的衰退。
1.2 钒的氧化物
钒的氧化物具有能量密度高,循环性能好等优点,但是在水溶液电池中容易发生电极溶解。若在VO2表面包覆一层碳,形成VO2/C核壳结构可明显减缓VO2的溶解,从而提高电极的循环稳定性和比容量。碳层的存在还有利于提高电极的导电性,并形成较高的比表面积和较短的离子通道,有助于同时提高电极的比容量和倍率性能。
近年来,3D结构的晶体引起大家广泛的兴趣。3D结构具有较高的比表面积和良好的力学性能,因此具有较好的循环稳定性。2009年,Xie等[12]合成了一种由纳米晶片自组装形成的具有花朵形状的VO2晶体,首次放电容量达到了74.9 mA·h/g,若对前驱体进行煅烧则可以得到具有更高结晶度的VO2晶体,其首次放电容量可达到81.3 mA·h/g,在充放电50次后其放电容量依然可达54.8 mA·h/g,约为首次放电容量的67%。2010年,Xie等[13]又合成了单晶 H2V3O8纳米线,这种材料对锂离子的嵌入有较好的选择性,因此获得了很高的放电容量(234 mA·h/g)。此外,由于纳米层间有氢键的相互作用,因此材料性能稳定,具有很好的循环稳定性。
同年,Xie等[14]用类似的方法合成了 CuV2O5纳米带,并在不同pH值条件下测试其容量变化,结果发现电解质pH值为8.5左右时最为合适,因为适当的碱性可以减少H+的浓度和水合作用,而更强的碱性会增加电极材料的溶解。
2011年,Xie等[15]合成了一种亚稳态多孔海胆状的 V2O3晶体。他们先用溶剂热制备钒乙烯乙醇酸(VEG)作为前驱体,之后在惰性气氛下将其热解,制备出的 V2O3具有体心立方铁锰矿结构,并在510 ℃以上热处理,使其从热力学稳定的菱面体向对称的亚稳立方形对称构造演化。同年,他们又合成了结构均一的M0.33V2O5(M=Ag,Na)纳米线。研究发现,与 2D结构相比,这种晶体中存在锯齿形锥形链连接了[V4O11]n层,从而形成3D稳定结构。实验表明,电池首次放电容量达到127.5 mA·h/g,且随着电流密度的增大,电池的首次放电容量差别减小。XRD表明,在循环100次之后,电极的晶体结构基本没有改变,且容量保持率达到51.2%。图4和图5是上述几种结构的示意图。

图4 自组装形成的具有花朵形状VO2晶体的SEM图像(a)及亚稳态多孔海胆状V2O3晶体的SEM图像(b) Fig.4 SEM images of the as-prepared flowerlike VO2(a)and SEM image of the porous urchin-like V2O3(b)
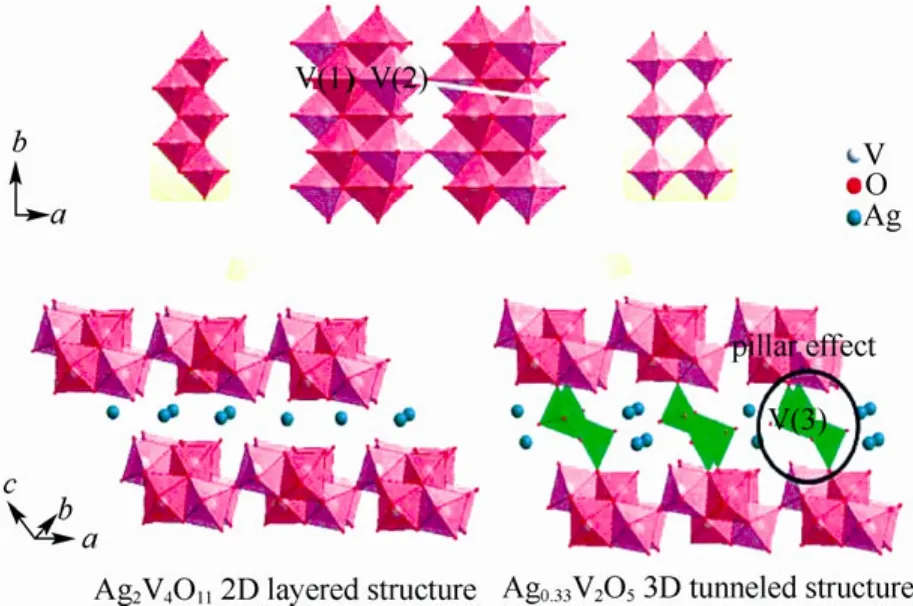
图5 M0.33V2O5(M=Ag, Na)晶体的2D和3D结构对比图 Fig.5 A crystal 2D and 3D structure comparison chart
此外,该研究组[16]还用一种温和的非水方法合成了一种有序片层状的有机无机交织的 V2O3纳米棒,这种方法实现了有序纳米棒的克量级合成,且其中的纳米片层厚度只有 0.65 nm,在合成方法上有突破性意义。这种电极材料具有很高的放电容量(131 mA·h/g)及容量保持率(50次后容量保持率达到88%),远高于普通V2O3晶体,这些优点都得益于其层状的宏观结构和有机-无机复合的微观结构,这使得电解液更易渗透,增大了接触面积,从而缩短了锂离子的传输距离,增加了储存位点;此外,复合结构的存在还减小了电极在充放电过程中的体积变化率,保证了结构的稳定。这种复合结构在电极的制作上是很有启示意义的。
1.3 磷酸盐系
2007年,Chen等[17]报道了正极采用LiMn2O4,负极采用 TiP2O7和 LiTi2(PO4)3,电解液为 LiNO3溶液的水系锂离子电池。其中TiP2O7作负极的水系锂离子电池平均工作电压为1.40 V,放电容量约为42 mA·h/g,10次充放电循环后,放电容量保持率为起始容量的85%;而LiTi2(PO4)3作负极的水系锂离子电池平均工作电压为 1.50 V,放电容量约为 45 mA·h/g,10 次充放电循环后,放电容量保持 率为起始容量的75%。他们认为正极材料LiMn2O4在水溶液中是稳定的,负极材料TiP2O7晶体结构的分解和新物质的形成导致了整个电池容量的衰减。
2009年,Okada等[18]报道了一种正极为LiMn0.05Ni0.05Fe0.9PO4,负极为LiTi2(PO4)3,电解液为饱和Li2SO4溶液的水系锂离子电池。电池初始放电容量为87 mA·h/g,是正极理论放电容量的一半。在开始的几个充放电循环中,充电容量和放电容量相差很大,然而充放电效率却达到了98%。50次循环以后,放电容量为50 mA·h/g。通过控制充放电循环电压范围,在所有循环过程中,都没有检测到析氧析氢反应,并且电解液中没有溶解金属离子,始终保持中性、无色。
2011年,Wessells等[19]报道了一种新的水系锂离子电池材料,负极采用碳包覆LiTi2(PO4)3,正极采用部分脱锂的LixMn2O4,电解液为pH值为2的2 mol/L的Li2SO4溶液。工作电压为1.50 V,起始放电容量为118 mA·h/g,在0.2 C充放电条件下,100次充放电循环以后,放电容量保持率为开始的90%,库仑效率基本保持在98%。他们认为电解液的分解导致了库仑效率的降低,可通过提高终止电压来改善库仑效率;或通过减少电极与电解液的接触时间也可以减少电解液的分解,因此高倍率充放电时,库仑效率更高。
2013年,Cui等[20]采用溶胶-凝胶法合成了LiTi2(PO4)3,并用 LiTi2(PO4)3作负极组装电池,电解液为1 mol/L 的Li2SO4,恒流充放电测试发现其首次充放电容量仅为57.56 mA·h/g和44.41 mA·h/g,且60次后容量保持率只有67.3%。阻抗测试表明,电池内阻由肖特基接触电阻和电子传输电阻两部分组成,研究人员分别对两者给出了相对于电压的变化关系,对后继研究具有很大的启示意义。
1.4 包覆锂金属
2013年,Wu等[21]采用GPE和LISICON膜包覆的锂金属作负极,以0.5 mol/L的 Li2SO4作电解液,LiMn2O4作正极组装电池,得到了同时具有高容量与高能量密度以及良好循环稳定性的电池,且体系比较安全,具有很大的应用潜力。电池的平均电压达到4 V,为动力学电位差,而理论上水系电池的热力学电位窗口为1.229 V,因此电池依然是稳定的,其原因如图6所示。电池的能量密度为446 W·h/kg,比普通锂离子电池高出80%。电池循环性能很好,10 000次循环后容量保持率仍然达到93%。此外,它还具有价格低廉、环境友好等优点。GPE和LISICON膜的存在抑制了锂枝晶的形成,保证了电池的安全性和循环稳定性,在极限情况下,即GPE和 LISICON膜破损的时候,电解液中的锂盐会与锂金属反应形成不溶物,且形成的气体较容易散发出去,电池不会发生危险。此外,由于正负电极直接与电解液接触,水的高热容保证了电池系统温度的稳定。这些优点使其在电动车或大容量储能方面有良好的应用前景。
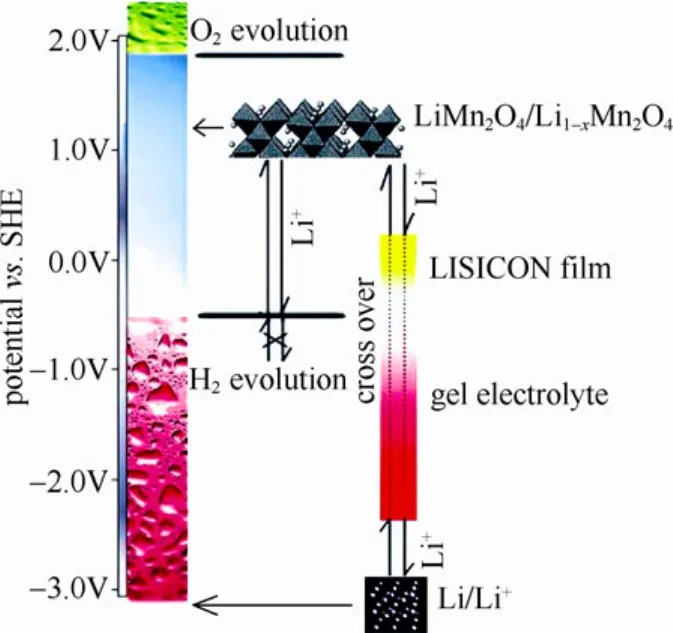
图6 碳包覆锂金属作负极的水系锂离子电池具有更高电压的原理解释图 Fig.6 Schematic illustration of higher voltage of aqueous lithium-ion battery with coated lithium metal as anode
2 水系锂离子电池正极材料
LiCoO2、LiMnO2、LiFePO4在有机体系锂离子电池中是常用的正极材料,在众多水系锂离子电池 研究中,也作为正极材料被广泛研究,考虑LiCoO2和 LiMnO2作为电极材料的嵌入电位以及充电时的析氧反应和嵌入/脱出反应的稳定性,LiMnO2适合在pH值7~9、LiCoO2适合在pH值11~12的溶液中作电极材料。采用LiFeO4作为正极材料的水系锂离子电池中,锂离子的嵌入/脱出行为与在有机体系锂离子电池中相似[22]。表2是各种正极材料的主要类型及其性能。
2.1 LiCoO2
LiCoO2是最早应用于锂离子电池的正极材料,具有放电电压高、易于合成、稳定性高等优点,但是由于钴金属的价格较为昂贵,且对环境污染大,近年来LiCoO2的使用正在逐渐减少。传统LiCoO2晶体的合成方法是固态法,但是此法不易制备出均匀且粒径小的晶体,下文将介绍近年来合成LiCoO2的新方法。
2009年,Huggins等[23]采用层状材料 LiCoO2作工作电极,层状材料 Li0.5Mn2O4作对电极,Ag/AgCl(3mol/L KCl)作参比电极,电解液采用pH=7的5 mol/L的LiNO3溶液。在1 C倍率充放电时,初始放电容量为113 mA·h/g,90次充放电循环以后,放电容量为105 mA·h/g,显示出良好的循环 性能,并且在循环过程中库仑效率保持为 99.7%。Huggins经过验证,该水系锂离子电池在 pH=7的 5 mol/L的LiNO3溶液中具有最佳的循环性能,并 且可以进行高倍率充放电。
2010年,Tong等用左旋苹果酸辅助下的溶胶-凝胶法合成了层状 LiCoO2晶体,这种方法比传统的固态合成方法更快,且所得 LiCoO2晶体粒子更小。实验证明,随着烧结温度的提高,其库仑效率和比容量均得到提高。750 ℃下其充放电比容量分别为 124.5 mA·h/g 和 115.1 mA·h/g。他们认为,高的烧结温度有助于形成层状结构,利于锂离子的嵌入/嵌脱,因而具有较高的比容量和库仑效率。
2010年,Wu等[24]报道了一种水系锂离子电池,工作电极采用纳米粒子 LiCoO2,对电极采用活性炭,甘汞电极为参比电极,电解液采用 0.5 mol/L的 Li2SO4溶液。在恒定电流密度为 1000 mA/g(7 C)时,LiCoO2起始放电容量为 143 mA·h/g;在恒定电流密度为 5000 mA/g(35 C)时,LiCoO2起始放电容量为 135 mA·h/g;在恒定电流密度为 10 000 mA/g(70 C)时,LiCoO2起始放电容量为 133 mA·h/g。在40次充放电循环中,放电容量基本没有衰减,库仑效率在第一次充放电循环中为 92.5%,这与有机体系锂离子电池相当,在接下来的40次充放电循环中库仑效率基本保持在97%左右。吴宇平教授认为纳米粒子可能在充放电循环过程中填补 LiCoO2的结构扭曲,进而带来良好的循环性能。
2011年,Ruffo等[25]认为层状结构LiCoO2具有以下优势:工作电压范围与LiMn2O4相当、高充放电效率、良好的循环性能、高倍率充放电等,在适当的条件下,会有良好的电化学行为。在 5 mol/L的 LiNO3溶液中,LiCoO2作工作电极,采用Li0.5Mn2O4作对电极,Ag/AgCl(3.5 mol/L 的 KCl)作参比电极。锂离子可以很容易地嵌入/嵌脱LiCoO2,并且有很好的循环性能,在20 C的高倍率下,3 min完成充放电,还可以保持良好的容量(大约 90 mA·h/g)。在1 C倍率下,200次循环以后,容量保 持率为82%,工作电压为1.40 V时放电容量为135 mA·h/g,库仑效率为98.5%。Ruffo认为,这种良好的电化学行为是由高电导率(室温0.17 S/cm)决定的,另外高浓度电解液和低溶液黏度都对其有良性的影响。

表2 水系锂离子电池正极材料的主要类别和性能 Table 2 The major categories and performance of cathode materials in aqueous lithium ion battery
2013年,Mahesh等[26]在高温及自生压力条件下合成出LiNi0.8Co0.2O2,并用作锂离子电池阴极材料。由于反应时间较短且节能,因此在商业应用上有较大潜力。电化学阻抗测试(EIS)证明在水溶液中嵌脱锂离子的原理与在有机电解质中一致,所计算出的化学扩散系数也相近,说明此材料在两种情况下均有较好的化学稳定性。组装 LiTi2(PO4)3/2mol/L Li2SO4/LiNi0.8Co0.2O2电池测试,结果证明其循环稳定性比有机体系更好,充放电100次后容量保持率仍高于 95%。阻抗测试表明,在水溶液体系中电极表面没有形成有效的SEI膜,因此电池内阻较小,适合用于大电流放电。充放电测试也证明了这一点,在倍率为C/5 时电池容量为 65 mA·h/g,5 C 时为 40 mA·h/g,两者相差并不大,因此适宜在大电流放电的情况下使用。
同年,Shivashankaraiah等[27]又用类似的方法合成具有层状结构的LiNi1/3Mn1/3Co1/3O2材料,之后与聚吡咯物理混合,增强粒子间的紧密性,从而减小电极阻抗。循环伏安测试和阻抗测试表明,聚吡咯的加入明显减小了电子传输阻抗,增加了电池的可逆性和容量。实验证明,加入质量分数为 10%的聚吡咯效果最好,此时电池充放电循环70次后容量保持率达到70%,远高于纯的LiNi1/3Mn1/3Co1/3O2材料。
2.2 LiMn2O4
尖晶石型 LiMnO2的骨架是 MnO2四面体和八面体组成的三维网络,比较有利于锂离子的嵌入/嵌脱。锰氧系化合物作为水溶液锂离子电解质的正极具有来源广、制作简单、比容量高等优点,但是在充放电过程中,晶格中的锰离子易发生歧化反应而溶于水溶液,因而在循环过程中会导致严重的容量衰退。此外,在放电过程中,LiMnO2八面体相易发生畸变形成不稳定的四方相。且在不同 pH值溶液中水的分解电压不同,因此溶液酸度不同,所得电池的电位差也不同。
2009年,Mentus等[28]用 LiMn2O4作正极,含水 V2O5凝胶作负极,电解液采用 LiNO3溶液,起始放电容量为69 mA·h/g,100次充放电循环以后,放电容量保持率为起始的 89%,并且在前 30次循环中容量衰减明显,后面循环中衰减很弱。他们认为这种体系比钒氧结晶化合物(VO2、LixV2O5、LixV3O8)具有更好的锂离子嵌入效果。
2011年,Wu等[29]进行了LiMnO2正极材料的研究,采用纳米级链状 LiMnO2作工作电极,活性炭作对电极,电解液采用0.5M的Li2SO4溶液。这种特殊的正极材料带来了良好的循环性能和较高的放电容量,4.5 C充放电时,充放电容量为 110 mA·h/g;91 C 充放电时,充放电容量为 95 mA·h/g;136 C 充放电时,充放电容量为 92 mA·h/g。并且 200次循环内,容量基本没有衰减,具有良好的循环性能。他们认为,由于这种正极材料特殊的纳米结构,缩短了锂离子扩散的距离,使锂离子的嵌入/嵌脱更容易,从而实现较高的充放电容量和库仑效率。
2013年,Wu等[30]又以多壁碳纳米管为模板合成了LiMn2O4纳米管。他们首先将碳纳米管用浓硝酸处理去除杂质,并引入亲水基团,之后浸入KMnO4溶液中使其表面包覆一层 MnO2,最后与LiOH混合并在高温下去除碳纳米管从而得到LiMn2O4纳米管。实验证明,LiMn2O4纳米管具有较高的比容量和极好的循环稳定性。4.5 C时其比容量为110 mA·h/g,而600 C时其容量保持率依然达到53.9%。图7是LiMn2O4纳米管的SEM图以及在不同循环次数下其容量和库仑效率的变化情况。LiMn2O4纳米管良好的倍率性能和较高的比容量使其在电动汽车行业很有应用潜力。
同年,Li等[31]在不同条件下用固态反应法合成了棒状尖晶石型LiMn2O4,结果证明,在700 ℃下烧结8 h制得的LiMn2O4电极材料电化学性能最好,他们认为这是由于该条件下制得的纳米棒更小,且大小更均一,从而电极振实密度更高,有利于电子迅速稳定地传输。此外,纳米棒较小有利于增大电极与锂离子的接触面积,减小其传输距离,这些均 有利于提高电池的循环性能。实验表明,此条件下制得的电极材料组装的电池循环100次后容量保持率为94.6%。此外,在5 C的倍率下其放电容量为0.1 C时的80%,说明1D的纳米棒在循环过程中很稳定,适用于大电流放电。由于制作方法简单、原料廉价易得、对环境无污染,因此在大规模储能方面很有应用潜力。图8为最优合成条件下(即蔗糖质量分数为20%)的LiMn2O4电极的循环伏安曲线。

图7 LiMn2O4纳米管的SEM图像(a)及在不同循环次数下其容量和库伦效率的变化情况(b)Fig.7 SEM image of LiMn2O4nanotubes (a) and the change of its capacity and coulomb efficiency under different cycle times (b)
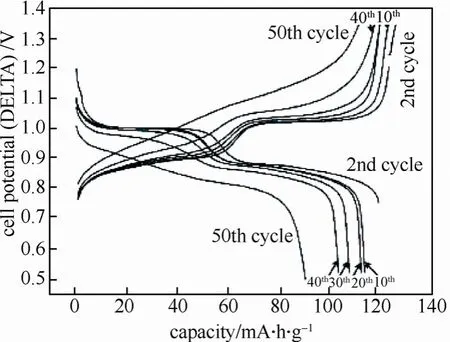
图8 蔗糖浓度(质量分数为20%)条件下合成的单晶LiMn2O4的循环伏安曲线 Fig.8 Cyclic voltammetry curves of single crystal LiMn2O4synthesized under the condition of 20% percent sucrose concentration
2.3 磷酸盐系
LiFePO4因为具有廉价易得、环境友好、理论比容量较高、稳定性较好等优点被认为是很有应用潜力的新型材料,近年来引起了科研工作者的广泛兴趣。Goodenough研究组对此材料已经进行了较为深入的基础探究。近年来很多磷酸盐系的锂盐LiMPO4(M=Fe、Mn、MnyFe1–y、Co、Ni、V)被合成出来,并且被证明具有很好的研究价值,下文将介绍一些这方面近几年的研究进展。
2010年,Lee等[32]研究了溶液pH值对LiFePO4正极性能的影响。在磷酸铁锂晶体中,锂离子、铁离子和磷分别占据八面体的 4a、4c和四面体的 4c位点,在水溶液中,锂离子和铁离子较磷更容易溶解,这会导致纳米粒子表面化学性质的改变,从而进一步影响纳米粒子在水溶液中的分散性质。实验表明,溶液 pH值的不同会影响到纳米粒子表面基团的性质和数量,且锂离子的溶解会增加表面酸性基团的数量,而铁离子的溶解减少了粒子表面碱性基团的数量,这增加了粒子的黏度,从而影响到纳米粒子微结构的均匀性,进而降低了其比率性能。2012年,Manjunatha等[33]通过RAPET法合成了橄榄石型的 LiMnPO4并研究了 LiMnPO4在不同溶液中嵌入/嵌脱离子的性质。结果表明,在锂离子浓度较低时发生的是质子的嵌入/嵌脱,反之则为锂离子的嵌入/嵌脱。
橄榄石型LiCoPO4曾用于有机溶剂电池中,但是其容量和循环性能均不理想。2011年,Minakshi等[34]以LiCoPO4为正极,Sn为负极,LiOH为电解液组装电池,并研究了在充放电过程中电极结构的变化。充放电循环5次后,电极的容量保持率约为100%,且充放电循环25次后,根据XRD和SEM测试结果,LiCoPO4电极的形态基本没有变化,且电极中始终存在LiCoPO4和CoPO4两个晶相,说明锂离子没有完全嵌入,只是在充放电中相互转化,这也为电极的稳定性提供了理论依据。
2012年,Zhao等[35]用两步法首次合成了碳包覆的 LiFe0.5Mn0.5PO4晶体材料,用于水系锂离子电池的正极,并以LiV3O8为负极,饱和LiNO3为电解液组装电池,测量电池性质。他们先用柠檬酸和反应物形成干凝胶,再通过煅烧形成了碳包覆的LiFe0.5Mn0.5PO4单晶纳米粒子。电池测试过程中发现,若电解液中含氧,则与溶解的锰离子反应形成Mn(OH)2沉淀,从而降低了电池的库仑效率和放电容量,这种情况在无氧条件下可以得到有效改 善。电池在 0.05 C 的放电速率下电池容量为 123.09 mA·h/g,但是随着倍率的增大以及循环次数的增加,容量衰减较为明显,具体原因还需进一步考察。详细的CV分析可以得出锂离子在电极中的扩散速率,结果表明,锂离子的嵌入/嵌脱过程是由扩散控制的。
2013年,Zhao等[36]又用两步法合成了碳包覆的橄榄石型 LiMn1−xFexPO4(x=0.5、0.4、0.3、0.2)晶体,并研究了电解质在溶氧和脱氧的条件下锂离子在其中的扩散行为。结果表明,溶氧量的降低会减小电子的传输电阻,增加离子扩散系数,从而改善电池的效率。此外,溶氧量的减少还能显著减少电极在循环过程中的容量衰减,提高电池的循环稳定性,但是溶氧影响电极性质的原因还需进一步探索。碳包覆的橄榄石型 LiMn1−xFexPO4(x=0.5、0.4、0.3、0.2)晶体在 0.1 C 时首次放电容量达到 112 mA·h/g,在水系锂离子电池中具有很大的潜力。
2.4 普鲁士蓝
普鲁士蓝锂盐LixMy[Fe(CN)6](M=Fe,Co,Ni,Mn,Zn,Cu等)是一类含有变价过渡金属的配合物[37]。CN–可以和过渡金属离子形成结合力很强的络合物,尤其是与铁离子和亚铁离子形成的六配位络合物和,两者的配合物稳定系数分别为 35.0和 42.0,且在水溶液中电对的电化学行为是完全可逆的,在氧化还原过程中,两者均保持八面体结构,使电极具有很好的循环稳定性。此外,具有较高的工作电位(0.36V vs.SHE),因此在用作电极材料方面有很大的潜力。和Fe(CN)64–盐相比,普鲁士盐具有两个活性位点[Mn+/(Mn+1)+,Fe2+/Fe3+],因此应该具有更大的可逆容量,且其晶格结构具有较大的配位空隙,有利于离子的迁移。钱江峰[38]用球磨法合成了Na4Fe(CN)6/C纳米复合材料作为正极,金属钠为负极,1.0 mol/L的NaFP6为电解液组装电池,1 C倍率下循环500次后,容量保持率依然达到88%,库仑效率为 100%,说明电极具有很好的循环稳定性,但此材料在锂电方面的应用却鲜有报道。
3 水系锂离子电池电极材料改性
3.1 电极材料添加剂
各国科研工作者对正负极材料的研究不仅关注材料的选择,同时也注重外加物质对正负极性质的改善。2006年,Minakshi等[39]研究了MnO2/Zn水系锂离子电池,电解液分别采用LiOH和KOH溶液。研究发现,在LiOH溶液中,锂离子嵌入MnO2形成 LixMnO2的过程与 γ-MnO2在 LiOH溶液中发生还原反应过程是可逆的;然而在 KOH溶液中,这个过程是不可逆的,也不发生锂离子的嵌入反应,只是在γ-MnO2还原反应时伴随有质子嵌入MnO2。产生这种现象的原因在于Li+和K+的尺寸大小不同,由于Li+和Mn4+的尺寸相近,所以可以嵌入γ-MnO2八面体结构中,形成的LixMnO2晶格结构稳定,而K+的尺寸大小是Mn4+的2倍,不发生K+的嵌入反应。Minakshi认为,这开辟了以 γ-MnO2为正极材料的可充水系锂离子电池的新领域。2009年,该组又研究了 CeO2添加到正极材料 MnO2中的水系锂离子电池,Zn作负极,电解液用LiOH溶液。CeO2的添加使电池第一次充放电循环以后在容量以及抵抗容量衰减方面都有改善,未添加 CeO2时,第一次放电时放电容量为152 mA·h/g;正极添加质量分数为2%的CeO2时,第一次放电时放电容量为155 mA·h/g,差异很小;然而正极添加质量分数为2%的CeO2后,第二次放电时放电容量从155 mA·h/g上升至190 mA·h/g,放电容量有了明显提升。5次循环以后,放电容量依然保持在183 mA·h/g,20次循环以后,放电容量保持在145 mA·h/g,40次循环以后,放电容量保持在 135 mA·h/g。Minakshi等[40]认为产生这种现象的原因是在充电过程中抑制了析氧反应,促进放电产物(主要是 LixMnO2)转化为活性MnO2,同时抑制了不可充电的氢氧化物的形成,提高了库仑效率。研究发现,添加质量分数为 2%的CeO2是最有效的,质量分数超过5%将导致电池长期循环过程中容量的衰减。此外,他们研究发现,TiB2[41]、TiS2[42]、Bi2O3[43]的添加都会抑制不可充电产物的形成,进而提高电池的循环性能。
3.2 电极材料包覆
众所周知,水系锂离子电池能量衰减主要原因在于电极材料在电解液中的溶解,所以对电极材料进行包覆是减少电极材料在电解液中溶解的一种有效途径,主要有导电高聚物包覆、碳包覆、氧化物包覆等方法[44]。
2007年,Chen等[45]认为通过电极表面包覆导电聚合物,能有效减少由电极材料与电解液的接触导致的电极材料损耗,进而提高电池循环性能。研究发现,120次充放电循环后,用聚吡咯包覆的LiMn2O4比单纯的 LiMn2O4容量密度从 110 mA·h/g升到125 mA·h/g。后来又尝试了采用聚吡咯包覆负极LixV2O5,正极采用LiMn2O4,电解液用5 mol/L的LiNO3水系锂离子电池。这种电池平均工作电压为 1.25 V,放电容量约为 43 mA·h/g,40 次充放电循环后,放电容量保持率为86%,而60次充放电循环后,放电容量保持率为82%。而未进行包覆的相同体系40次充放电循环后,放电容量保持率仅为8%。
2007年,Xia等[46]报道了以负极采用碳包覆LiTi2(PO4)3,正极采用传统的 LiMn2O4,电解液为Li2SO4溶液的水系锂离子电池。与上述陈立泉院士报道的水系锂离子电池不同之处在于对负极材料LiTi2(PO4)3进行了碳包覆,有效减少了负极材料放电状态时在电解液中的溶解,循环性能得到很大提高。碳包覆LiTi2(PO4)3电导率高,20 C充放电电流下,容量仍保持为80%;该水系锂离子电池平均工作电压为 1.5 V,放电容量约为 40 mA·h/g,能量密度为60 W·h/kg,200次充放电循环后,放电容量保持率为82%。他们认为,纳米厚度的碳包覆层可以允许锂离子通过,但是可以有效阻止负极材料LiTi2(PO4)3与水发生副反应,使得循环性能大幅提高。随后,他们发现,通过除氧操作、调整电解液的pH值、采用碳包覆电极材料等方法,水系锂离子电池可以在循环1000次后容量仍保持90%以上。他们还报道了一种新型水系锂离子电池,正极采用LiFePO4,负极采用碳包覆LiTi2(PO4)3,电解液采用pH值为13的1 mol/L的Li2SO4溶液,组装成密封无氧水系锂离子电池。这种水系锂离子电池的输出电压为 0.9 V,比容量为 55 mA·h/g,比能量为 50 W·h/kg(实际比能量约为 30 W·h/kg,与铅酸和镍隔电池相当,但功率更大,寿命更长),1000次充放电循环后容量仍保持为起始容量的90%,这与现用商业化有机体系锂离子电池相当,是重大跃迁,闻名海内外。
此外,以上内容也包含有碳包覆LiFe0.5Mn0.5PO4和碳包覆锂等作为水系锂离子电极等包覆方法在此方面的应用,在此不再单独赘述。
4 结 语
水系锂离子电池作为一种新兴锂离子电池,具有高离子迁移率、高倍率充放电、设备简化、安全环保、成本低等优点,成为具有开发应用潜力的新一代储能器件,具有很好的发展前景。我们看到发展前景的同时也应看到存在的问题,目前影响水系锂离子电池循环性能的主要因素在于电极材料在电解液中的溶解,尤其在氧气环境中,循环性能更差。此外,水系锂离子电池电解液中质子活性大,可能先于锂离子发生嵌入/嵌脱反应,成为电极材料的主要副反应形式。通过发掘新型电解质材料、对电极材料进行包覆、除氧、调节电解液 pH值等操作,可以大幅提高电池循环性能,相信随着研究的深入,存在的问题会得以解决,最终带来水系锂离子电池的商业化,造福人类。
[1] Wang Gaojun,Zhao Nahong,Yang Lichun,et al.Characteristics of an aqueous rechargeable lithium battery (ARLB)[J].Electrochimica Acta,2007,52(15):4911-4915.
[2] Li W,Dahn J R,Wainwright D S.Rechargeable lithium batteries with aqueous electrolytes[J].Science,1994,264(5162):1115-1118.
[3] Kohler J,Makihara H,Uegaito H,Inoue H,Toki M.LiV3O8:Characterization as anode material for an aqueous rechargeable Li-ion battery system[J].Electrochimica Acta,2000,46(1):59-65.
[4] Wang Gaojun,Fu Lijun,Wu Yuping,et al.An aqueous rechargeable lithium battery with good cycling performance[J].Angewandte Chemie,2007,119(1-2):299-301.
[5] Wang Gaojun,Zhang Hanping,Wu Yuping,et al.Aqueous rechargeable lithium battery (ARLB) based on LiV3O8and LiMn2O4with good cycling performance[J].Electrochemistry Communications,2007,9(8):1873-1876.
[6] Cheng Cheng,Li Zhaohui,Zhan Xiaoyun,et al.A macaroni-like Li1.2V3O8nanomaterial with high capacity for aqueous rechargeable lithium batteries[J].Electrochimica Acta,2010,55(15):4627-4631.
[7] Zhao Mingshu,Zheng Qingyang,Wang Fei,et al.Electrochemical performance of high specific capacity of lithium-ion cell LiV3O8//LiMn2O4with LiNO3aqueous solution electrolyte[J].Electrochimica Acta,2011,56(11):3781-3784.
[8] Caballero A,Morales J,Vargas O A.Electrochemical instability of LiV3O8as an electrode material for aqueous rechargeable lithium batteries[J].Journal of Power Sources,2010,195(13):4318-4321.
[9] Li H Q,Zhai T Y,Zhou H S,et al.Single-crystal H2V3O8nanowires:A competitive anode with large capacity for aqueous lithium-ion batteries[J].Journal of Materials Chemistry,2011,21(6):1780-1787.
[10] Liang L,Zhou M,Xie Y.Electrospun hierarchical LiV3O8nanofibers assembled from nanosheets with exposed {100} facets and their enhanced performance in aqueous lithium-ion batteries[J].Chemistry,2012,7(3):565-571.
[11] BaoJian,Zhou Min,Zeng Yongquan,Bai Liangfei,Zhang Xiaodong,Xu Kun,Xie Yi.H3V2O5with high lithium diffusion rate:A promising anode material for aqueous lithium-ion batteries with superior rate performance[J].J.Mater.Chem.A,2013,(1):5423-5429.
[12] Zhang Shudong,Li Yingmei,Wu Changzheng,Zheng Fei,Xie Yi.Novel flowerlike metastable vanadium dioxide (B) Micronano- structures:Facile synthesis and application in aqueous lithium ion batteries[J].J.Phys.Chem.C,2009,113(33):15058-15067.
[13] Li H,Zhai T,Xie Y,et al.Single-crystal H2V3O8nanowires:A competitive anode with large capacity for aqueous lithium-ion batteries[J].Journal of Materials Chemistry,2011,21(6):1780-1787.
[14] Bai L,Zhu J,Zhang X,et al.Reducing hydrated protons co-intercalation to enhance cycling stability of CuV2O5nanobelts:A new anode material for aqueous lithium ion batteries[J].Journal of Materials Chemistry,2012,22(33):16957-16963.
[15] Xu Yang,Zheng Lei,Wu Changzheng,Qi Fei,Xie Yi.New-phased metastable V2O3porous urchin-like micronanostructures:Facile synthesis and application in aqueous lithium ion batteries[J].Chemistry-A European Journal,2011,1(17):384-391.
[16] Sun Y,Jiang S,Bi W,et al.Highly ordered lamellar V2O3based hybrid nanorods towards superior aqueous lithium-ion battery performance[J].Journal of Power Sources,2011,196(20):8644-8650.
[17] Wang Haibo,Huang Kelong,Zeng Yuqun,Yang Sai,Chen Liquan.Electrochemical properties of TiP2O7and LiTi2(PO4)3as anode material for lithium ion battery with aqueous solution electrolyte[J].Electrochimica Acta,2007,52(9):3280-3285.
[18] Liu X H,Saito T,Doi T,et al.Electrochemical properties of rechargeable aqueous lithium ion batteries with an olivine-type cathode and a nasicon-type anode[J].Journal of Power Sources,2009,189(1):706-710.
[19] Wessells C,Huggins R A,Cui Y.Recent results on aqueous electrolyte cells[J].Journal of Power Sources,2011,196(5):2884-2888.
[20] Cui Y,Hao Y,Bao W,et al.Synthesis and electrochemical behavior of LiTi2(PO4)3as anode materials for aqueous rechargeable lithium batteries[J].Journal of The Electrochemical Society,2013,160(1):A53-A59.
[21] Wang X,Hou Y,Wu Y P,et al.An aqueous rechargeable lithium battery using coated Li metal as anode[J].Scientific Reports,2013,3:1401.
[22] Wang G J,Qu Q T,Wang B,Shi Y,Tian S,Wu Y P,Holze R.Electrochemical behavior of LiCoO2in a saturated aqueous Li2SO4solution[J].Electrochimica Acta,2009,54(4):1199-1203.
[23] Ruffo R,Wessells C,Huggins R A,et al.Electrochemical behavior of LiCoO2as aqueous lithium-ion battery electrodes[J].Electrochemistry Communications,2009,11(2):247-249.
[24] Tang Wei,Liu Lili,Wu Yuping,et al.Nano-LiCoO2as cathode material of large capacity and high rate capability for aqueous rechargeable lithium batteries[J].Electrochemistry Communications,2010,12(11):1524-1526.
[25] Ruffo R,La Mantia F,Wessells C,et al.Electrochemical characterization of LiCoO2as rechargeable electrode in aqueous LiNO3electrolyte[J].Solid State Ionics,2011,192(1):289-292.
[26] Mahesh K C,Suresh G S,Bhattacharyya A J,et al.Synthesis and electrochemical characterization of LiNi0.8Co0.2O2as cathode material for aqueous rechargeable lithium batteries[J].Journal of the Electrochemical Society,2012,159(5):A571-A578.
[27] Shivashankaraiah R B,Manjunatha H,Mahesh K C,et al.Electrochemical characterization of polypyrrole-LiNi1/3Mn1/3Co1/3O2composite cathode material for aqueous rechargeable lithium batteries[J].Journal of Solid State Electrochemistry,2012,16(3):1279-1290.
[28] Stojković I,Cvjetićanin N,Mentus S,et al.Electrochemical behaviour of V2O5xerogel in aqueous LiNO3solution[J].Electrochemistry Communications,2009,11(7):1512-1514.
[29] Tang Wei,Tian Shu,Wu Yuping,et al.Nanochain LiMn2O4as ultra-fast cathode material for aqueous rechargeable lithium batteries[J].Electrochemistry Communications,2011,13(2):205-208.
[30] Tang Wei,Hou Yu yang,Wang Faxing,Liu Lili,Wu Yuping,Zhu Kai.LiMn2O4nanotube as cathode material of second-level charge capability for aqueous rechargeable batteries[J].Nano Lett.,2013,13(5):2036-2040.
[31] Li Zhihua,Wang Liqiu,Li Keyan,Xue Dongfeng.LiMn2O4rods as cathode materials with high rate capability and good cycling performance in aqueous electrolyte[J].Journal of Alloys and Compounds,2013,580:592-597.
[32] Lee J H,Kim H H,Kim G S,et al.Evaluation of surface acid and base properties of LiFePO4in aqueous medium with pH and its electrochemical properties[J].The Journal of Physical Chemistry C,2010,114(10):4466-4472.
[33] Manjunatha H,Venkatesha T V,Suresh G S.Electrochemical studies of LiMnPO4as aqueous rechargeable lithium-ion battery electrode[J].Journal of Solid State Electrochemistry,2012,16(5):941-1952.
[34] Minakshi M,Singh P,Sharma N,et al.Lithium extraction-insertion from/into LiCoPO4in aqueous batteries[J].Industrial & EngineeringChemistry Research,2011,50(4):1899-1905.
[35] Zhao Mingshu,Huang Guanliang,Wang Fei,Song Xiaoping.Characteristics and electrochemical performance of LiFe0.5Mn0.5PO4/C used as cathode for aqueous rechargeable lithium battery[J].Journal of Power Sources,2012,211:202-207.
[36] Zhao Mingshu,Huang Guanliang,Zhang Weigang,Zhang Hanyuan,Song Xiaoping.Electrochemical performance of modified LiMn2O4used as cathode material for an aqueous rechargeable lithium battery[J].Energy Fuels,2012,26(2):1214-1219.
[37] Minakshi M ,Singh P ,Appadoo D ,et al.Synthesis and characterization of olivine LiNiPO4for aqueous rechargeable battery[J].Electrochimica Acta,2011,56(11):4356-4360.
[38] Qian Jiangfeng(钱江锋).Sodium electrode material and advanced storage applications electrochemical energy storage[D].Wuhan:Wuhan University,2012.
[39] Minakshi M,Singh P,Issa T B,et al.Lithium insertion into manganese dioxide electrode in MnO2/Zn aqueous battery:Part III.Electrochemical behavior of γ-MnO2in aqueous lithium hydroxide electrolyte[J].Journal of Power Sources,2006,153(1):165-169.
[40] Minakshi M,Nallathamby K,Mitchell D R G.Electrochemical characterization of an aqueous lithium rechargeable battery:The effect of CeO2additions to the MnO2cathode[J].Journal of Alloys and Compounds,2009,479(1):87-90.
[41] Minakshi M,Mitchell D R G,Prince K.Incorporation of TiB2additive into MnO2cathode and its influence on recharge ability in an aqueous battery system[J].Solid State Ionics,2008,179(9):355-361.
[42] Manickam M,Mitchell D R G,Singh P.TEM investigation of MnO2cathode containing TiS2and its influence in aqueous lithium secondary battery[J].Electrochimica Acta,2007,52(9):3294-3298.
[43] Minakshi M,Mitchell D R G.The influence of bismuth oxide doping on the recharge ability of aqueous cells using MnO2cathode and LiOH electrolyte[J].Electrochimica Acta,2008,53(22):6323-6327.
[44] Sun Yang(孙洋),Dong Jinping(董金平),Tang Chun(唐春),et al.Reviews of selected 100 recent papers for lithium batteries (Oct.1 to Nov.30, 2012)[J].Energy Storage Science and Technology(储能科学与技术),2013,2(1):42-54.
[45] Wang H B,Zeng Y Q,Huang K L,et al.Improvement of cycle performance of lithium ion cell LiMn2O4/LixV2O5with aqueous solution electrolyte by polypyrrole coating on anode[J].Electrochimica Acta,2007,52(15):5102-5107.
[46] Luo Jiayan,Xia Yongyao.Aqueous lithium-ion battery LiTi2(PO4)3/ LiMn2O4with high power and energy densities as well as superior cycling stability[J].Advanced Functional Materials,2007,17(18):3877-3884.
