除草剂二甲戊乐灵降解真菌Qsun-6的分离及其特性
2014-09-19宫宏琨,孙庆元,刘栓栓,金超楠
宫 宏 琨,孙 庆 元,刘 栓 栓,金 超 楠
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
二甲戊乐灵(Pendimethalin)是一种选择性芽前二硝基苯胺类除草剂,可应用于多种大田作物、蔬菜和烟草[1-2]。它是一种低毒高效性除草剂[3],已被大面积推广使用。由于其结构较复杂,所以在自然界中难以降解,对环境和人类健康造成威胁,是一种持久性生物积累毒物[4]。二甲戊乐灵在环境中的降解依靠生物降解和光降解,但在自然光条件下,土壤中的二甲戊乐灵降解较慢,主要依靠微生物降解。国外的科研工作者已经做了一些其微生物降解方面的工作[4],主要集中在二甲戊乐灵在土壤和培养基中的微生物降解[5-9]。国内对于二甲戊乐灵的微生物降解鲜有报道。本研究分离了高效降解菌株Qsun-6,并研究了不同培养条件对菌株生长和降解的影响,为农药污染治理和降解菌剂的开发提供依据。
1 材料和方法
1.1 主要仪器设备
高效液相色谱仪(LC-20AT,Shimadzu),附有紫外可见检测器(SPD-M20A);C18色谱柱:4.6mm×150mm,5μm(ECOSIL ODS,Japan);旋转蒸发仪;KQ-250超声波清洗器;超净工作台,恒温振荡摇床,恒温培养箱,高压灭菌锅,电子天平等。
1.2 试 剂
二甲戊乐灵标准品,纯度≥98%,Fluka;33%施田补乳油,江苏龙灯化学有限公司,用无菌水适当稀释得质量浓度为10mg/L的二甲戊灵溶液,按需加入培养液;无水Na2SO4,分析纯,150℃烘24h后使用;石油醚,分析纯,天津市科密欧化学试剂有限公司;甲醇,色谱纯,山东禹王实业有限公司化工分公司。
1.3 真菌的分离与鉴定
培养基为察氏培养基按需加入适量二甲戊乐灵制成。将采集的土壤样品按10%的量接种到100mg/L二甲戊乐灵的富集培养基中,30℃振荡培养7d,再次取富集液按10%的量接种到200mg/L二甲戊乐灵的培养基中培养,如此连续转接并提高二甲戊乐灵质量浓度到5 000mg/L。采用稀释涂平板法进行分离,挑取单一菌落到以二甲戊乐灵为唯一碳源的选择性培养基中进一步纯化,并逐渐提高二甲戊乐灵质量浓度到3 000mg/L。选取真菌菌株编号保存,并测定其降解能力,确定二甲戊乐灵的高效降解菌株。
1.4 真菌降解实验
察氏培养基121℃灭菌30min后加入适量二甲戊乐灵标准品溶液,以每支10mL分装到试管,用移液枪向每支试管接种真菌孢子悬液0.5mL,置恒温振荡摇床150r/min培养5d。待培养结束后,将培养液转入已装有50mL饱和NaCl溶液的250mL分液漏斗中,再向分液漏斗加入石油醚,共用50mL。充分振荡后静置分层,弃去下层水相,上层石油醚经盛有无水Na2SO4的漏斗到圆底烧瓶,用真空旋转蒸发仪蒸发(水浴40℃)至数毫升后转入10mL刻度离心管中,并用少量石油醚冲洗圆底烧瓶3次。继续蒸发至近干,最后用弱N2气流吹干后,加10mL甲醇溶解,振荡混匀后即为待测样品液。
色谱条件[10]:流动相为甲醇-水,体积比为85∶15;体积流量为1mL/min;柱温,室温。检测波长238nm。
按照式(1)计算二甲戊乐灵相对降解率:
X= (Sck-Sx)/Sck×100% (1)
式中:X为降解率,Sck为未接菌处理中二甲戊乐灵峰面积,Sx为接菌处理中二甲戊乐灵峰面积。
按照式(2)计算二甲戊乐灵绝对去除量:
C=C0-Cx(2)
式中:C为绝对去除量,C0为二甲戊乐灵未处理的质量浓度,Cx为接菌处理中二甲戊乐灵质量浓度。
1.5 真菌的生长量和降解速率实验
1.5.1 外加碳源
以蔗糖为外加碳源,配制蔗糖质量分数为0、0.5%、1.0%、2.0%、3.0%、4.0%的培养基,按照“1.4”方法接种振荡培养5d后取样,测定二甲戊乐灵的降解率;过滤收集菌丝体于80℃下烘至恒重,称量计算菌株生长量[11]。
1.5.2 二甲戊乐灵质量浓度
根据“1.5.1”实验结果选择适宜的蔗糖质量分数,配制培养基,加入二甲戊乐灵标准溶液,使二甲戊乐灵的质量浓度分别为20、50、100、200、500和1 000mg/L,分装于试管后接种振荡培养,5d后取样测菌株生长量和二甲戊乐灵降解率。
1.5.3 初始pH值
根据“1.5.2”实验结果选择适宜的蔗糖质量分量和适当的二甲戊乐灵的质量浓度,调整培养液中K2HPO4和KH2PO4的比例,控制培养基的pH 值分别在5.0、6.0、7.0、8.0、9.0,接种培养5d后取样,按照上述方法测定二甲戊乐灵的降解率和菌株生长量。
1.5.4 温 度
根据“1.5.3”实验结果选择适宜的蔗糖和初始pH,以及适当的二甲戊乐灵的浓度,配制培养液分装,接种后于10、20、30、40、50℃下振荡培养,5d后取样测定二甲戊乐灵的降解率和菌株生长量。
2 结果与讨论
2.1 高效降解菌株Qsun-6的筛选和确定
选择在以二甲戊乐灵为唯一碳源的培养基中生长较好的真菌进行降解能力测定,结果见表1。多数真菌对二甲戊乐灵都具备一定的降解能力,但其降解能力因菌株的种类不同而不同,Qsun-1菌株5d内对100mg/L二甲戊灵的降解率在30%,其他菌株都在60%以上,其中Qsun-6菌株到达75.21%。6株真菌在二甲戊乐灵质量浓度为3 000mg/L的固体培养基上生长缓慢,出现菌落时间均超过7d。结合不同菌株对二甲戊乐灵的耐受能力,最终选择Qsun-6进行进一步研究。

表1 不同菌株对二甲戊乐灵5d的降解率Tab.1 Degradation rate of pendimethalin by strain in 5d
2.2 菌种鉴定
菌株Qsun-6菌落在察氏琼脂培养基上生长迅速,平坦或近于平坦,边缘具有白色的菌丝体;质地丝绒状或稍带絮状;红褐色至褐黑色;具或不具少量无色的渗出液;菌落反面带黄色。对菌株的26SrDNA D1/D2区PCR扩增并测序,经NCBI数据库的Blast比对,发现Qsun-6与塔宾曲霉(Aspergillustubingensis)相似度达100%。
2.3 外加碳源对菌株Qsun-6生长量和降解速率的影响
如图1所示,无外加速效碳源时,菌株Qsun-6的生长量和降解率很低。当加入速效碳源后,菌株Qsun-6的生长量随着可利用碳源蔗糖含量增加迅速增加,对二甲戊乐灵的降解率先随菌株生长量的增加而增加,降解率在蔗糖为1.0%时达到最大,然后呈下降趋势。

图1 蔗糖质量分数对菌株Qsun-6生长量和二甲戊乐灵降解率的影响Fig.1 Effect of the concentration of cane sugar on growth of fungus strain Qsun-6and pendimethalin degradation rate by strain Qsun-6
由图1可以看出,菌株Qsun-6的生长量和二甲戊灵的降解率都随着蔗糖含量的增加而增加,但是降解率达到一定程度后开始下降。这是因为,无外加碳源时,缺乏速效碳源,真菌生长量较低,降解酶量少,降解率不高;当加入少量速效碳源后,促使真菌生长量增加,降解酶的产量增高,从而使降解率提高[12];但蔗糖含量过高时,虽然真菌生长量增加,但是由于菌株会优先利用速效碳源,所以降解率下降。只有环境中存在一定数量的速效碳源,真菌才可以降解二甲戊乐灵,降解酶产量受到真菌生长量和环境中底物性质及数量的影响[13]。
2.4 二甲戊乐灵质量浓度对菌株Qsun-6生长量和降解速率的影响
如图2所示,在实验所测浓度范围内,菌株Qsun-6的降解率和菌株生长量都随二甲戊乐灵质量浓度的增加而减少。二甲戊乐灵是一种复杂的化学物质,很难被直接利用,一方面作为底物促进降解酶的产量且提供其活性,另一方面抑制了真菌的生长。对于菌株Qsun-6,二甲戊乐灵对真菌菌株生长的抑制作用大于对降解酶的影响,所以降解率降低。然而,二甲戊乐灵的绝对去除量(如图3所示)随二甲戊乐灵质量浓度的增加而增加。在农药微生物降解实践过程中,不仅要得到高的降解率,还要有较大的绝对去除量[14]。本研究与林爱军等[15]研究结果基本一致,降解率随二甲戊乐灵质量浓度升高而降低。
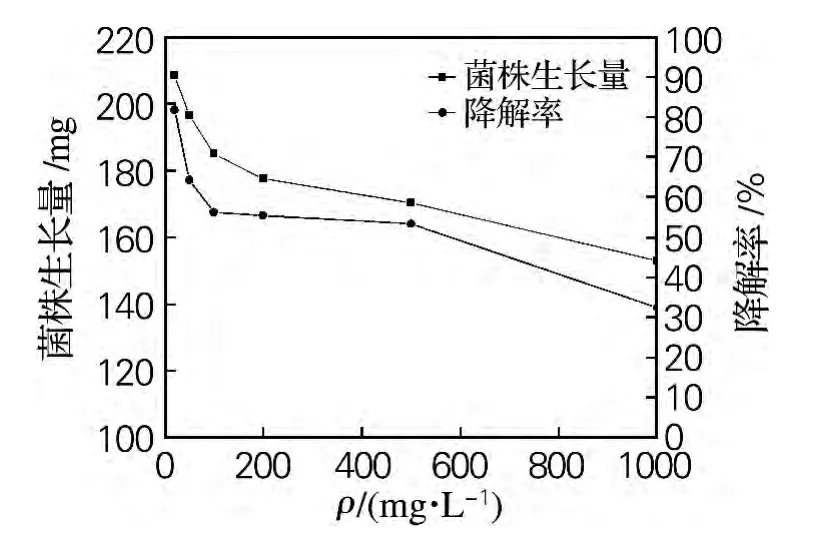
图2 二甲戊乐灵质量浓度对菌株Qsun-6生长量和二甲戊乐灵降解率的影响Fig.2 Effect of different concentration of pendimethalin on growth of fungus strain Qsun-6and pendimethalin degradation rate by strain Qsun-6
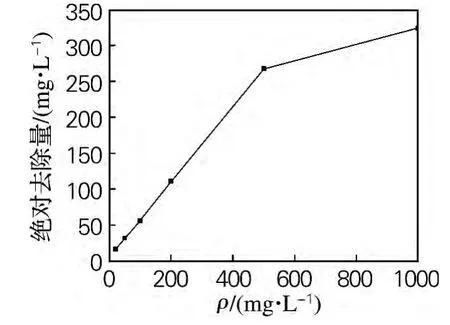
图3 不同二甲戊乐灵质量浓度下的菌株Qsun-6对二甲戊乐灵的绝对去除量Fig.3 Removed amount on different concentration of pendimethalin by strain Qsun-6
2.5 初始pH对菌株Qsun-6生长量和降解速率的影响
如图4所示,菌株Qsun-6的生长量随pH升高先增加,在pH为6时达到最大,然后随pH值升高而减少。菌株Qsun-6的降解率变化趋势与菌株生长量变化一致,在pH为6时达到最大。这表明菌株Qsun-6在中性偏酸pH值范围内可以对二甲戊乐灵保持较高的降解率,而林爱军等[15]筛选的二甲戊乐灵降解真菌最适pH为中性偏碱。
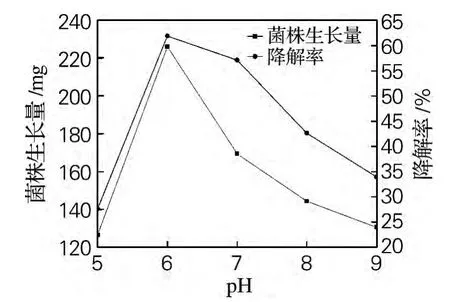
图4 pH对菌株Qsun-6生长量和二甲戊乐灵降解率的影响Fig.4 Effect of pH value on growth of fungus strain Qsun-6and pendimethalin degradation rate by strain Qsun-6
2.6 温度对菌株Qsun-6生长量和降解速率的影响
如图5所示,在实验温度的范围内,菌株Qsun-6的生长量和对二甲戊乐灵的降解率都是开始随温度的升高而增大,在30℃都达到最大,然后随温度的升高都降低。这表明,低温和高温都不利于菌株Qsun-6的生长。
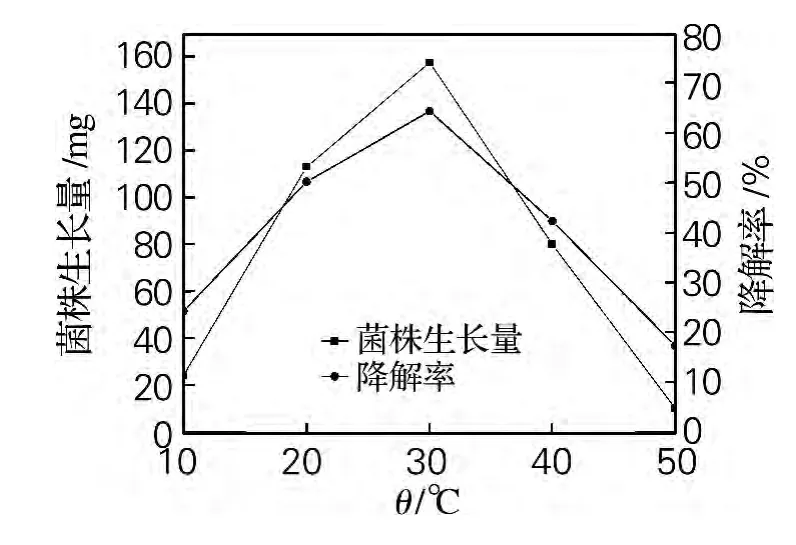
图5 培养温度对菌株Qsun-6生长量和二甲戊乐灵降解率的影响Fig.5 Effect of different temperature on growth of fungus strain Qsun-6and pendimethalin degradation rate by strain Qsun-6
3 结 论
(1)以二甲戊乐灵为唯一碳源,从土壤中分离出一株耐受能力强、降解能力较大的真菌菌株Qsun-6,经鉴定该菌株为塔宾曲霉(Aspergillus tubingensis)。
(2)菌株Qsun-6在以二甲戊乐灵作为唯一碳源的条件下,其菌株生长量和对二甲戊乐灵的降解率都处于较低水平,加入适量速效碳源后,其菌株生长量和降解率都处于较高水平。
(3)菌株Qsun-6在二甲戊乐灵质量浓度低于100mg/L、pH 6和30℃培养的条件下,生长量和对二甲戊灵的降解率可达到最大。
[1]SERDAR C M,GIBOSN D T.Enzymatic hydrolysis of organophosphates:cloning and expressing of a paranthion hydrolase fromPudomonasdiminuta[J].Bioresource Technology,1985,3:567-571.
[2]虞云龙,樊德方,陈鹤鑫.农药微生物降解的研究现状与繁殖策略[J].环境科学进展,1996,4(3):28-36.
[3]王险峰.进口农药应用手册[M].北京:农业出版社,2000:421-429.
[4]于彩虹,宋英男,张显涛,等.环境微生物降解二甲戊灵研究进展[J].农药,2011,50(6):399-401
[5]VEENA B M,PREETI N T,ROBERTCYRIL S H,et al.Biodegradation of pendimethalin by Bacillus circulans[J].Indian Journal of Biotechnology,2010,9:173-177.
[6]RAMAKRISHNA M,VENKATA S M,SHAILAJA S,et al.Identification of metabolites during biodegradation of pendimethalin in bioslurry reactor[J].Journal of Hazardous Materials,2008,151(2/3):658-661.
[7]GASPER J,STREE T J R,KENTHARRISON S.Pendimethalin efficacy and dissipation in turfgrass as influenced by rainfall incorporation[J].Weed Science,1994,42(4):586-592.
[8]BARRIUSO E,HOUOT S,SERRA-WITTLING C.Influence of compost addition to soil on the behavior of herbicides[J].Pesticide Science,1997,49(1):65-75.
[9]ROCA E,D’ERRICO E,IZZO S,et al.In vitro saprotrophic basidiomycetes tolerance to pendimethalin[J].International Biodeterioration and Biodegradation,2009,63(2):182-186.
[10]李永新,李倩,潘红梅,等.高效液相色谱法测定水中二甲戊乐灵[J].现代预防医学,2006,33(5):786-789.
[11]钱存柔,黄仪秀,林稚兰,等.微生物学实验教程[M].北京:北京大学出版社,1999:205-224.
[12]王永杰,李顺鹏,沈标,等.有机磷农药广谱活性降解菌的分离及其生理特性研究[J].南京农业大学学报,1999,22(2):42-45.
[13]刘玉焕,钟英长.真菌的有机磷农药降解酶产酶条件和一般性质[J].微生物学通报,2000,27(3):162-164.
[14]周军英,林玉锁,徐亦刚,等.巨大芽孢杆菌LY-4对土壤中杀虫单农药的降解[J].中国环境科学,2000,20(6):511-514.
[15]林爱军,朱鲁生,王军,等.除草剂二甲戊灵的真菌降解及其特性研究[J].应用生态学报,2003,14(11):1929-1933.
