不同载体固定化产脂肪酶发酵性丝孢酵母的比较
2014-09-19孙艳红,王珊,侯英敏,孙玉梅
孙 艳 红,王 珊,侯 英 敏,孙 玉 梅
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
脂肪酶(EC3.1.1.3)能在油水界面上催化酯水解和醇解、酯合成、酯交换、内酯合成及高聚物合成等反应,被重点研究和较广泛应用[1]。与游离酶和固定化酶相比,固定化全细胞在经济性、使用稳定性及易行性等方面均具有显著优越[2]。
常用的细胞固定化方法有包埋法、吸附法、共价法以及交联法等。吸附法以其操作简单、处理条件温和、酶的损害作用小以及吸附剂可反复使用等优点广泛地应用于细菌、酵母菌、真菌细胞的固定化[3-4]。活性炭、硅胶和大孔树脂是常用的固定化载体,具有较大的孔径和比表面积,理化性质稳定,价格低廉及吸附能力强[4-5]。大孔弱碱性离子交换树脂D301固定化假丝酵母脂肪酶比游离酶的酶活力提高了两倍多,酶的固定化效率约为3.5U/(mg·h)[6]。活性炭比大孔树脂对蛋白酶的吸附固定效果好,固定率可达61.95%,固定的蛋白酶对蛋白质的去除率达到44.30%[7]。以氨基化硅胶固定化葡萄糖氧化酶较游离酶酶活力、热稳定性、贮存稳定性上均有提高[5]。
本文分别以活性炭、硅胶G、大孔树脂DM-130固定发酵性丝孢酵母细胞,研究了固定化培养条件,并对不同载体的固定化效果进行比较。
1 材料与方法
1.1 材 料
1.1.1 菌 种
发酵性丝孢酵母(Trichosporonfermentans)CICC1368,购自中国食品发酵工业研究院。
1.1.2 培养基制备
斜面培养基(g/L):葡萄糖20,蛋白胨10,酵母粉10,琼脂20,自然pH,0.1MPa、121℃灭菌15min。
种子培养基(g/L):葡萄糖100,蛋白胨5.3,酵母膏2,尿素2,MgSO40.5,自然pH,0.08MPa、115℃灭菌20min,尿素0.05MPa灭菌15min。
发酵培养基(g/L):葡萄糖100,酵母膏0.5,蛋白胨1.8,KH2PO42,自然 pH,0.08MPa、115℃灭菌20min。
1.1.3 固定化载体
活性炭(40目、颗粒状),沈阳市新西试剂厂;大孔树脂DM-130,山东鲁抗医药股份有限公司树脂分厂;硅胶G,青岛裕民硅胶试剂厂。
1.2 实验方法
1.2.1 载体的预处理
1.2.1.1 活性炭预处理
在1mol/L HCl溶液中加入定量40目活性炭颗粒,于50℃搅拌1h分离除酸,用去离子水多次冲洗,直至洗液pH为中性,于130℃烘干[8]。
1.2.1.2 大孔树脂DM-130和硅胶G的预处理
用去离子水将载体清洗至无明显杂质后装入30mm×480mm层析柱中,按酸(HCl 5%)-碱(NaOH 5%)-酸(HCl 5%)的顺序淋洗载体3次,每一次酸洗或碱洗后,用去离子水反复冲洗至洗液pH为中性,处理后的载体于室温干燥待用[6]。
1.2.2 游离细胞的培养与处理
将菌种接于YEPD斜面上,于30℃培养72h,挑取2环活化后的菌丝接种于含100mL种子培养基的250mL锥形瓶中,于30℃、160r/min培养24h,得到种子液。将种子液以10%接种量接入发酵培养基中,相同条件培养72h。将发酵液于4℃、5 000g离心10min,去除上清液,用50mmol/L、磷酸缓冲液(pH 7.0)洗涤菌体3次,并离心收集。
1.2.3 固定化细胞的吸附培养与处理
按10%的接种量将液体种子接入到100mL含有已预处理的载体的发酵培养基中,于30℃、160r/min培养,将固定化载体与发酵液过滤分离,滤得的载体用去离子水和50mmol/L磷酸缓冲液(pH 7.0)冲洗3次,风干后得到固定化细胞[8]。
1.2.4 细胞吸附量的测定

式中:细胞质量=风干的固定化细胞质量-发酵液中载体添加量,g。
1.2.5 脂肪酶活力测定
将50mL橄榄油加入到150mL 4%聚乙烯醇溶液中,用榨汁机处理3min,置于4℃保存,使用前需重新乳化。采用酸碱滴定法测定脂肪酶活力。取50mL锥形瓶3个,分别加入4mL磷酸缓冲液和5mL底物溶液,另向空白瓶A中加入10mL体积分数为95%乙醇,于38℃恒温预热5min,加入待测细胞,在38℃搅拌条件下准确反应10min,向样品瓶B、C中加入10mL体积分数为95%乙醇终止反应。滴加3~5滴酚酞,用0.025mol/L NaOH溶液滴定反应产生的脂肪酸。在上述反应条件下,以每分钟脂肪酶催化橄榄油水解产生1μmol脂肪酸的所需酶量定义为1个酶活单位[9]。
1.2.6 固定化细胞的扫描电镜观测
将固定化细胞于130℃烘干2h,置于干燥器中保存。取形状规则的待测样品,采用JFC-1600AUTO FINE COATER仪在真空度8.85Pa的条件下对样品进行离子溅射喷Pt处理,最后用JSM-6460LV扫描电子显微镜观测固定化细胞结构并拍照。
2 结果与讨论
2.1 吸附载体的选择
2.1.1 吸附载体固定化时间的确定
分别以10g/L活性炭、10g/L硅胶G、10g/L大孔树脂DM-130为载体,通过吸附培养的方法固定化发酵性丝孢酵母。测定不同培养时间下的细胞吸附量及脂肪酶活力,以游离细胞脂肪酶活力作对照,结果如图1和图2所示。
由图1可知,在吸附培养的前48h,随着吸附培养时间的延长,细胞吸附量逐渐增加,且3种不同载体在吸附培养48h时细胞吸附量均达到最大,随后降低。其中硅胶G细胞吸附量>活性炭细胞吸附量>大孔树脂DM-130细胞吸附量。
由图2可知,活性炭及大孔树脂DM-130作为载体时,在吸附培养的前48h,随着吸附培养时间的延长,固定化细胞酶活力逐渐增加,在吸附培养48h达到最高,随后逐渐降低。硅胶G作为载体时,在吸附培养60h达到最高,随后逐渐降低。而游离细胞酶活力随时间增加变化不明显,脂肪酶活力在发酵60h达到最高。
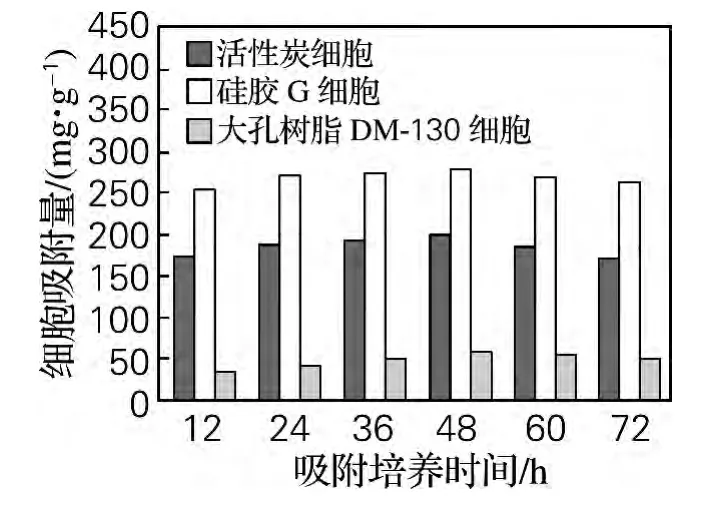
图1 吸附培养时间对不同载体细胞吸附量的影响Fig.1 Effect of adsorption cultivation time on the cell adsorption quantity on various support
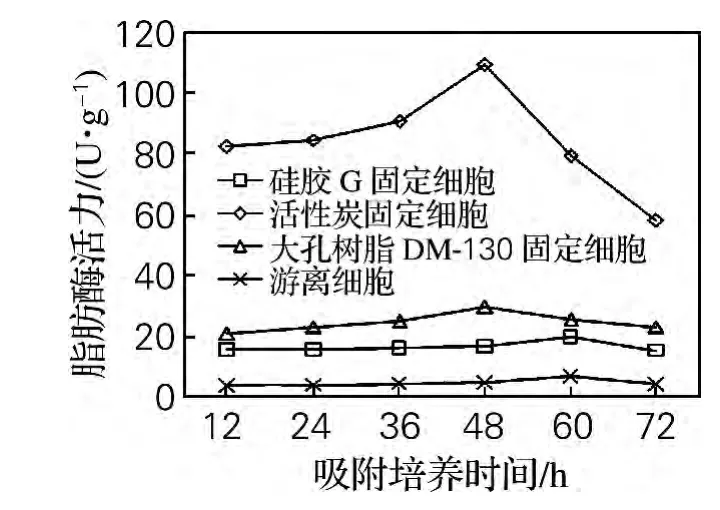
图2 吸附培养时间对不同载体固定化细胞脂肪酶活力的影响Fig.2 Effect of adsorption cultivation time on the lipase activity of immobilized cell on various support
在整个细胞培养过程中,固定化细胞酶活力均高于游离细胞酶活力,呈现活性炭固定化细胞酶活力>大孔树脂DM-130固定化细胞酶活力>硅胶G固定化细胞酶活力>游离细胞酶活力的趋势。以活性炭为载体固定化细胞较硅胶G及大孔树脂DM-130对细胞生长及产酶的促进效果更显著,缩短了细胞的发酵周期,提高了胞内脂肪酶活力。
2.1.2 吸附载体添加量的确定
分别以5、10、15、20g/L活性炭、硅胶 G、大孔树脂DM-130为载体,通过吸附培养的方法固定化发酵性丝孢酵母,活性炭及大孔树脂DM-130吸附培养48h后取样,硅胶G吸附培养60h后取样,测定其细胞吸附量及胞内脂肪酶活力,结果如图3和图4所示。由图3和图4可知,相对而言,大孔树脂DM-130不利于细胞吸附,其固定化细胞的产酶活力低于另外两种载体。添加量相同时,活性炭载体远远高于另外两种载体的细胞吸附量。当活性炭添加量为15g/L时,其细胞吸附量达到最大,而固定化细胞酶活力的最大值却出现在活性炭添加量为10g/L时。这可能是由于活性炭添加量较少,细胞吸附量过大,酶分子之间产生凝结作用的机会增多,易形成多层包被或皱褶结构,导致空间传质阻力变大,从而使固定化细胞酶活力降低[10]。而活性炭添加量过多,单位质量载体的细胞吸附量相对降低,相应的酶分子较少,从而使固定化细胞酶活力降低。表明载体添加量过多或过少对细胞固定化均有负面影响。
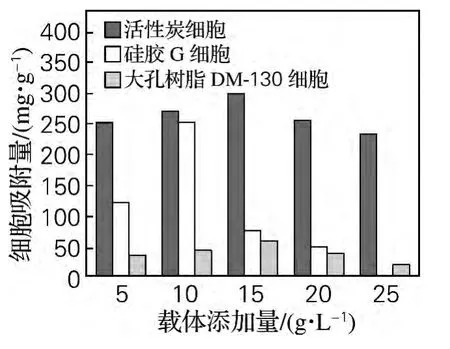
图3 载体添加量对细胞吸附量的影响Fig.3 Effect of support concentration on the cell adsorption quantity
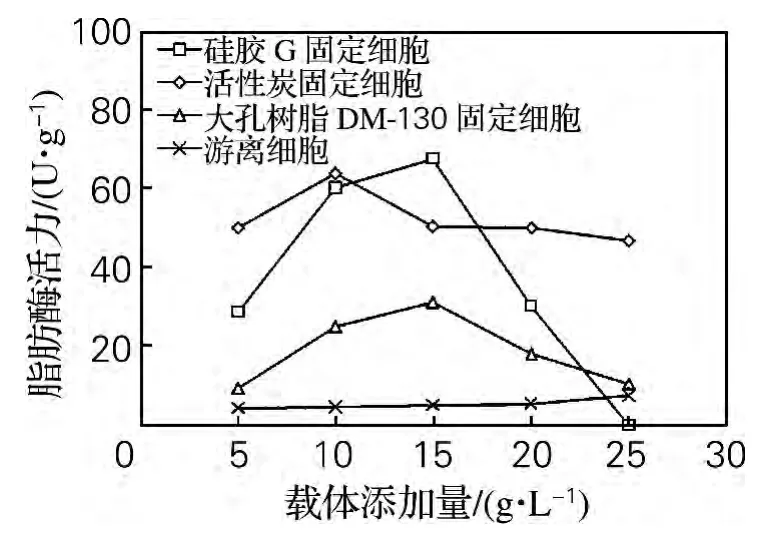
图4 载体添加量对脂肪酶活力的影响Fig.4 Effect of support concentration on the lipase activity of immobilized cell on various support
硅胶G添加量为10g/L时,其细胞吸附量达到最大,而添加量为15g/L时,固定化细胞酶活力达到最大但细胞吸附量过小,不利于固定化细胞的重复使用。因此硅胶G适宜的添加量为10g/L。
2.1.3 吸附载体的选择
不同吸附载体的最优固定化条件及固定化效果如表1所示。以活性炭为载体固定化发酵性丝孢酵母,其固定化条件、细胞吸附量、酶活和比酶活均优于另外两种载体,并且活性炭具有安全性高、韧性好、成本低以及固定化方法简单等特点,因此初步选用活性炭为适宜固定化载体。

表1 不同吸附载体的性能比较Tab.1 Comparison of property among three kinds of immobilization carriers
2.2 固定化细胞扫描电镜观测
通过扫描电镜比较活性炭载体与活性炭固定化细胞后的结构状态,结果如图5和图6所示。由图5可知,活性炭表面凹凸不平,存在缝隙和许多蜂窝形凹陷,这种孔隙结构决定了活性炭具有良好的吸附性能。由图5和图6对比可知,活性炭表面附着着一层较厚的物质,说明在吸附培养过程中有细胞等物质被吸附,借助于载体本身的孔隙、强度和韧性保证了固定化细胞的催化活性和效率[11]。

图5 活性炭结构的扫描电镜观测Fig.5 Observation of active carbon structure by scanning electron microscope

图6 活性炭固定化细胞的扫描电镜观测Fig.6 Observation of cells immobilized on active carbon by scanning electron microscope
3 结 论
通过比较活性炭、硅胶G、大孔树脂DM-130为载体吸附固定化发酵性丝孢酵母,发现40目活性炭作载体固定化发酵性丝孢酵母操作简单可行,安全性高,固定化效果较好。结果显示,添加10g/L 40目活性炭于发酵培养基中,在30℃、160r/min摇床培养48h时可吸附较多细胞,且细胞的脂肪酶活性较高。
[1]赵磊,唐婧.脂肪酶在尼龙网上的固定化及其酶学性质研究[J].食品科学,2013,34(9):210-215.
[2]刘幽燕,庚乐.生物柴油制备方法的应用研究进展[J].现代化工,2006,26(4):15-20.
[3]李青云,周茂钟,刘幽燕,等.固定化铜绿假单胞菌GF31对氯氰菊酯降解的强化作用[J].化工学报,2013,64(6):2219-2226.
[4]王珊,孙玉梅,曹芳,等.活性炭固定化产脂肪酶的发酵性丝孢酵母细胞的研究[J].中国酿造,2010(2):42-45.
[5]刘海燕,李宁,李敬慈,等.氨基化硅胶载体固定化α-淀粉酶的研究[J].食品科学,2009,30(1):169-172.
[6]王燕华,朱凯,刘辉,等.D301树脂固定化假丝酵母脂肪酶[J].生物工程学报,2009,25(12):2036-2041.
[7]杨雪梅,张兰英,张蕾,等.固定化酶在高浓度有机废水处理中的应用[J].吉林大学学报,2000,35(3):398-402.
[8]李文宏.吸附固定氨氧化菌短程脱氮研究[D].南京:南京理工大学,2007:23-24.
[9]江蕙芳,王雅琴,刘国春.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
[10]王海雄,吴侯,翁新楚.活性炭吸附法固定猪胰脂酶的初步研究[J].上海大学学报,2003,9(5):428-432.
[11]PARK E Y,SATO M,KOJIMA S.Fatty acid methyl ester production using lipase-immobilizing silica-particles with different particle sizes and different specific surface areas[J].Enzyme and Microbial Technology,2006,39(4):889-896.
