八正颗粒质量标准的改善研究
2014-09-18盛望鹏
盛望鹏
(海南科技职业学院生物与化工学院,海南 海口 571126)
八正颗粒质量标准的改善研究
盛望鹏
(海南科技职业学院生物与化工学院,海南 海口 571126)
目的改进八正颗粒的含量测定法,更好地控制药品质量。方法运用高效液相色谱法对八正颗粒中栀子苷、大黄素和大黄酚含量进行测定,拟订含量测定标准,改进和完善质量控制标准。结果新修订的栀子苷、大黄素和大黄酚含量检测方法简单可行,且灵敏度高。结论统一了八正颗粒质量标准,为规范市场中八正颗粒的质量提供了依据。
八正颗粒;栀子苷;大黄素;大黄酚;质量标准
八正颗粒是由八正合剂演变而来的中药新药,处方由瞿麦、大黄、栀子、车前子、滑石、甘草、萹蓄、川木通、灯芯草组成。具有清热,利尿,通淋等功效。用于抗菌消炎、利尿消肿、溶石排石、及下焦湿热症[1]。应用广泛,药效显著,为常用药品。鉴于目前八正颗粒生产厂家多,2010版药典没有标准,且有关于八正颗粒的质量标准控制还不够完善,市场上药材质量亦普遍下降,以及技术层面的局限性,无法做到更好的控制八正颗粒的质量标准[2]。本文探索八正颗粒质量控制新标准,力求改变目前八正颗粒的标准参差不齐的现状,建立一个简便、准确、专属的统一标准,从而更好的控制市场上八正颗粒的质量,使药用更安全,疗效更显著[3]。
1 材料与方法
1.1 仪器与试剂 高效液相色谱仪(Waters2695 Agillent1100),色谱柱(菲罗门 C18,5μm,4.6mm×250mm),色谱柱(迪马C18,5μm,4.6mm×250mm),十万分之一电子分析天平(梅特勒-托利多),万分之一电子分析天平(梅特勒-托利多)。
栀子苷对照品:中国药品生物制品检定所(批号:110749-200714),大黄素、大黄酚对照品:中国药品生物制品检定所(大黄素批号:110756-200110、大黄酚批号:110796-201017),八正颗粒分别购于湖南方盛制药有限公司(规格:8g×12袋,批号:100101、100102、100103),陕西康惠制药有限公司(规格:8g×12袋,批号:100601);乙腈、甲醇为色谱纯,其他试剂均为分析纯。
1.2 方法
1.2.1 栀子苷的含量测定:栀子苷为药典标准收载中药材栀子的含量测定的指标,本文以栀子苷为指标成分对八正颗粒质量标准进行了如下方法的修订。
①溶液制备 对照品溶液的制备:取栀子苷对照品适量,精密称定,加甲醇制成每1mL含0.1mg的溶液即得。供试品溶液的制备:取八正颗粒适量,研细,精密称取3 g,用50%乙醇溶解并定容至25mL的容量瓶中,0.45 uL微孔滤膜滤过,即得。阴性溶液制备:取却栀子的处方量下各药材按照处方提取,并按供试品处理方法处理,即得。
②色谱条件选择 流动相统为乙腈-水(12∶88),检测波长为238 nm[4],对照品、供试品、阴性溶液分别进样检测。
③线性关系考察 精密称取栀子苷对照品0.010 89 g,置5mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取上述溶液2mL,置10mL容量瓶中,加甲醇至刻度,摇匀,再精密量取上述溶液5mL,置0mL容量瓶中,加甲醇至刻度,摇匀,逐级稀释,分别配制成浓度为 0.027 225、0.054 45、0.544 5、0.217 8、0.435 6mg/mL的溶液,分别进样10μL,测定结果。
④精密度试验 以栀子苷对照品溶液(0.010 89mg/mL)连续进样5次,每次10μL,测定峰面积。
⑤稳定性试验 按2.1.2项下制备供试品溶液,精密进样10μL,测定栀子苷峰面积,在0、2、4、8、12小时测定一次。
⑥重复性实验 取同一批样品(湖南方盛制药有限公司,批号100101),按溶液制备方法制备6份供试品溶液,测定其栀子苷含量。
⑦加样回收率考察 分别精密量取栀子苷对照品甲醇溶液(浓度为2.284 6mg/mL)2.0 mL置6个具塞锥形瓶中,挥干溶剂,再精密量取已测定含量的样品(同重复性试验样品,其中栀子苷含量为6.54mg/粒)6份,分别加入上述具塞锥形瓶中,按溶液制备方法制备,测定栀子苷含量,计算加样回收率。
⑧方法耐用性考察 采用不同牌号仪器,不同牌号、规格的色谱柱,按溶液制备方法制备,分别测定样品中栀子苷含量。
⑨供试品含量测定与含量限度的制定 按色谱条件选择制备供试品溶液,并进样测定八正颗粒样品中栀子苷含量。
1.2.2 大黄的含量测定:大黄为八正颗粒质量控制指标之一,现对其进行了如下的修订。
①供试品溶液制备 对照品溶液的制备:取大黄酚对照品和大黄素对照品适量,精密称定,加甲醇制成每1 mL含大黄酚12 ug、大黄素5 ug的混合溶液,即得。供试品溶液的制备:取本品适量,研细,取1 g,精密称定,置具塞锥形瓶中,精密加入甲醇-盐酸(10∶1)的混合溶液25 m L,称定重量,置80℃水浴中加热回流30min,放冷,再称定重量用甲醇补足重量,摇匀,滤过,精密量取续滤液2mL,置5mL量瓶中,加2%氢氧化钠溶液1mL,加甲醇至刻度,摇匀,滤过,取续滤液即得。
②适应性实验 流动相为乙腈-甲醇-0.1%磷酸溶液(42∶23∶35);检测波长为 254 nm[5-6],分别吸取对照品、供试品、阴性溶液进样检测。
③线性关系考察 精密称取大黄素对照品0.010 68 g,置100mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,逐级稀释,分别配制成浓度为 0.002 67、0.005 34、0.010 68、0.021 36、0.042 72 mg/mL的溶液,分别进样10μL,测定。以进样量为横坐标,大黄素峰面积为纵坐标,绘制标准曲线。精密称取大黄酚对照品0.016 76 g(含量按99.6%计算),置100mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,逐级稀释,分别配制成浓度为0.004 17、0.008 35、0.016 69、0.033 39、0.066 77mg/mL的溶液,分别进样10μL,测定。
④精密度实验 以大黄素、大黄酚混合对照品溶液(0.010 68mg/mL、0.016 69mg/mL)连续进样 5次,每次 20μL,测定峰面积。
⑤稳定性实验 按供试品溶液制备方法配制供试品溶液,精密进样10μL,测定大黄素、大黄酚峰面积,在0、2、4、8 h测定1次。
⑥重复性实验 取同一批样品(湖南方盛制药有限公司,批号100101),按供试品溶液制备方法制备6份供试品溶液,分别测定其总大黄素和总大黄酚总量以及游离大黄素和游离大黄酚的总量。
⑦加样回收率实验 分别精密量取大黄素、大黄酚对照品甲醇溶液(浓度为0.106 8mg/mL、0.1669mg/mL)各1.5mL置6个具塞锥形瓶中,挥干溶剂,再精密量取已测定含量的样品(同重复性试验样品,其中大黄素、大黄酚含量为0.097 5mg/g、0.15mg/g)6份,分别加入上述具塞锥形瓶中,按供试品溶液制备方法操作,测定大黄素、大黄酚含量,计算加样回收率。
分别精密量取大黄素、大黄酚对照品甲醇溶液(浓度为0.106 8mg/mL、0.166 9mg/mL)1.0mL和0.5mL置6个具塞锥形瓶中,挥干溶剂,再精密量取已测定含量的样品(同重复性试验样品,其中大黄素、大黄酚含量为 0.060 mg/g、0.045 mg/g)6份,分别加入上述具塞锥形瓶中,按供试品溶液制备供试品制备方法制备,测定大黄素、大黄酚含量,计算加样回收率。
⑧方法耐用性实验 采用不同牌号仪器,不同牌号、规格的色谱柱,按适应性实验方法,分别测定样品中栀子苷含量。
⑨供试品含量测定与含量限度的制定 按供试品溶液制备方法制备供试品,适应性实验条件进样测定八正颗粒样品中总大黄素和总大黄酚总量以及游离大黄素和游离大黄酚总量。
2 结果
2.1 栀子苷含量测定
2.1.1 色谱条件选择:按照栀子苷检测方法进样得八正颗粒中栀子苷色谱峰分离度均良好,阴性对照无干扰,见图1。
2.1.2 线性关系考察:以进样量为横坐标,栀子苷峰面积为纵坐标,绘制标准曲线(见图2),并按最小二乘法计算直线回归方程,得Y=2044X-1.269(r=0.999 5)。结果表明,栀子苷进样量在0.272 25μg~4.356 0μg范围内,与峰面积呈良好的线性关系。
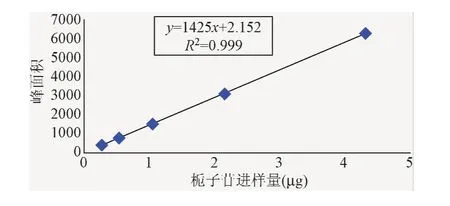
图2 栀子苷标准曲线Fig.2 The standard curve of gardenin
2.1.3 精密度试验:以栀子苷对照品溶液连续进样5次峰面积见表1,试验结果表明,仪器精密度良好。

表1 栀子苷精密度试验结果Tab.1 Precision result of gardenin
2.1.4 稳定性实验:栀子苷在0、2、4、8、12 h峰面积检测结果见表2,试验结果表明,供试品溶液稳定性良好。
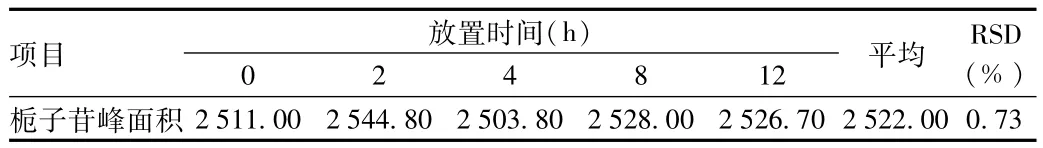
表2 栀子苷稳定性考察结果Tab.2 Stability investigation result of gardenin
2.1.5 重复性实验:6份供试品溶液栀子苷含量见表3,6次重复测定结果RSD为1.1%,表明该方法重复性较好。
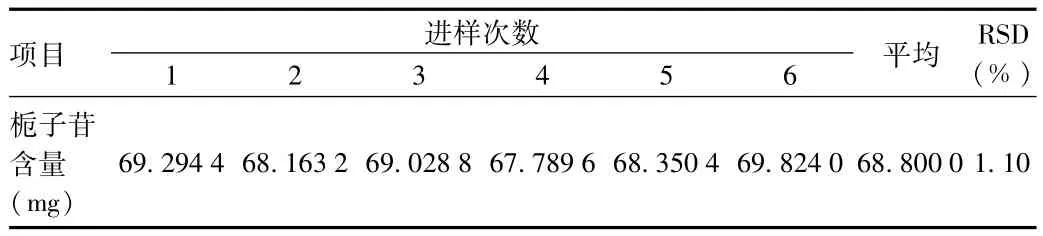
表3 栀子苷重复性考察结果Tab.3 Repeatability result of gardenin
2.1.6 加样回收率考察:栀子苷加样回收率试验结果见表4。试验结果表明,本方法回收率良好。
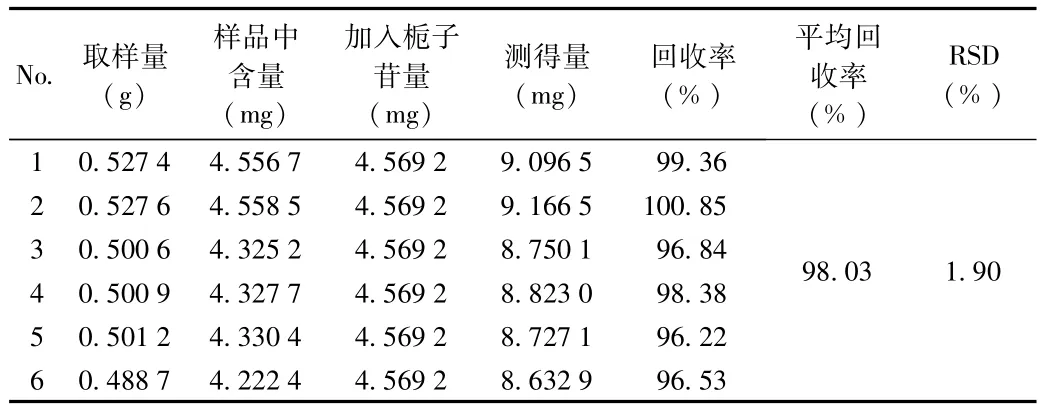
表4 栀子苷加样回收率考察结果Tab.4 Recovery result of gardenin of gardenin
2.1.7 方法耐用性考察:不同牌号仪器,不同牌号、规格的色谱柱,测定样品中栀子苷含量结果见表5,试验结果表明,该方法耐用性良好。

表5 栀子苷方法耐用性考察结果Tab.5 Durability Results of gardenin
2.1.8 供试品含量测定与含量限度的制定:八正颗粒样品中栀子苷含量试验结果见表6。
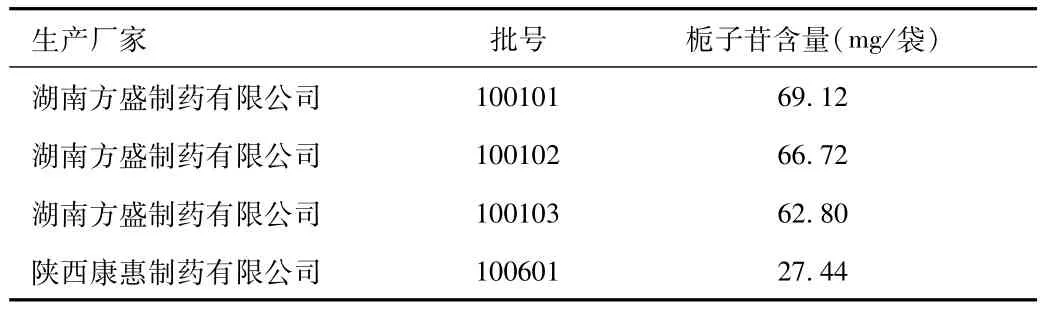
表6 八正颗粒样品中栀子苷含量测定结果Tab.6 Determination Results of gardenin in eight-positive particles
根据原标准含量限度,测定结果,结合药典对栀子药材中栀子苷限度(1.8%)的规定,以及生产的实际情况及原料药材含量的波动,暂订:本品每袋(8 g/袋)含栀子以栀子苷 (C17H24O10)计,不得少于16.0mg。
2.2 大黄的含量测定
2.2.1 适应性实验:八正各剂型样品中大黄素、大黄酚色谱峰分离度均良好,阴性对照无干扰,八正颗粒HPLC图谱见图3。
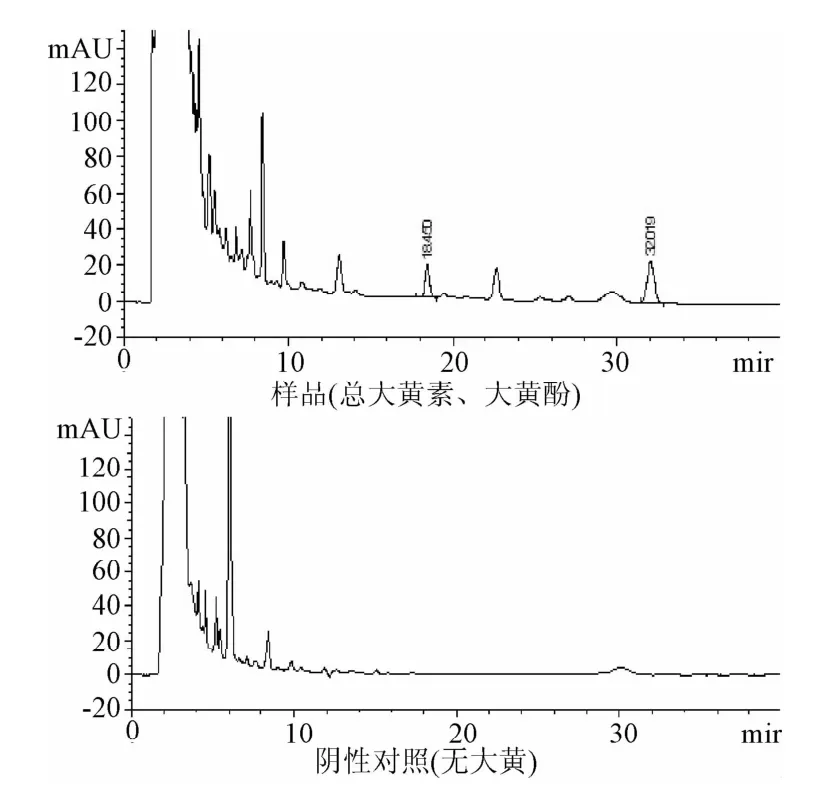
图3 八正颗粒各剂型样品HPLC图Fig.3 HPLC diagram of eight-positive particles
2.2.2 线性关系考察:以进样量为横坐标,分别以大黄素、大黄酚峰面积为纵坐标,绘制标准曲线(见图4、图5),并按最小二乘法计算直线回归方程,得大黄素回归方程为Y=142 5.7X+2.152 1(r=0.999 8),大黄酚回归方程为 Y=156 7.3X-8 566.2(r=0.999 9)。结果表明,大黄素进样量在0.026 7μg~0.427 2 μg范围内,大黄酚进样量在0.041 7~0.667 7μg范围内与峰面积呈良好的线性关系。
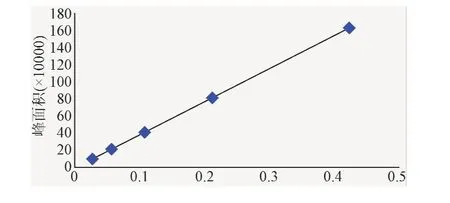
图4 大黄素标准曲线Fig.4 Standard curve of emodin
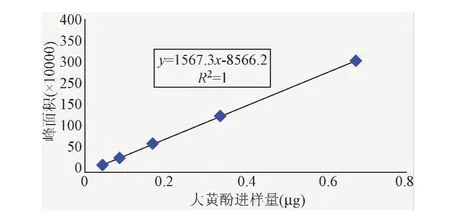
图5 大黄酚标准曲线Fig.5 Standard curve of chrysophanol
2.2.3 精密度实验:精密度试验结果见表7,结果表明,仪器精密度良好。

表7 大黄素和大黄酚精密度试验结果Tab.7 Precision results of emodin and chrysophanol
2.2.4 稳定性实验:稳定性试验结果见表8,表明供试品溶 液稳定性良好。
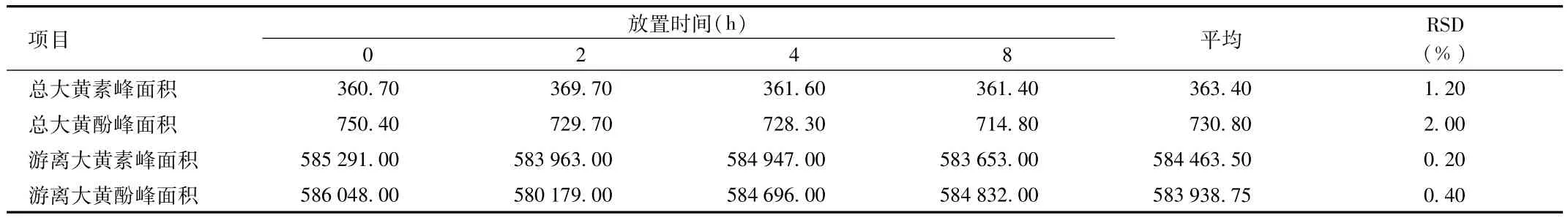
表8 大黄素和大黄酚供试品溶液的稳定性考察结果Tab.8 Stability investigation Results of emodin and chrysophanol
2.2.5 重复性实验:重复性试验结果见表9,6次重复测定结果的RSD分别为0.80%、0.50%,表明该方法重复性较好。
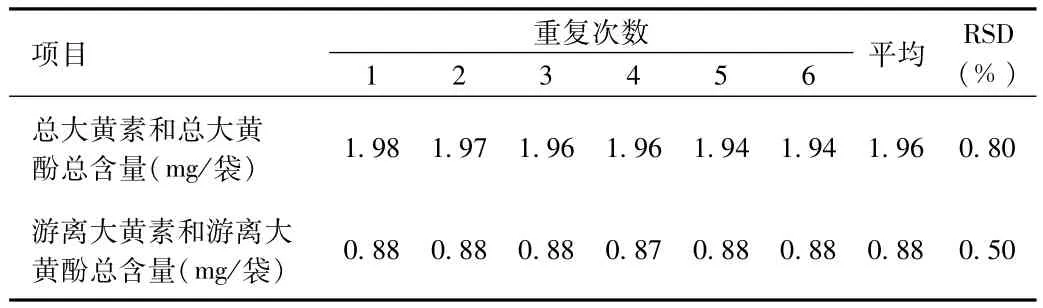
表9 大黄素和大黄酚重复性考察结果Tab.9 Repeatability Results of emodin and chrysophanol
2.2.6 加样回收率实验:大黄素、大黄酚加样回收率试验结果分别见表10、表11。试验结果表明,本方法回收率良好。
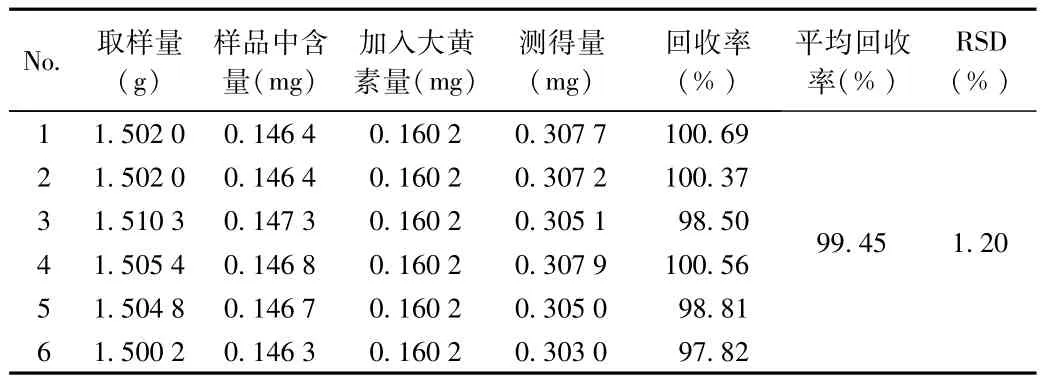
表10 大黄素加样回收率考察结果Tab.10 Recovery result of emodin
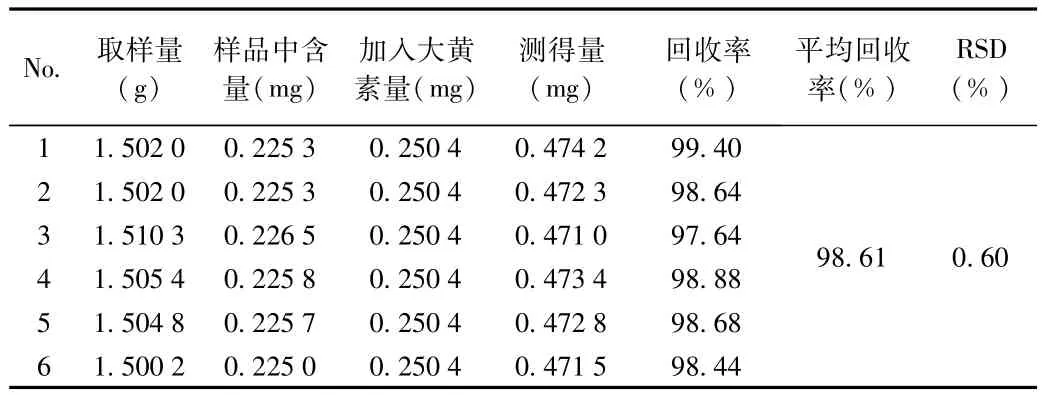
表11 大黄酚加样回收率考察结果Tab.11 Recovery result of chrysophanol
2.2.7 方法耐用性实验:不同牌号仪器,不同牌号、规格的色谱柱测定样品中栀子苷含量结果见表12。试验结果表明,该方法耐用性良好。

表12 大黄素和大黄酚方法耐用性考察结果Tab.12 Durability Results of emodin and chrysophanol
2.2.8 供试品含量测定与含量限度的制定:试验结果见表13。根据测定结果,结合药典对大黄药材中大黄酚和大黄素限度的规定,以及生产的实际情况及原料药材含量的波动,暂订:本品每粒含大黄以总大黄酚(C15H10O4)和总大黄素(C15H10O5)的总量计,不得少于1.5mg;以游离大黄酚(C15H10O4)和游离大黄素(C15H10O5)的总量计,不得少于0.55mg。
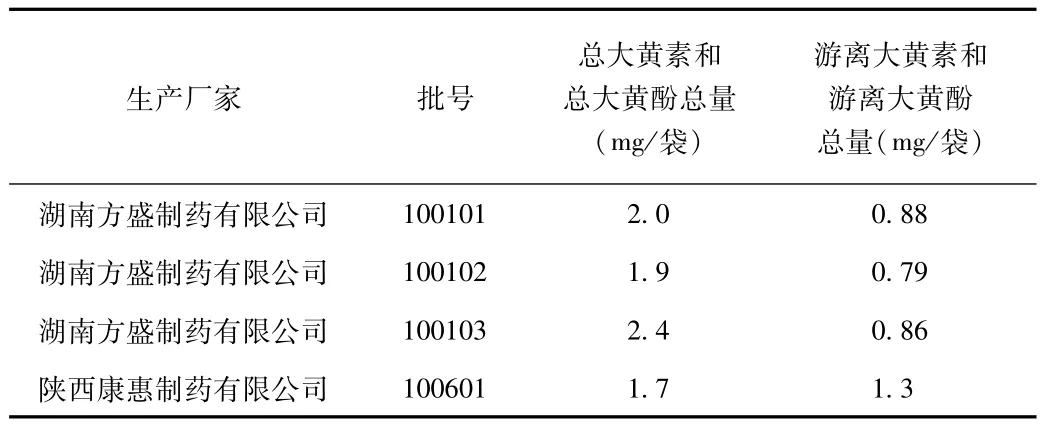
表13 八正颗粒样品中大黄素和大黄酚含量测定结果Tab.13 Determination results of emodin and chrysophanol in eight-positive particles
3 讨论
八正颗粒原标准为:①国家食品药品监督管理局标准(试行)YBZ10372005;②国家食品药品监督管理局标准(试行)YBZ00992005;③国家食品药品监督管理局标准YBZ08992006;④国家食品药品监督管理局标准YBZ02662006;⑤国家食品药品监督管理局标准YBZ09332006等五个标准,每个标准之间在指标性成分含量检测方法上均存在差异。
据文献报道,八正其他剂型均以栀子苷、大黄素、大黄酚为质量控制指标[7-13],综合全方各味药比例及其有效成分的提取和含量情况,本实验修订了栀子苷HPLC含量测定方法,拟定了含量测定标准;新增订了大黄素、大黄酚的HPLC含量测定方法并建立了新的质量标准,对原标准中含量测定从方法学上进行了明显的提高。
[1] 中国药典一部(S).中国医药科技出版社,2010.
[2] 苗明三,李振国.现代中药质量控制技术[M].北京:人民卫生出版社,36-38.
[3] 中国药品生物制品鉴定所等.现代实用本草学[M].北京:人民卫生出版社,123-124.
[3] 郑虎占.中药现代化研究与应用[M].北京:学苑出版社,76-77.
[4] 韩晋,蔡光明.反相高效液相色谱法测定复方茵陈注射液中氯原酸和栀子甙的含量[J].中国药学杂志,2012(3):9-10.
[5] 高宇明,曾锐.高效液相色谱法测定胃欣舒胶囊中大黄酸、大黄素和大黄酚的含量[J].中南药学,2009,7(4):275-276.
[6] 刘桂艳,王晔,马双成,等.木通属植物木通化学成分及药理活性研究概况[J].中国药学杂志,2014(5):1223-1225.
[7] 陈长水,桑旭峰.HPLC法测定八正合剂中芦荟大黄素、大黄酸、大黄素和大黄酚[J].中国卫生检验杂志,2011,21(5):1088-1089.
[8] 陈金文,曹林林.HPLC法测定八正合剂中栀子苷的含量[J].陕西中医药学院学报,2013,26(4):61-62.
[9] 孟婷,郭建丽.HPLC法测定八正片中栀子苷的含量[J].陕西中医,2012,33(7):893-894.
[10] 冉长清,陈万群.八正合剂的主要药效学研究[J].中成药,2014,22(8):565-567.
[11] 陈红英,蒋平.八正合剂中桅子昔的含量测定[J].中国药师,2006,9(1):17-18.
[12] 金灿,姜宁华.八正颗粒的制备及临床应用[J].中国医院药学杂志,2011,21(11):693-694.
[13] 黄顺旺.八正颗粒质量标准的初步研究[J].中国实验方剂学杂志,2009,15(11):20-22.
(编校:李璐璐)
Investigate the improvement of quality standard on eight-positive particles
SHENGWang-peng
(College of Biological and Chemical,Hainan College of Science and Technology,Haikou 571126,China)
ObjectiveTo improve the content determination of eight-positive particles,and better control drug quality.MethodsGardenin,emodin and chrysophanol of eight-positive particles were determined by HPLC.Revised content determination standards and improved the standards of quality control.ResultsThe revised content determinations of gardenin, emodin and chrysophanol were simple and feasible, and had high sensitivity.ConclusionUnification the quality standards of eight positive granules,the standards provide the basis for standardizing themarket of eightpositive particles.
eight-positive particles;gardenin;emodin;chrysophanol;quality standards
R283.6
A
1005-1678(2014)04-0164-05
海南省自然科学基金(812186)
盛望鹏,男,博士,讲师,研究方向:中药学,E-mail:758691571@qq.com。
