诱导食用真菌代谢生产木聚糖酶的研究
2014-09-17邢振楠臧海莲王丹丽范冬茹
邢振楠,臧海莲,王丹丽,范冬茹
(1.伊春林业科学院,黑龙江伊春153000;2.东北农业大学)
木聚糖酶(xylanase)是一类能够破坏植物纤维组织,降解半纤维素,主要成分为木聚糖的一组酶的总称,属于水解酶、胞外酶类,具有可诱导性。木聚糖酶已被广泛应用于工业生产,动物饲喂,食品加工,能源开发,环境治理,造纸业以及功能性低聚糖制备等领域[1-4],同时,还可为食用菌品种选育及分类提供重要参考[5]。木聚糖酶产生菌主要来源于自然菌株筛选,或通过诱变、基因工程、蛋白质工程等分子技术改造产酶基因改变及提高菌体木聚糖酶分泌量。目前国内外的研究主要集中在利用工程化菌株生产木聚糖酶,研究最多的是青霉、木霉、黑曲霉、链霉菌、酵母菌[6-9]等。利用大型食用真菌液体发酵生产木聚糖酶鲜有报道。本研究以不同种木聚糖结构类似物诱导液体发酵培养食用菌菌丝,从66株不同种的大型食用真菌中筛选产木聚糖酶能力较强的菌株,进行诱导条件优化以确定最佳产木聚糖酶条件,同时,对液体发酵食用菌菌丝的多糖含量进行测定,为木聚糖酶生产及食用菌菌丝深加工提供基础数据和研究资料。
1 材料与方法
1.1 菌种及药品
66个种(11株灵芝、9株木耳,18株香菇,及28株其他大型真菌)的食用真菌菌丝体为实验对象,菌种来自全国不同地域的多家科研机构,部分野生品种采自黑龙江省伊春市小兴安岭地区。本实验药品均为分析纯化学品。
1.2 培养基及培养方式
诱导培养基Ⅰ(g/L):木聚糖类似物,蛋白胨2.0 g, 酵母膏2.0 g, MgSO4·7H2O 0.5 g , K2HPO41.0 g , KH2PO40.46 g。
诱导培养基Ⅱ(g/L):马铃薯200.0 g煮沸30min浸出液,木聚糖类似物。
其中木聚糖类似物:可溶性淀粉、葡聚糖、羧甲基纤维素钠、木聚糖、葡萄糖、木糖、微晶纤维素,添加浓度按实验组别要求。
3,5-二硝基水杨酸(DNS)试剂:将6.3 g DNS和262.0 mL 2M NaOH溶液,加到500.0 mL含有185.0 g酒石酸钾钠的热水溶液中,再加5.0 g结晶酚和5.0 g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
柠檬酸-磷酸二氢钠缓冲液(pH5):0.2 mol/L Na2HPO410.3 mL,0.1 mol/L柠檬酸 9.7 mL。
1.3 菌株培养及木聚糖酶活力测定
1.3.1 食用真菌菌丝产木聚糖酶诱导培养
2种不同诱导培养基与7种诱导底物的不同浓度交叉组合,150 r/min、25℃恒温液体摇瓶培养,培养时间与培养基pH值根据实验组要求设定,测算66种大型食用真菌菌丝诱导培养后产木聚糖酶的酶活,比较产酶能力。
1.3.2 木聚糖酶活力定义
1 mL酶液在温度为50℃,pH值5.0条件下,1min水解木聚糖生成1μmol木糖还原物质的量为1个酶活力单位,以IU/mL表示。
1.3.3 超薄层琼脂板扩散法快速检测法[10-11]
配制含0.1%木聚糖-柠檬酸磷酸二氢钠琼脂胶板,待胶板冷凝后在其上打出若干个直径为0.7 cm的孔穴,用微量注射器向孔穴内适量加入粗酶液,3重复。加入酶液的琼脂薄板置50℃条件下,缓冲液保湿反应3 h。取出薄板,用0.1%刚果红液染色30 min后,lM NaC1溶被中漂洗2次,每次5min,此时显现透明圈,再放入5%乙酸中至底物变为紫色,游标卡尺测量透明圈直径,比较木聚糖酶的活性大小。
1.3.4 DNS法[12-13]
取4支洗净烘干的20 mL具塞刻度试管,编号后各加入2 mL 1%木聚糖溶液,并向1号试管中加入5 mL DNS溶液以钝化酶活性,将4支试管同时在50℃水浴中预热10 min,再各加入酶液1 mL, 2号试管中加入等体积的蒸馏水替代酶液,50℃ 水浴中保温3 h后取出,立即向2、3、4号试管中各加入5 mL DNS溶液以终止酶反应,充分摇匀后沸水浴5 min,取出冷却后用蒸馏水定容至20 mL,充分混匀。以1号试管溶液为空白对照调零点,在540 nm波长下测定2、3、4号试管液的OD值。
1.4 不同环境因素对诱导食用真菌提高木聚糖酶产量的影响
根据不同菌种利用诱导底物的能力添加木聚糖类似物研究不同底物浓度对真菌菌丝产木聚糖酶能力的影响,分别以0.1%、0.25%、0.5%、1%的梯度差添加诱导底物作为浓度试验组,以不添加诱导底物培养基培养作对照;分别以pH值为4.0、5.0、6.0、7.0和8.0作为酸碱度试验组,以pH值7.0作对照;分别以15、20、25、30、35 d作为培养天数试验组。以上各试验组分别以诱导培养基Ⅰ、Ⅱ为培养液, 等量接种,按照1.3.1操作,设置对照组,按照1.3.3及1.3.4定时检测实验菌株产木聚糖酶能力。
1.5 诱导食用真菌产木聚糖酶条件优化
参考1.4单因素对食用真菌菌株产酶的影响结果,设计3因素3水平实验,选用L9(33)正交表,拟定的正交试验因素与水平见表1。
表1 实验因素与水平表
1.6 食用真菌菌丝胞内多糖提取
将50℃烘至恒重的食用菌菌丝体加入30倍蒸馏水,800 W微波处理10 min,过滤沉淀,取上清,加入95%乙醇,至乙醇终浓度为75%~80%,-4℃醇沉过夜。4000 r/min离心10 min沉淀食用菌粗多糖,30∶1水稀释沉淀,按照体积比3∶1加入sevag试剂(氯仿∶异戊醇=24∶1) ,涡旋震荡充分混匀,4000 r/min离心15 min去除蛋白及杂质,重复以上步骤,至蛋白质完全去除,取上清,3倍体积的95%乙醇沉淀多糖,4000 r/min离心15min后,沉淀物60℃烘干,所得即为食用菌多糖。
2 结果与分析
2.1 木聚糖酶高产食用真菌菌种筛选
经初筛和复筛后可最终确定黑木耳LK8、玉田平菇、香菇236三株食用真菌菌丝体在不同培养条件以木聚糖为诱导物,采用诱导培养基Ⅰ液体发酵培养一定时间后产木聚糖酶和多糖的能力相对较强,针对这3株菌进行后续实验。本实验筛选确定的可诱导高产木聚糖酶的黑木耳LK8、玉田平菇、香菇236均为伊春林科院保藏菌种。
2.2 单因素影响试验结果
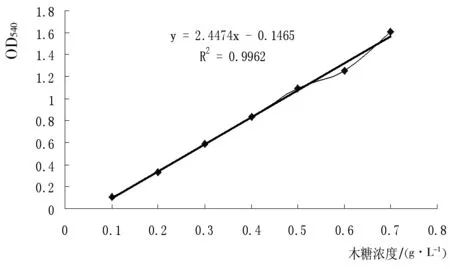
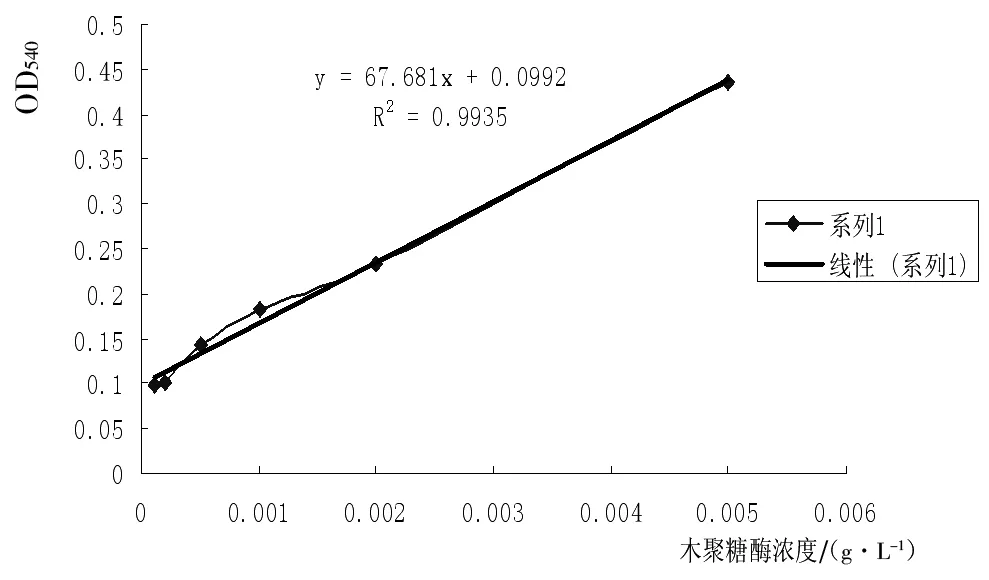
图1 木聚糖酶作用木糖酶活标准曲线
由图1可知,该实验设计和检测方法可行,酶活力可用OD540数值反应,检测木聚糖酶最小浓度为0.0001 g/mL,即可检测0.069 IU/mL活力的木聚糖酶。并且,实验发现,底物浓度一定,酶浓度高于一定值时DNS检测值不再变化。
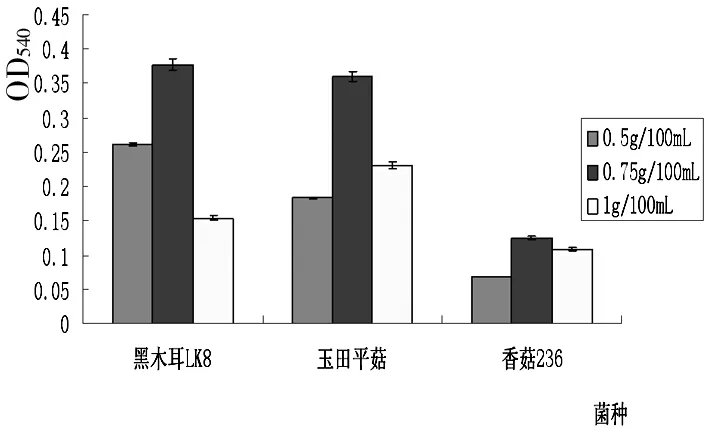
A
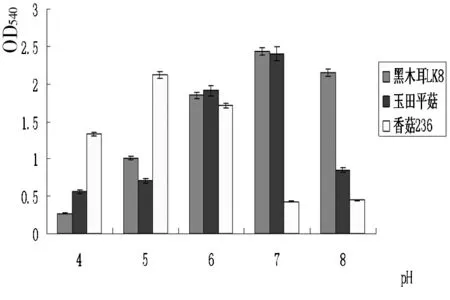
B
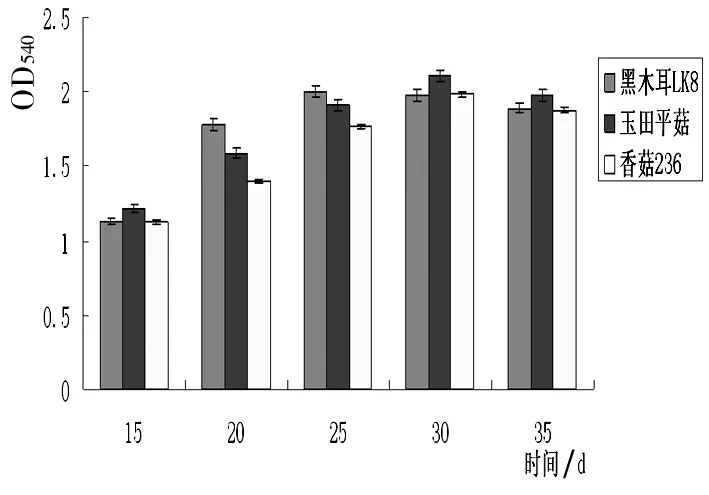
C
由图2可知,不同菌种产木聚糖酶的能力受环境因素影响较大。其中,以木聚糖为诱导底物,当每100mL培养基中加入0.75g木聚糖诱导不同菌种生产木聚糖酶均可获得较好的酶活,即酶产量最高。由图2B可知,培养液pH值对菌种产木聚糖酶影响较大,并且,不同菌种对培养液pH值要求不同,黑木耳LK8和玉田平菇在pH =7.0时,菌种产酶能力最强,黑木耳LK8对培养基的要求中性偏碱性(OD540=2.43),而玉田平菇则要求偏酸性(OD540=2.40),香菇236在pH =5.0时,菌种产酶能力最强(OD540=2.12),酸性条件下诱导该菌种产木聚糖酶能力较强。通过由图2C可知,经20~35d液体诱导培养3株菌均可产生较高活性的木聚糖酶,产酶能力较强,其中,黑木耳LK8诱导培养25d产酶效果最佳(OD540=2.0067),诱导培养30d玉田平菇和香菇236的产酶能力较高(OD540分别为2.1091,1.9851)。
2.3 诱导培养条件优化结果
直观分析结果见表2,由各因素均值分析可知:黑木耳LK8、玉田平菇、香菇236诱导产木聚糖酶酶活最高的最佳条件组合分别为A1B3C3,A2B3C3,A2B2C2,即最佳培养时间、pH值和底物木聚糖浓度(g/100mL)分别为20 d、7.5和1.0g/100mL;25 d、7.0和1.0 g/100mL;25 d、5.0和0.75 g/100mL。最佳条件组合时的酶活分别为:600.6IU/mL,672.5 IU/mL,345 IU/mL。由极差数据分析可知,黑木耳LK8、玉田平菇、香菇236诱导培养受各因素影响大小顺序分别为:诱导培养液pH>底物浓度>诱导时间,诱导培养液pH >诱导时间>底物浓度,诱导培养液pH >诱导时间>底物浓度,可见,本实验筛选出的3株经木聚糖诱导产木聚糖酶活性较高的食用真菌诱导过程中诱导培养液pH值是影响诱导效果的主要因素。
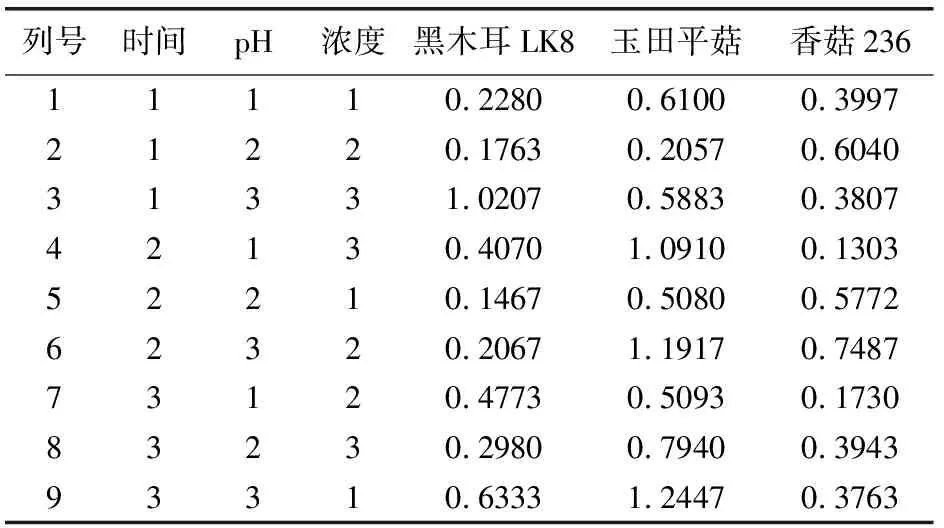
表2 正交试验结果直观分析表
2.4 食用菌多糖产量

图3 菌丝多糖产量图
15 d相同培养条件下,每100 mL黑木耳LK8、玉田平菇及香菇236液体培养菌丝体产精多糖量分别为0.0278 g, 0.0121 g,0.0025 g,菌丝多糖产率如图3所示。
3 讨论
木聚糖(xylan)是植物半纤维素的主要成份,是除纤维素之外自然界中最为丰富的多糖,也是自然界中最为丰富的可再生资源之一。水解酶系中各种酶相互之间协同完成,其中木聚糖酶是最关键的,然而,由于木聚糖复杂的化学结构和异质性,很大一部分木聚糖未得到有效利用,造成巨大的资源浪费。木聚糖酶是自然界中专性降解木聚糖的水解酶系,经过木聚糖酶的系内各种酶相互之间协同作用,木聚糖可完全被降解为小分子而参与自然生态循环。根据木聚糖酶的这一特性,生产木聚糖酶剂参与工业生产是可以低能耗高效率地利用木聚糖的最佳方式,因此,随着应用领域的增多,如何提高产量、降低成本,获得适应性强,应用范围广的木聚糖酶成为研究者们主要研究方向。
由微生物代谢生产的木聚糖酶根据理化性质的不同可分为酸性、中性、碱性木聚糖酶;根据作用底物的特异性,又可将木聚糖酶分为特异性和非特异性。本研究发现,诱导培养过程中食用菌菌丝体对培养基酸碱度要求差别很大,后续将就食用菌代谢生产的木聚糖的理化性质进行进一步研究,确定其理化性质及应用范围,为木聚糖酶的使用应用积累数据。并且,实验发现,菌丝生长前期产多糖比率较高,随培养时间延长多糖比率有所下降,产酶能力则是随菌丝代谢时间延长而增加,平衡产酶和产多糖时间点,是后续的主要研究内容。
食用菌做为主要的木腐性、草腐性真菌,通过分泌具有专性和高活性的纤维素酶和木聚糖酶系分解培养基质中的纤维素及半纤维素再加以吸收利用。另一方面,木聚糖酶属胞外酶,具有可诱导性[14-16],有研究表明,木聚糖及木聚糖类似物具有诱导木聚糖酶合成的功能[17-18],可增加该酶代谢量,因此,开发研究利用食用菌代谢生产具有高活性的木聚糖酶是具有理论依据和可行性。并且,食用菌种类众多,液体发酵技术成熟,食用菌多糖等附加值产值高,所以,探究大型食用真菌的深层价值,利用其生产木聚糖酶及其它酶系将成为未来科研的一个主要方向。
4 结论
4.1 以木聚糖为诱导底物,对66株大型食用真菌进行液体发酵诱导培养,筛选获得3株产木聚糖酶较高的菌株,分别为黑木耳LK8、玉田平菇、香菇236。
4.2 单因素结合正交试验可确定黑木耳LK8、玉田平菇、香菇236诱导产木聚糖酶酶活最高的最佳条件组合培养时间、pH值和底物木聚糖浓度(g/100mL)分别为20d、7.5和1.0g/100mL;25 d、7.0和1.0 g/100mL;25 d、5.0和0.75 g/100mL。
4.3 最佳条件组合时的酶活分别为:600.6IU/ mL,672.5 IU/ mL,345 IU/ mL,培养液pH值是影响诱导效果的主要因素。
[1] Beg QK, Bhushan B, Kapoor M, Hoondal GS.Enhanced production of a thermostable xylanase from Streptomyces sp.QG-11-3 and its application in biobleaching of eucalyptus kraft pulp[J].Enzyme and Microbial Technology, 2000,27(7): 459-466.
[2] Mathlouthi N, Mohamed MA, Larbier M.Effect of enzyme preparation containing xylanase and β-glucanase on performance of laying hens fed wheat/barley- or maize/soybean meal-based diets[J].British Poultry Science, 2003,44(1): 60-66.
[3] Moure A, Gullón P, Domínguez H, Parajó JC.Advances in the manufacture, purification and applications of xylo-oligosaccharides as food additives and nutraceuticals[J].Process Biochemistry, 2006,41(9): 1913-1923.
[4] Dutron A, Georis J, Genot B, Dauvrin T, Collins T, Hoyoux A, Feller G.Use of family 8 enzymes with xylanolytic activity in baking.World Intellectual Property Organization.2004.
[5] 韩增华, 张丕奇, 孔祥辉, 等.黑木耳胞外酶活变化与栽培性状比较的研究[J].食用菌学报, 2007, 14(4):41-46.
[6] Malabadi RB, Raghvendra S, Kumar SV.Production of cellulose-free xylanase from a novel yeast used for biobleaching in paper industry[J].Research Journal of Microbiology, 2007,2(1): 24- 33.
[7] Gigi C, Adina C, Gabriela E.Optimization of biosynthesis conditions and catalytic behavior evaluation of cellulose-free xylanase produced by a new Streptomyces sp.Strain[J].AUDJC-Food Technology, 2011,36(1): 34-44.
[8] 于俊杰, 赫荣琳, 武改红, 等.复合木质纤维素酶菌株筛选及其培养条件优化[J].生物技术通报, 2013(4): 101-109.
[9] 李里特, 丁长河, 江正强, 等.一株产木聚糖酶链霉菌的鉴定及发酵产酶[J].微生物学通报, 2003,30(6): 59-64.
[10] 郭清吉.木聚糖酶产生菌的筛选、酶学性质及宏基因组文库的构建与筛选[D].青岛科技大学, 2008.
[11] 王宜磊, 邓振旭.透明圈法快速筛选半纤维素分解菌[J].生物技术, 2000.10(1): 37-39.
[12] 沈诚, 李戎, 胡婷莉, 等.木聚糖酶活力的二硝基水杨酸(DNS)测定法[J].印染, 2011(2): 35-39.
[13] Bailey MJ, Biely P, Poutanen K.Interlaboratory testing of methods for assay of xylanase acticity[J].J Biotechnol, 1992,23(5): 257-270.
[14] 韩晓芳, 郑连爽.产木聚糖酶嗜碱细菌的筛选及产酶条件研究[J].环境污染治理技术与设备, 2002,3(11):25-27.
[15] 刘超纲, 勇强, 余世袁.纤维素和木聚糖复合诱导合成木聚糖酶的研究[J].林产化学与工业, 2001,21(1): 69-73.
[16] Pallavi D, Vivekanand V, Ganguly R.Parthenium sp.as a plant biomass for the production of alkalitolerant xylanase from mutant Penicillium oxalicum SAUE-3.510 in submerged fermentation[J].Biomass and Bioenergy, 2009,33(4): 581-588.
[17] Rajoka MI.Regulation of synthesis of endo-xylanase and β-xylosidase in Cellulomonas flavigena : a kinetic study[J].World Journal of Microbiology and Biotechnology, 2005,21(4): 463-469.
[18] Oliverira LA, Porto Ana LF, Tambourgi EB.Production of xylanase and protease by Penicillium janthinellum CRC 87M-115 from different agricultural wastes[J].Bioresour Technol, 2006, 97(6): 862-867.
