GLP-1对高糖诱导乳鼠心肌细胞损伤的保护作用及机制分析
2014-09-15杨啸范丽芬姚艳玲焦向英
杨啸 范丽芬 姚艳玲 焦向英
基础研究
GLP-1对高糖诱导乳鼠心肌细胞损伤的保护作用及机制分析
杨啸 范丽芬 姚艳玲 焦向英
作者单位:030001 太原市,山西医科大学生理教研室
目的 以高糖刺激的乳鼠心肌细胞模拟糖尿病诱导心肌细胞损伤,给予胰高血糖样多肽-1(GLP-1)预处理,观察其对高糖引起的心肌细胞凋亡的影响,以及细胞内硫氧还蛋白(Trx)系统的变化。方法 将分离培养48 h的大鼠乳鼠心肌细胞分为3组:①正常对照组:使用含葡萄糖5.5 mmol/L的DMEM培养基加入甘露醇20 mmol/L作为对照培养基进行培养;②高糖组:使用含葡萄糖25 mmol/L的DMEM培养基作为高糖培养基进行培养模拟糖尿病;③高糖+GLP-1组:以含葡萄糖25 mmol/L的DMEM培养基加入终浓度10 nmol/L的GLP-1继续培养模拟糖尿病GLP-1干预。心肌细胞分别在三种培养基中培养24 h后测定指标。结果 ①与正常组比较,高糖组细胞乳酸脱氢酶活性、细胞凋亡率、p38激酶活性均显著升高,Trx活性明显降低(P<0.05);硫氧还蛋白表达无明显变化,但细胞内蛋白硝基化的标志物3-硝基酪氨酸生成量增加,Trx的内源性抑制蛋白硫氧还蛋白相互作用蛋白(TXNIP)表达明显上调,活性氧(ROS)生成和丙二醛(MDA)的含量均明显升高(P均<0.05)。②与高糖组比较,高糖+GLP-1组乳酸脱氢酶活性、细胞凋亡率、p38激酶活性明显降低,Trx活性明显恢复(P<0.05),3-硝基酪氨酸生成、TXNIP表达、活性氧生成和丙二醛的产生量均明显降低(P均<0.05)。结论 高糖可引起培养的乳鼠心肌细胞发生损伤和凋亡,这种损伤与高糖引起的Trx活性和功能下降有关。蛋白的硝基化、TXNIP的表达上调均可抑制Trx的活性,使其抗自由基和抗凋亡功能减弱,自由基生成增加,p38激酶介导的凋亡途径加强,进而引起心肌细胞损伤和凋亡。GLP-1处理可使高糖引起的TXNIP表达明显下调,蛋白硝基化减轻,Trx活性得到改善,细胞自由基损伤和凋亡减轻,通过对Trx系统的保护而逆转高糖引起的细胞损伤和凋亡。
硫氧还蛋白; 凋亡; 胰高血糖样多肽-1; 心肌细胞
糖尿病的发病率增长迅速,已成为当前威胁人类健康、缩短寿命的最重要疾病之一[1]。糖尿病作为一种慢性疾病,长期的代谢紊乱可引起多个器官发生病变,其中以心脏并发症的危害最严重,已成为糖尿病患者死亡的主要危险因素,高达糖尿病患者死亡原因的55%[2]。在心脏,长期的慢性损伤主要引起细胞凋亡。研究发现,糖尿病患者心肌细胞凋亡发生率为非糖尿病患者的85倍[3]。
近年来,胰高血糖素样肽-1(GLP-1)在糖尿病的发生、发展及治疗领域方面的作用备受关注,尤其是对胰岛B细胞凋亡的抑制作用方面。而我们知道GLP-1受体(GLP-1R)分布广泛,除胰腺β细胞外,还分布于大脑、肺、心脏、肾脏等,其分布的广泛性也决定其作用的广泛性。研究发现,GLP-1在这些组织中发挥作用与其对细胞凋亡的影响密不可分。
在诸多可能诱导细胞发生凋亡的因素中,考虑到大量自由基生成在糖尿病发病机制中的核心作用,我们选择了硫氧还蛋白(thioredoxin,Trx)系统这种既有强大抗自由基损伤功能,又有重要促生长和凋亡抑制功能的蛋白系统作为探讨GLP-1抗心肌细胞凋亡的靶点。而TXNIP是目前发现的唯一一种内源性的Trx结合抑制蛋白[4]。TXNIP可与Trx结合,结合的Trx失去凋亡抑制功能而使凋亡增加[5]。
1 材料与方法
1.1 主要材料
1.1.1 主要仪器和试剂 DMEM培养基购于Hy-Clone公司;胎牛血清购于杭州四季青生物工程有限公司;GLP-1、胰蛋白酶、Ⅱ型胶原酶、5-溴脱氧尿嘧啶核苷(BrdU)、胰岛素(Insulin)、NADPH、Tris-HCL、DTNB、 盐酸胍 (Guanidine hydrochloride)、Thioredoxin Reductase、β-actin 抗 体(Monoclonal Anti-β-actin)、PVDF 膜等均购于 Sigma公司;BCA试剂盒购于Pierce;Trx抗体(Rabbit anti-thioredoxin polyclonal antibody)购于 Millipore公司;辣根酶标记山羊抗兔IgG购于北京中杉金桥生物技术有限公司;3-硝基酪氨酸(3-NT)测定试剂盒购于上海西唐生物科技有限公司;乳酸脱氢酶测定试剂盒购于南京建成生物集团有限公司;活性氧(ROS)测定试剂盒购于普利莱基因技术有限公司;丙二醛(MDA)测定试剂盒购于碧云天生物科技有限公司。
1.1.2 主要仪器 BJ-1CD单人单面垂直净化工作台购于上海博讯实业有限公司医疗设备厂;IX51倒置荧光显微镜购于日本OLYMPUS公司;Heracell 150i CO2培养箱购于美国Thermo Electron公司;Mx3005P Real-Time PCR仪(美国STRATAGENE公司);酶标仪(美国Molecular Devices公司);电泳仪和半干转印(美国BIO-RAD公司);Kodak Image Station 400(美国 Kodak公司);FACS Calibur流式细胞仪(美国B-D公司)。
1.2 实验动物及分组
1.2.1 实验动物 1~3 d龄健康SD乳鼠(山西医科大学实验动物中心提供)。
1.2.2 实验分组 将分离培养48 h的大鼠乳鼠心肌细胞随机分为3组:①正常对照组:使用含葡萄糖5.5 mmol/L的DMEM培养基,加甘露醇20 mmol/L作为对照培养基进行培养;②高糖组:使用含葡萄糖25 mmol/L的DMEM培养基作为高糖培养基进行培养;③高糖+GLP-1组:使用含葡萄糖25 mmol/L的DMEM培养基加入终浓度10 nmol/L的GLP-1进行培养。三组细胞均继续培养24 h后收集上清液和细胞裂解液待测。
1.3 实验方法
1.3.1 培养基乳酸脱氢酶(LDH)活性测定 细胞损伤发生后,细胞内的LDH漏出到细胞外,因此可以通过测定培养基上清中LDH活性反映心肌细胞损伤的程度。本实验使用南京建成生物工程研究所乳酸脱氢酶测定试剂盒进行测定。LDH能催化乳酸生成丙酮酸,丙酮酸与2,4-二硝基苯肼反应生成丙酮酸二硝基苯腙,在碱性溶液中呈棕红色,在440 nm处有最大吸收峰,通过吸光度值可得出酶活力。收集各组细胞培养基上清0.5 ml,按乳酸脱氢酶测定试剂盒说明书操作,并计算乳酸脱氢酶活性。
1.3.2 流式细胞仪检测心室肌细胞凋亡 以标记了FITC的Annexin V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生,以Propidium Iodide(PI)来区分存活的早期细胞和坏死或晚期凋亡细胞。给药处理的心肌细胞培养24 h后用0.25%的胰酶消化,然后加入含10%FBS的DMEM液终止消化。洗涤后加150 μl缓冲液重悬细胞,细胞悬液加入10 μl Annexin V-FITC轻轻混匀,室温避光孵育15 min,加入5 μl PI及150 μl缓冲液立即上机检测。
1.3.3 p38活性分析 按试剂盒中提供的试剂和方法,采用免疫沉淀(immunoprecipitation,IP)的方法,将定量后的200 μl细胞裂解物和20 μl磷酸化的p38一抗4℃孵育过夜,次日将混合物14 000 g离心 1 min,随后用 1×lysis buffer和 1×Kinase buffer各洗 2 遍,然后和 50 μl 1×Kinase buffer、kinase substrate、ATP(10 mmol/L)30 ℃孵育 30 min,4×SDS上样缓冲液终止反应,95℃煮样5 min。用Western immunoblot方法检测ATF的表达量,方法和条件同前面的Western blot。
1.3.4 成年大鼠心肌细胞硫氧还蛋白(Trx)活性的测定 用胰岛素还原法检测成年大鼠心肌细胞Trx活性,即将心肌细胞裂解液(以Cell signaling公司的cell lysis buffer常规提取细胞蛋白,并测定蛋白浓度)与胰岛素、TR和NADPH孵育。酶标仪检测412 nm处的OD值,计算出Trx的活性。
1.3.5 3-硝基酪氨酸含量测定 使用酶联免疫吸附法(ELISA)测定。用抗大鼠3-NT单抗包被于酶标板上,标准品和样品中的3-NT与单抗结合,加入生物素化的抗大鼠3-NT,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入底物工作液显蓝色,最后加终止液硫酸,在450 nm处测OD值,3-NT浓度与OD值呈正比,通过绘制标准曲线求出标本中3-NT浓度。
1.3.6 Real-time PCR方法测定培养的乳鼠心肌细胞TXNIP的mRNA表达 心肌细胞RNA提取使用RNAiso Plus,cDNA合成使用PrimeScriptTM RT reagent Kit。条件:37 ℃,15 min;85 ℃,5 s;4 ℃保存。Real time PCR检测仪器为Mx3005P real time PCR仪。反应条件为:预变性95℃30 s;PCR反应95℃5 s,60℃ 20 s,45个循环。熔解曲线设置 95℃1 min,55 ℃ 30 s,95 ℃ 30 s。选用 GAPDH(引物由Invitrogen 公司合成)作为参照,结果采用 2-ΔΔCt法进行相对定量分析。使用的相关基因引物序列如下:
GAPDH 引物序列(GeneID:24383)
上游引物:5’-2ATGGTGAAGGTCGGTGTG2-3’
下游引物:5’-2AACTTGCCGTGGGTAGAG2-3’
TXNIP引物序列(GeneID:117514)
上游引物:5’-GGCAATCAGTAGGCAAGTCTCCA-3’
下游引物:5’-TTCCGACATTCACCCAGCAA-3’
1.3.7 Western blot方法测定培养48 h后乳鼠心肌细胞Trx1、TXNIP的蛋白表达 将培养皿内培养基吸出,1×PBS清洗2遍,每皿内加入裂解液50 μl,吸入1.5 ml EP管内,超声波细胞粉碎机裂解细胞,并以10 000 rpm、4℃离心10 min,取上清液。BCA法进行蛋白定量,取等量蛋白(60 μg)进行SDSPAGE电泳分离(BIO-RAD)。先在恒压80 V电泳约20 min,随后120 V电泳90 min;然后在25 V的条件下转膜40 min,将蛋白转移至PVDF膜(BIORAD)上;5%BSA室温封闭2 h,分别加入相应的一抗(TXNIP 稀释度 1∶1250,Trx稀释度为 1∶2500;β-actin的稀释度为 1∶1000),4 ℃过夜;次日用 1×洗膜缓冲液洗4次,每次5 min。加入用TBST稀释HRP标记的山羊抗兔二抗(1∶3000),将膜置于其中室温轻摇1 h,同样的方法洗膜20 min。加入DAB显色液(Vector),室温下孵育 3 min,用 Kadak成像扫描仪内扫描拍摄蛋白条带。以β-actin为内参照,实验在相同的条件下至少重复6次。利用Alpha View Version 3.4.0.0图像分析软件进行条带分析。
1.3.8 流式细胞仪检测细胞内活性氧生成 去除细胞培养液,用PBS洗2次,加入1 ml按照1∶1000用无血清培养液稀释DCFH-DA。继续在CO2培养箱37℃孵育细胞1 h,用无血清细胞培养液洗涤细胞3次,用0.25%胰酶消化收集各组细胞,洗涤后加150 μl缓冲液重悬细胞用流式细胞仪进行检测。
1.3.9 培养48 h后乳鼠心肌细胞脂质过氧化水平——丙二醛含量检测丙二醛(Malondialdehyde,MDA)是生物体脂质氧化的天然产物。细胞发生氧化应激(oxidative stress)时,会发生脂质氧化。一些脂肪酸氧化后逐渐分解为一系列复杂的化合物,其中包括MDA,此时通过检测MDA水平即可检测脂质氧化的水平。丙二醛在较高温度及酸性环境中可与TBA发生反应,形成红色的MDA-TBA加合物,MDA-TBA加合物在535 nm处有最大吸收,用酶标仪读出535 nm的OD值,然后根据试剂盒中的标准品计算出发生脂质氧化细胞的比例。
1.4 统计学方法 应用统计软件SPSS 16.0进行统计分析。实验结果以±s表示,样本例数n代表所测样品来源的乳鼠例数,组间比较使用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 乳鼠心肌细胞接种后48 h的形态观察 接种48 h后细胞形成细胞簇或细胞单层,贴壁细胞呈梭形、多角形,通过周边突起的伪足相互交联,铺满瓶底,呈放射状排列的同心圆状或峰谷样生长,细胞搏动逐渐同步,收缩有力,于72 h达高峰。
2.2 乳酸脱氢酶(LDH)活性测定 经检测,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞的乳酸脱氢酶活性增高[(1.685±0.130)比(1.000±0.130),P<0.05],提示高糖可引起心肌细胞损伤;而GLP-1组乳酸脱氢酶活性下降[(0.725±0.200)比(1.685±0.130),P<0.05],表明 GLP-1处理能明显减轻高糖对细胞的损伤。见图1。
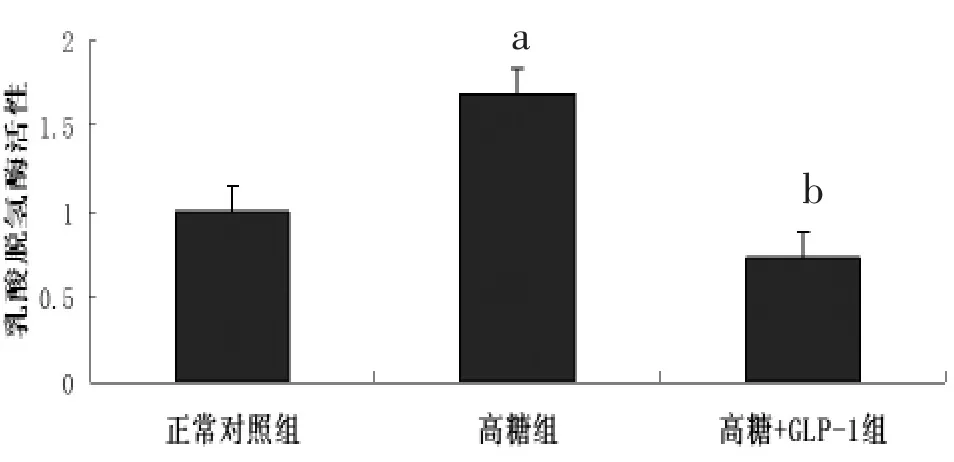
图1 高糖刺激和GLP-1预处理对乳鼠心肌细胞乳酸脱氢酶活性的影响
2.3 流式细胞仪检测心室肌细胞凋亡 结果显示,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞凋亡明显增加 [(16.60±2.35)%比 (9.99±1.97)%,P<0.05],同时给予GLP-1预处理后凋亡减少[(10.06±1.48)%比(16.60±2.35)%,P<0.05],表明GLP-1对高糖诱导的心肌细胞凋亡具有保护作用。见图2。
2.4 P38活性分析 结果显示,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞P38激酶活性增高[(1.456 ±0.080)比(1.000 ±0.163),P<0.05],给 予GLP-1 处理后降低[(0.782±0.094)比(1.456±0.080),P<0.05]。见图 3。
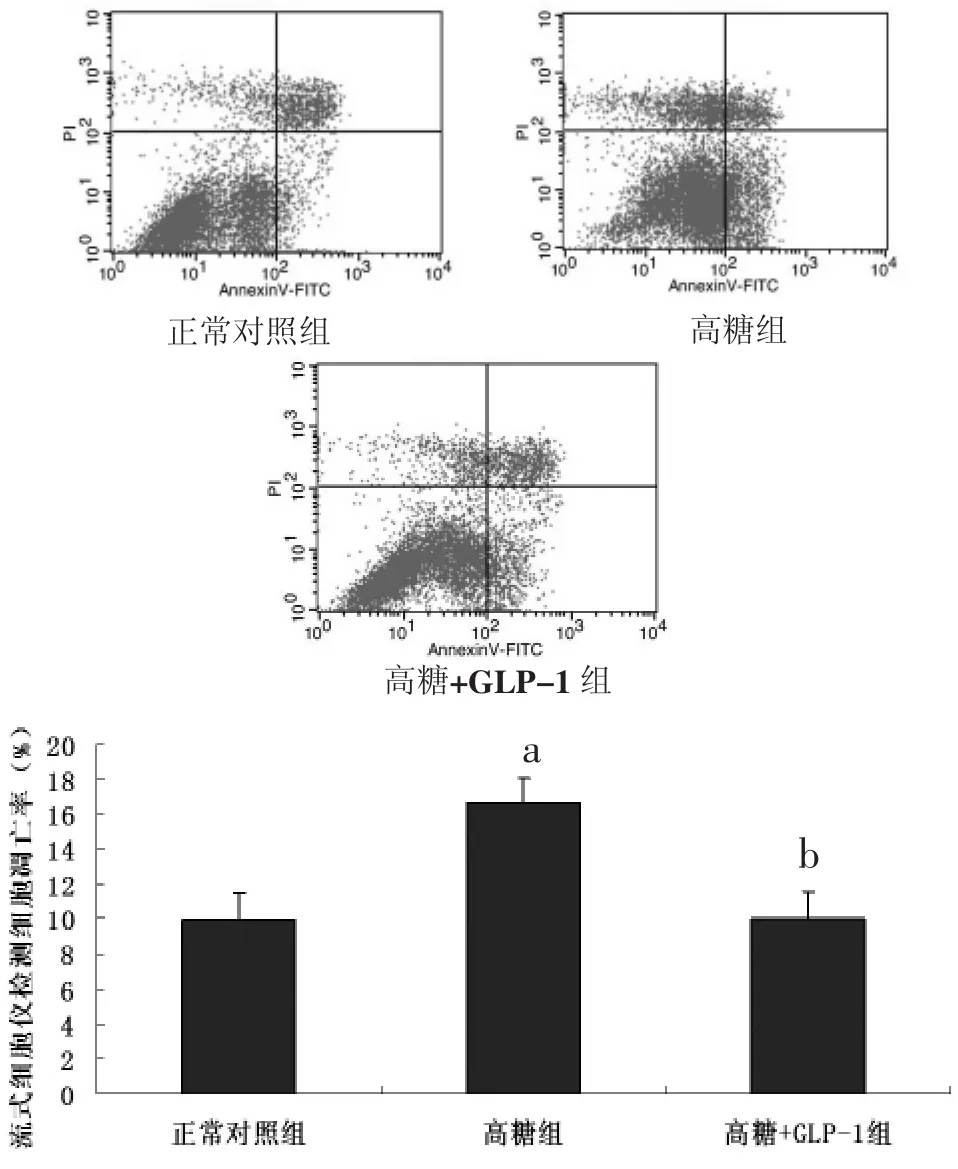
图2 高糖刺激和GLP-1预处理对乳鼠心肌细胞凋亡率影响
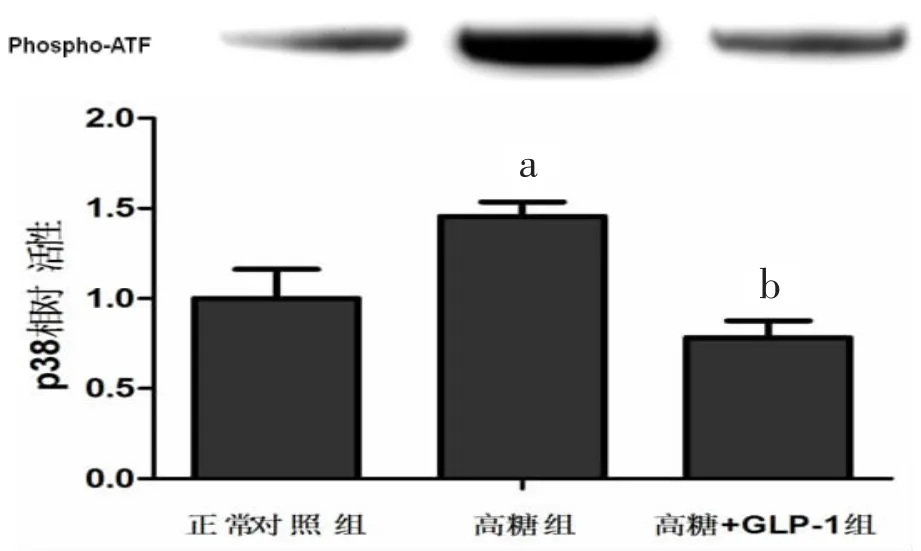
图3 高糖刺激和GLP-1预处理对乳鼠心肌细胞P38活性影响
2.5 TRX活性分析 经检测,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞TRX活性显著降低 [(0.33±0.02) 比 (1.00±0.11),P<0.05],给予GLP-1处理后高糖引起的TRX活性降低得以改善[(1.15±0.07)比(0.33±0.02),P<0.05]。见图 4。
2.6 3-硝基酪氨酸含量测定 经检测,与正常对照组心肌细胞相比,高糖组心肌细胞内3-NT含量较高[(16.978±0.200)μg/ml比(7.876±1.574)μg/ml,P<0.05],给予 GLP-1处理后 3-NT含量降低[(9.550±0.500)μg/ml比(16.978±0.200)μg/ml,P<0.05]。见图 5。
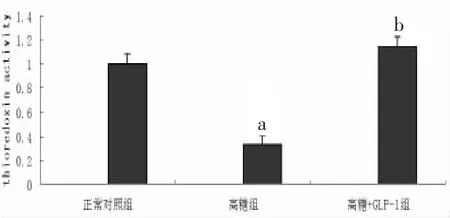
图4 高糖刺激和GLP-1预处理对乳鼠心肌细胞Trx活性影响

图5 高糖刺激和GLP-1预处理对乳鼠心肌细胞3-硝基酪氨酸含量
2.7 硫氧还蛋白表达 结果显示,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞Trx1蛋白表达未见明显变化[(1.001±0.018)比(1.000±0.023),P>0.1]。见图 6。
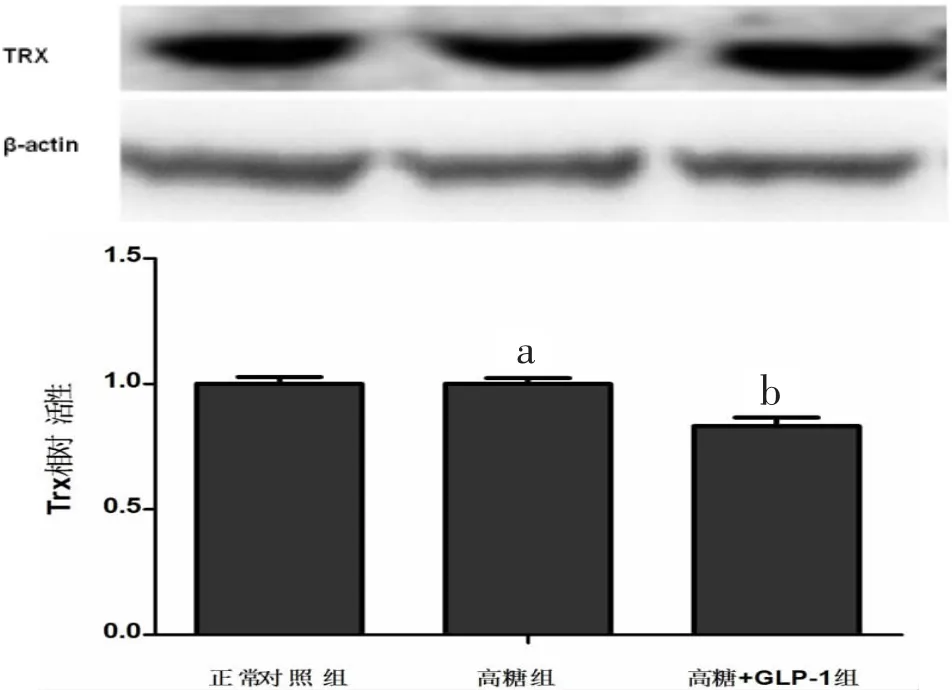
图6 高糖刺激和GLP-1预处理对乳鼠心肌细胞Trx相对表达量的影响
2.8 TXNIP表达
2.8.1 蛋白水平 经检测,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞TXNIP表达明显增高[(1.48±0.08)比(1.00±0.05),P<0.05],给予 GLP-1处理逆转了由高糖引起的TXNIP表达的改变[(0.97±0.03)比(1.48±0.08),P<0.05]。见图 7。
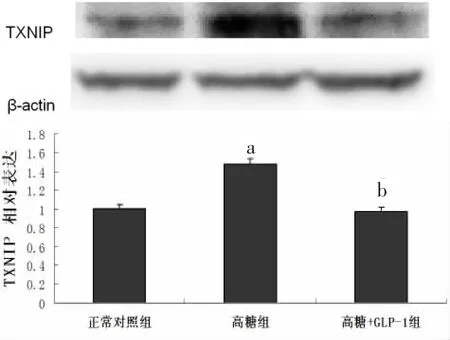
图7 高糖刺激和GLP-1预处理对乳鼠心肌细胞TXNIP表达量的影响
2.8.2 mRNA水平 经检测,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞在培养48 h后,TXNIP mRNA 水平显著增加[(12.873±1.726)比(1.000±0.000),P<0.05], 给 予 GLP-1 处 理 后TXNIP mRNA 水平明显降低 [(9.950±2.250)比(12.873±1.726),P<0.05]。见图 8。该结果提示,给予GLP-1处理能有效逆转由高糖引起的心肌细胞TXNIP mRNA水平的增加。
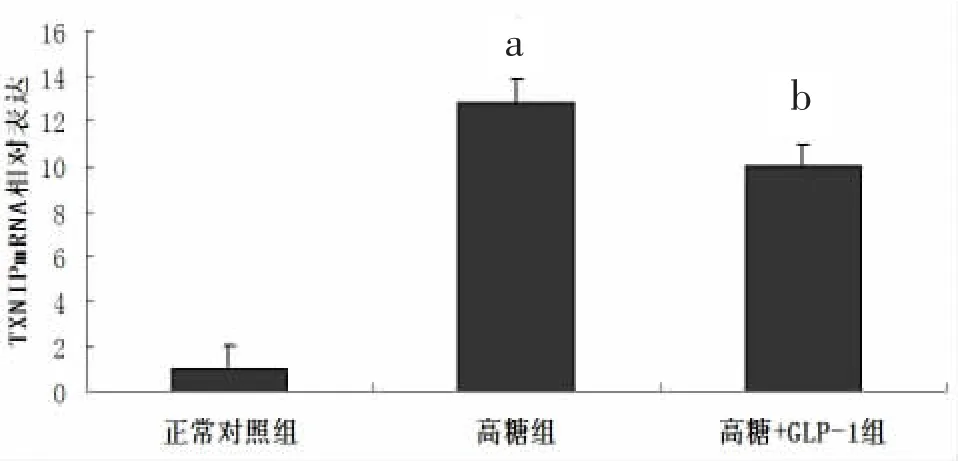
图8 高糖刺激和GLP-1预处理对乳鼠心肌细胞TXNIPmRNA相对表达量的影响
2.9 活性氧(ROS)生成测定 经检测,与正常对照组心肌细胞相比,高糖组乳鼠心肌细胞在培养48 h后,细胞内活性氧生成显著增加[(1.70±0.07)比(1.00±0.11),P<0.05],给予 GLP-1 处理后活性氧生成量降低[(0.69±0.09)比(1.70±0.07),P<0.05]。见图9。该结果提示,给予GLP-1处理能有效减少由高糖引起的心肌细胞内活性氧生成。
2.10 丙二醛(MDA)测定 经检测,与正常对照组心肌细胞相比,高糖组心肌细胞在培养48 h后,细胞内 MDA 水平显著增加[(11.043±0.730)μmol/mg比(5.506±0.360)μmol/mg,P<0.05],给予 GLP-1 处理后 MDA 水平明显降低[(4.958±0.370)μmol/mg比(11.043±0.730)μmol/mg,P<0.05](图 10)。该结果提示,给予GLP-1处理能有效减轻高糖诱导的脂质过氧化损伤。
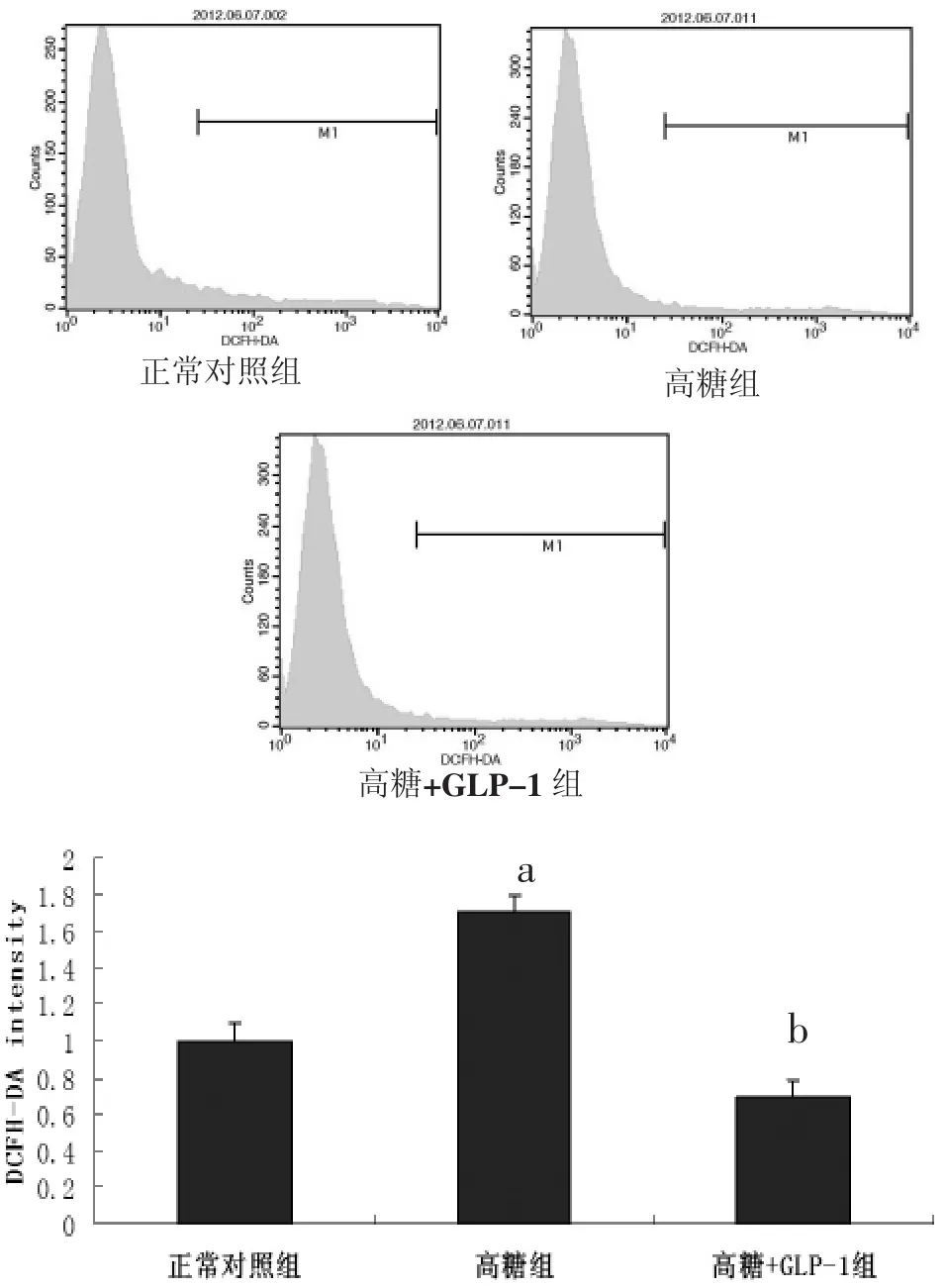
图9 高糖刺激和GLP-1预处理对乳鼠心肌细胞内活性氧生成的影响
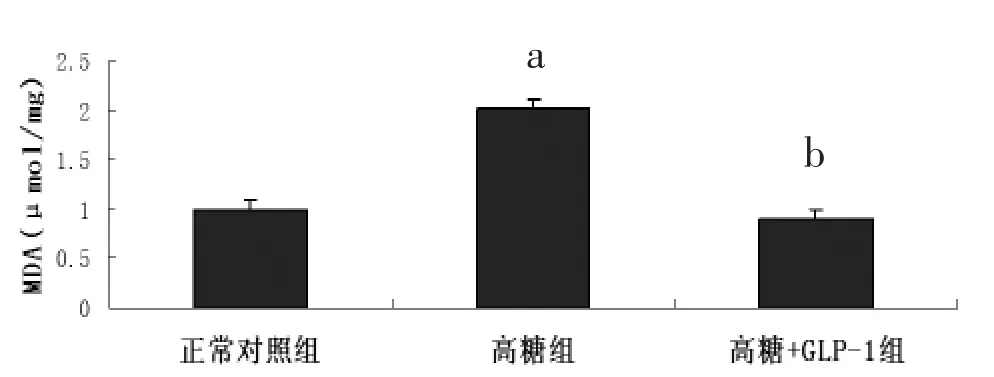
图10 高糖刺激和GLP-1预处理对乳鼠心肌细胞内MDA含量的影响
3 讨论
本研究结果显示,高糖可显著诱导心肌细胞凋亡、活性氧生成及细胞脂质过氧化,其中伴随TRX系统的改变。此外,本研究证实GLP-1具有减轻心肌细胞凋亡、清除活性氧、减轻细胞脂质过氧化,从而对高糖诱导的乳鼠心肌细胞损伤起到保护作用。GLP-1的这种保护作用伴随着TRX系统的改变,尤其是Trx活性增加以及上调的TXNIP表达受到抑制。
临床上糖尿病的心血管并发症发病率非常高。究其原因,目前普遍接受的观点之一是:长期高糖刺激所致的氧化应激损伤心肌功能[6,7]。心肌细胞中存在着氧化和抗氧化两大系统的平衡,一旦这一平衡被打破即可诱发氧化应激损伤。高糖引起氧化系统功能增强、活性氧生成增强、氧化应激产物增多,如膜脂质氧化产物丙二醛和蛋白质硝基化物三硝基酪氨酸生成升高。大量自由基可以导致线粒体功能异常,线粒体细胞色素C释放,最终启动Caspase-9介导的细胞凋亡途径[8]。此外,自由基还可引起很多功能蛋白质硝基化修饰而影响其功能。考虑到糖尿病发生发展中大量的自由基产生极其关键性作用,我们选择Trx系统这个在许多自由基损伤及凋亡参与的疾病过程如肿瘤、炎症、再灌注损伤中发挥重要作用的系统作为靶点。Trx是细胞内重要的抗氧化物质,它通过与氧自由基反应,减少氧化型蛋白生成而发挥重要的抗氧化作用,同样发挥着重要的抗凋亡作用通过结合并抑制凋亡调节激酶-1(ASK1)活性[9]。在本研究中我们观察到,高糖组心肌细胞3-NT生成量增加,提示Trx硝基化可能是其活性受抑制的原因之一。TXNIP是目前发现的唯一一种内源性的Trx结合抑制蛋白[4],在肿瘤[10]、糖尿病等疾病中发挥作用,TXNIP引起心肌细胞损伤的机制可能主要与其对Trx的结合和功能抑制有关[11]。本实验中我们考虑TXNIP表达上调抑制Trx活性是其活性降低的另一个重要原因。
胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)又称肠促胰岛素,在体内葡萄糖稳态过程中发挥重要作用。GLP-1可以通过促进胰岛素分泌[12]、减低胰岛α细胞分泌胰高血糖素、回复胰岛B细胞功能、改善胰岛素第一时相的缺陷[13]等途径来控制血糖,另外还可以减轻体重[14]。这些优势使其有望成为治疗2型糖尿病及其相关心脑血管并发症的新型药物。GLP-1是通过结合胰岛等组织细胞上存在的特异性受体GLP-1受体,并影响介导的信号传导通路而发挥其相应功能的。GLP-1受体属于与G蛋白耦联的7次跨膜胰岛素受体家族成员。随着GLP-1受体在心血管系统的发现,GLP-1对心血管作用及其机制的研究成了当前关注的焦点。但是GLP-1确切机制尚需进一步研究。
在本研究中,从测得的LDH活性和凋亡率我们可以看出,GLP-1成功逆转了高糖对培养的乳鼠心肌细胞的损伤作用。GLP-1使高糖诱导自由基生成和MDA产生均明显下降。GLP-1对Trx系统的影响首次得到观察。我们的研究证实,GLP-1预处理能使高糖损伤的Trx的活性和功能得到恢复。在本实验中,GLP-1减少高糖诱导的氧化亚硝基产生、Trx硝基化和TXNIP表达上调,充分显示了其对Trx功能的保护作用。
[1] Diamant AL,Babey SH,Hastert TA,et al.Diabetes:the growing epidemic.Policy Brief UCLA Cent Health Policy Res,2007,PB2007-9:1-12.
[2] Geiss LS, Harris MI, Cowie CC, et al.Diabetes in America National Insitutus of Health,1995.
[3] Haffner SM,Lehto S,Pyorala K,et al.Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction.N Engl J Med,1998,339:229-234.
[4] Patwari P, Higgins LJ, Chutkow WA, et al.The interaction of thioredoxin with Txnip.Evidence for formation of a mixed disulfide by disulfide exchange.J Biol Chem,2006,281:21884-21891.
[5]刘磊,焦向英,张炜芳,等.动脉粥样硬化对大鼠心肌缺血屑灌注损伤及缺血预处理保护作用的影响.山西医科大学学报,2006,37:113-120.
[6] Estall JL, Drucker DJ.Glucagon and glucagon-like peptide receptors as drug targets.Curr Pharm Des,2006,12:1731-1750.
[7]范丽芬,杨啸,姚艳玲,等.白藜芦醇对高糖诱导乳鼠心肌细胞损伤和凋亡的保护作用.中国心血管病研究,2013,11:533-539.
[8]薛晓维,姚艳玲,范丽芬,等.外源性硫氧还蛋白对高糖、高脂刺激引起的H9C2细胞损伤和凋亡的影响.中国心血管病研究,2012,10:58-62.
[9] Mircescu G.Oxidative stress:anaccomplice to uremic toxicity?J Ren Nutr,2006,16:194-198.
[10] Turturro F, Friday E, Welboume T.Hyperglycemia regulates thioredoxin-ROS activity through induction ofthioredoxin interacting protein( TRXIP) in metastatic breast cancer-derived cells MDA-MB-231.BMC Cancer,2007,7:96.
[11] Schulze PC, Yoshioka J, Takahashi T, et al.Hyperglycemia promotes oxidative stress through inhibition of thior-edoxin function bythioredoxin-interactingprotein.JBiolChem,2004,279:30369-30374.
[12] Salehi M,Aulinger B,Ronald L.Effect of Endogenous GLP-1 on Insulin Secretion in Type 2 Diabetes.Diabetes,2010,59:1330-1337.
[13] Woerle HJ, Carneiro L, Derani A, et al.The role of endogenous incretin secretion as amplifier of glucose-stimulated insulin secretion in healthy subjects and patients with type 2 diabetes.Dibetes,2012,61:2349-2358.
[14] Catanzaro R.Effects of glucagon-like peptide-1 on appetite and body weightpreclinical and clinical data.G Ital Cardiol( Rome) ,2011,12:10-16.
The mechanism of GLP-1 protection against high glucose induced neonatal cardiomyocytes injury
YANG Xiao, FAN Li-Fen, YAO Yan-Ling, et al.Department of Physiology, Shanxi Medical University, Taiyuan 030001,China
Objective This study was designed to identify whether GLP-1 can relieve the apoptosis of neonatal rat cardiomyocyte induced by glucose toxicity,the mechanisms responsible for the effect of GLP-1 were also analyzed.Methods Cardiomyocytes cultured in 48 hours were then randomly divided into 3 groups:normal glucose group,high glucose group and high glucose+GLP-1 group.For normal glucose group,cardiomyocytes were cultured in DMEM containing 5.5 mmol/L glucose and 20 mmol/L mannitol served as a normal control.For the two high glucose groups, cardiomyocytes were cultured in high glucose DMEM containing 25 mmol/L glucose.Cardiomyocytes in high glucose+GLP-1 group were pretreated with GLP-1(10 nmol/L final concentration) for and then high glucose DMEM.After additional 24 hours culture,cells and medium were collected for further assays.Results ⑴Compared with control group,high glucose group showed increased activity of LDH,apoptosis rate,p38 kinase activity, quantitation of cellular 3-Nitrotyrosine content, TXNIP expression, reactive oxygen speciesgeneration,malondialdehyde(MDA) contents in cardiomyocytes and depressed activity of TRX.⑵Compared with High glucose group,high glucose and GLP-1 group showed depressed activity of LDH,apoptosis rate,p38 kinase activity, quantitation of cellular 3-Nitrotyrosine content, TXNIP expression, reactive oxygen species generation,malondialdehyde( MDA) contents in cardiomyocytes and increased activity of TRX.Conclusion High glucose induces increased cell damage and cell apoptosis, with the generation of free radical, lipid peroxidation damage and TRX system change, the decrease of TRX activity, and down regulate of TXNIP expression.Treatment with GLP-1 relieves recovered Trx activity, decreases intracellular reactive oxygen species generation, MDA content, 3-nitrotyrosine production and TXNIP expression are decrease markedly.GLP-1 successfully relieves high glucose induced cell injury and apoptosis.
Thioredoxin; Apoptosis; GLP-1; Cardiomyocyte
国家自然科学基金(项目编号:30800399);山西省留学人员科技活动择优资助项目[项目编号:2010(97)];山西省留学归国人员科研资助项目(项目编号:2009-46);山西省高等学校创新人才支持计划
10.3969/j.issn.1672-5301.2014.05.015
Q95-33;R542.2
A
1672-5301(2014)05-0442-07
2014-01-26)
