林可霉素-大观霉素注射液在猪体内的残留消除研究
2014-09-10高艳岳静黄显会曾振灵
高艳,岳静,黄显会,曾振灵
(华南农业大学,国家兽药残留基准实验室,广东广州 510642)
林可霉素-大观霉素注射液在猪体内的残留消除研究
高艳,岳静,黄显会,曾振灵
(华南农业大学,国家兽药残留基准实验室,广东广州 510642)
【目的】对一种盐酸林可霉素-硫酸大观霉素注射液在猪组织中的残留消除进行研究,并制订该制剂在猪体内的休药期.【方法】常规饲养条件下,将30头健康猪随机分为6组,按猪体质量以15 mg/kg(即林可霉素5 mg/kg和大观霉素10 mg/kg)剂量颈部肌内注射盐酸林可霉素-硫酸大观霉素注射液,每天1次,连用5 d,于最后一次给药后8、24、72、144、240、336 h各宰杀1组猪,分别采集每头猪的肌肉、肝脏、肾脏、脂肪和注射位点5种组织,采用LC-MS/MS法和HPLC-UV法分别对林可霉素和大观霉素进行残留量测定.【结果和结论】林可霉素在猪组织中消除较快,大观霉素消除较慢,给药后第6天所有检测组织中的林可霉素和大观霉素已全部低于最高残留限量,林可霉素和大观霉素在猪体内各组织器官的残留浓度大小顺序均为:肾脏>肝脏>注射部位>肌肉>脂肪,表明肾脏是二者的靶组织.结合农业部规定的林可霉素、大观霉素在猪体内的最高残留限量和WT1.4休药期软件计算结果,建议该制剂在猪体内的休药期为8 d.
残留;猪;林可霉素;大观霉素
林可霉素为林可胺类抗生素,主要抗革兰阳性菌,大观霉素为氨基糖苷类抗生素,主要抗革兰阴性菌,两者联用可从不同环节阻碍细菌蛋白质的合成,具有较好的协同作用.林可霉素与大观霉素配伍常用于防治猪沙门菌病、支原体肺炎和敏感菌引起的母猪乳腺炎-子宫炎-无乳综合症等疾病,临床上还可用于治疗猪密螺旋体性痢疾[1].随着该复方制剂在畜牧业中的广泛使用,不可避免地引起动物组织或其产品中药物的滞留或蓄积,不仅影响了动物性产品的生产加工,而且还会以残留的方式进入人体和生态系统,严重影响消费者的身体健康[2].本文对一种盐酸林可霉素-硫酸大观霉素注射液在猪组织中的残留消除进行研究,旨在为临床上合理使用该制剂提供理论依据和指导,并为制订该制剂在猪体内的休药期和正确执行休药期的规定提供科学依据.
1 材料与方法
1.1 主要药品与试剂
15 %盐酸林可霉素-硫酸大观霉素注射液(其中含林可霉素50 mg/mL,大观霉素100 mg/mL),批号120614,由上海公谊兽药厂提供.Bond Elut C18固相萃取小柱(6 mL,500 mg),美国安捷伦公司.甲醇(色谱纯),乙腈(色谱纯),正己烷(分析纯),二氯甲烷(分析纯)等.水为符合GB/T 6682规定的二级水.
1.2 主要溶液配制
提取液:称取磷酸二氢钾1.36 g,加水溶解并稀释至1 000 mL,磷酸调节pH至4.0,加入三氯乙酸20 g溶解即得.
十二烷基磺酸钠溶液:称取十二烷基磺酸钠2.78 g,加水溶解并稀释至50 mL,静置24 h后备用.
十二烷基磺酸钠缓冲液:称取十二烷基磺酸钠2.78 g,用水溶解,加入乙酸1 mL,并用水稀释至500 mL.
1.3 仪器
美国应用生物系统公司API4000型串联质谱仪(配ESI离子源).戴安UltiMate 3000高效液相色谱仪(配四元泵、自动进样器、柱温箱等).德国Eppendorf公司高速离心机.色谱柱:Hypersil BDS C18(5 μm,4.6 mm×250 mm),大连伊利特分析仪器有限公司.超声机:HS10260D型,BENCHTOP公司.
1.4 动物试验流程
32 头健康猪,其中,2头为空白对照,其余的随机分为6组.按猪体质量以15 mg/kg(林可霉素5 mg/kg和大观霉素10 mg/kg)剂量颈部肌内注射盐酸林可霉素-硫酸大观霉素注射液,每天给药1次,连续给药5 d,分别在给药后第8、24、72、144、240、336小时的时间点各宰杀1组猪,采集肌肉、肝脏、肾脏、脂肪及注射位点等5种组织,做好标记、包装,保存于-20℃冰箱,待测.
1.5 组织样品前处理
1.5.1 含林可霉素的样品前处理准确称取匀质试样(肌肉和脂肪各1 g,肝脏和肾脏各0.5 g),置于15 mL离心管中,加入2 mL乙腈涡旋混匀,超声10 min,振荡10 min,于4℃条件下8 000 r/min离心10 min,转移上清液,残渣用1 mL乙腈重复提取1次,合并上清液,蒸馏水稀释至10 mL.用4 mL正己烷除脂3次,8 000 r/min离心10 min,弃正己烷层,水层过0.22 μm滤膜,进行LC-MS/MS测定.
1.5.2 含大观霉素的样品前处理含大观霉素的样品前处理过程包括提取、净化和衍生化.其中,提取和净化过程参照我国农业部已颁布的动物性食品中林可霉素和大观霉素残留检测气相色谱法(农业部1163号公告-2-2009);衍生化过程如下:洗脱液用氮气吹干,加100 μL水复溶,加入400 μL体积分数为6%的三氟乙酸-乙腈溶液和400 μL 5 mg/mL 2,4-二硝基苯肼-乙腈溶液,涡旋混匀,70℃衍生化1 h,取出,冰浴2 min,加入100 μL丙酮,混匀后于70℃加热10 min终止反应,冷却至室温,过0.22 μm滤膜,进行HPLC测定.
1.6 检测林可霉素和大观霉素的色谱条件
1.6.1 检测林可霉素的高效液相色谱-串联质谱条件液相色谱条件:色谱柱:Hypersil GOLD C18(5 μm,150 mm×2.1 mm);流速:0.25 mL/min;柱温:35℃;进样量:5.00 μL;流动相:A为体积分数0.1%的甲酸水溶液,B为乙腈;洗脱梯度:流动相B的比例在1.5 min内由4%线性提高到85%,然后保持4 min,再在0.5 min内降至4%,柱平衡时间6 min.
质谱条件:ESI+离子化模式;雾化气压力(GS1):344 kPa;辅助气压力(GS2):241 kPa;气帘气压力(CUR):68 kPa;喷雾电压(IS):5 500 V;离子源温度:650℃.
1.6.2 检测大观霉素的高效液相色谱条件检测器:紫外检测器,检测波长500 nm;色谱柱:Hypersil BDS C18柱(5 μm,4.6 mm×250 mm);流动相:乙腈-四氢呋喃-水(体积比30∶35∶35);流速为1 mL/min;柱温30℃;进样量:50 μL.
2 结果与分析
2.1 方法学考察
在本试验色谱条件下,林可霉素和大观霉素与组织中其他组分分离良好,色谱峰峰形较佳,林可霉素在猪肌肉、肝脏、肾脏、脂肪中的检测限为3 μg/kg,定量限为10 μg/kg,保留时间6.5 min左右,大观霉素在各组织中的检测限均为50 μg/kg,定量限为100 μg/kg,保留时间8.2 min左右.林可霉素在猪不同组织中的线性范围为1~200 ng/mL,大观霉素在猪不同组织中的线性范围为0.1~10 μg/g,相关系数均在0.99以上,线性关系良好.林可霉素在猪不同组织中的回收率为70.00%~106.20%,批内变异系数为3.57%~11.18%,批间变异系数为4.13%~10.42%.大观霉素在猪不同组织中的回收率为85.64%~99.38%,批内变异系数为3.12%~6.17%,批间变异系数为4.09%~7.19%.
2.2 组织中药物残留
将冷冻保存组织样品自然解冻,依据上述建立的方法,对试验组猪在不同屠宰时间点采集的肌肉、肝脏、肾脏、脂肪及注射位点5种组织进行测定,以测得的组织样品药物峰面积代入标准曲线计算出药物残留量.结果见表1.
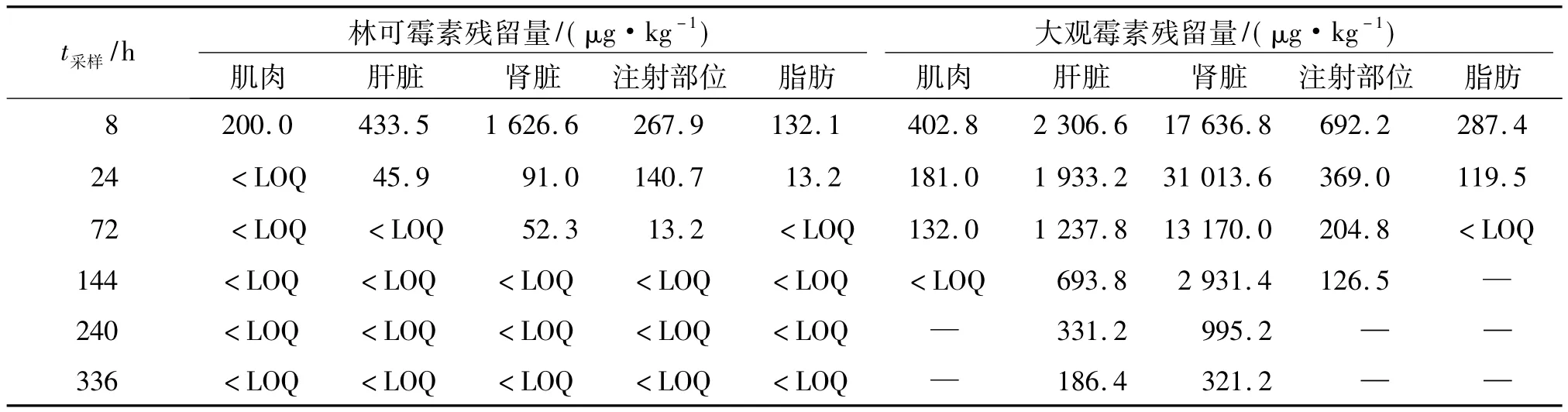
表1 猪肌注盐酸林可霉素-硫酸大观霉素注射液后组织中平均残留量1)Tab.1 Mean residues in tissues after intramuscular administration of lincomycin hydrochloride-spectinomycin sulfate injection in pigs
2.3 数据处理
我国农业部规定的林可霉素在猪组织中的最高残留限量为肌肉、脂肪100 μg/kg,肝脏500 μg/kg,肾脏1 500 μg/kg;大观霉素在猪组织中的最高残留限量为肌肉500 μg/kg,脂肪、肝脏2 000 μg/kg,肾脏5 000 μg/kg.经WT1.4休药期软件处理药物浓度-时间数据,计算得到林可霉素在各组织的休药期分别为:肌肉24 h、肝脏24 h、肾脏61.69 h、注射位点为42.26 h、脂肪24 h;大观霉素在猪各组织的休药期分别为:肌肉34.61 h、肝脏54.44 h、肾脏176.62 h、注射位点为67.58 h、脂肪8 h.根据农业部规定的最高残留限量标准及上述分析结果,可知该制剂以15 mg/kg肌注(每天1次,连用5 d)时在猪体内的休药期为8 d.
3 讨论与结论
3.1 检测方法
先前报道的关于大观霉素的检测方法有高效液相色谱-电化学检测法[3-5],高效液相色谱-安培检测法[6],高效液相色谱-柱前/柱后衍生化法,薄层色谱分析法/密度测定法[7],以及气相色谱分析法[8-10].本研究中,大观霉素的检测采用的是高效液相色谱柱前衍生化法,选取2,4-二硝基苯肼作为衍生化试剂,该试剂可与大观霉素的羰基反应生成苯腙化合物二硝基苯肼-大观霉素[11],衍生过程及衍生产物均比较稳定.反应需在酸性条件下进行,故用三氟乙酸控制反应过程中的酸性条件.已报道三氟乙酸-乙腈溶液的体积分数有3%[12]和6%[11],通过比较发现体积分数为6%的三氟乙酸-乙腈溶液作为酸性条件控制反应过程时效果较好,因此本研究中大观霉素的衍生化反应采用体积分数为6%的三氟乙酸-乙腈溶液.此外,也有报道采用反相高效液相色谱法测定林可霉素在肾脏、肝脏、肌肉和牛奶中的残留[13],离子对反相高效液相色谱法测定林可霉素在鲑鱼肌肉和皮肤中的残留[14],但是这些方法都涉及到繁琐的样品提取及净化程序.Sin等[13]报道了使用液相色谱电喷雾电离串联质谱法测定林可霉素在动物组织和牛奶中的残留,该方法准确、精确、灵敏,且样品制备过程简单.基于此,本研究依据实验室的实际状况对该方法进行了优化,用于测定林可霉素在猪组织的含量.
3.2 残留消除及休药期
林可霉素和大观霉素在猪组织中均以肾脏的残留量最高,其次是肝脏、注射位点、肌肉、脂肪,因此,肾脏是该2种药物在猪体内的靶组织.诸多对林可霉素在猪和鸡体内残留和消除规律研究表明,林可霉素在肝脏和肾脏中的残留量最高,其次为肌肉和脂肪;对大观霉素在畜禽体组织残留和消除规律研究表明,大观霉素在肾脏的残留量最高,其次为肝脏,肌肉和脂肪的残留量较低.Hornish等[16]利用原子示踪技术研究了给猪连续3 d饲喂含不同水平林可霉素的饲料,结果表明,林可霉素在肝脏及肾脏中的残留量远高于肌肉和脂肪中,但其消除速度很快.Hornish等[16]对猪和肉鸡的研究均证明,猪、鸡组织中林可霉素的残留量与饲料中林可霉素的浓度呈强线性相关.因此,在实际应用中,超量添加可导致林可霉素在动物性食品中残留超标.Bergwerff等[17]的研究也证实了肾脏中大观霉素的残留量最高.
兽药使用指南规定盐酸林可霉素硫酸大观霉素可溶性粉和预混剂在猪体内的休药期为5 d[18],但并未对复方注射液作出具体规定.根据农业部规定的林可霉素和大观霉素的最高残留限量和WT1.4休药期软件的计算结果,建议该制剂按猪体质量以15 mg/kg肌注(每天1次,连用5 d)时的休药期为8 d.
[1]AIELLO S E.The merck veterinary manual[M].8th ed.Whitehouse Station(NJ):Merck Sharp&Dohme Corp,1998:2032-2033.
[2]朱蓓蕾.动物性食品药物残留[M].上海:上海科学技术出版社,1994.
[3]SCHERMERHORN P G,CHU P,KIJAK P J.Determination of spectinomycin residues in bovine milk using liquid chromatography with electrochemical detection[J].J Agric Food Chem,1995(43):2122-2125.
[4]ELROD L J,BAUER J F,MESSNER S L.Determination of spectinomycin dihydrochloride by liquid chromatography with electrochemical detection[J].Pharm Res,1988,5 (10):664-667.
[5]DEBREMAEKER D,ADAMS E,NADAL E,et al.Analysis of spectinomycin by liquid chromatography with pulsed electrochemical detection[J].J Chromatogr A,2002,953 (1/2):123-132.
[6]PHILLIPS J G,SIMMONDS C.Determination of spectinomycin using cation-exchange chromatography with pulsed amperometric detection[J].J Chromatogr A,1994,675 (1/2):123-128.
[7]KRZEK J,KWIECIEN A,STAREK M,et al.Identification and determination of oxytetracycline,tiamulin,lincomycin,and spectinomycin in veterinary preparations by thin-layer chromatography/densitometry[J].J AOAC Int,2000,83(6):1502-1506.
[8]HOEBUS J,YUN Liming,HOOGMARTENS J.An improved gas chromatographic assay for spectinomycin hydrochloride[J].Chromatographia,1994,39(1/2):71-73.
[9]陶燕飞,于刚,陈冬梅,等.动物可食性组织中林可霉素和大观霉素残留检测方法:气相色谱法[J].中国农业科技导报,2008,10(S2):63-68.
[10]TAO Yanfei,CHEN Dongmei,YU Gang,et al.Simultaneous determination of lincomycin and spectinomycin residues in animal tissues by gas chromatography-nitrogen phosphorus detection and gas chromatography-mass spectrometry with accelerated solvent extraction[J].Food Addit Contam:Part A:Chem Anal Control Expo Risk Assess,2011,28(2):145-154.
[11]金燕华.大观霉素分析检测方法的比较与壮观链霉菌原生质体的制备[D].杭州:浙江工业大学,2008.
[12]BURTON S D,HUTCHINS J E,FREDERICKSEN T L,et al.High-performance liquid chromatographoc method for the determination of spectinomycin in turkey plasma[J].J Chromatogr B:BiomedSci Applications,1991,571 (1/2):209-216.
[13]MOATS W A.Determination of lincomycin in milk and tissues by reversed-phase liquid chromatography[J].J Agric Food Chem,1991,39(10):1812-1816.
[14]LUO Wenhong,YIN Binzhi,ANG C Y W,et al.Determination of lincomycin residues in salmon tissues by gas chromatography with nitrogen-phosphorus detection[J].J Chromatogr B:Biomed Appl,1996,687(2):405-411.
[15]SIN D W,WONG Y C,IP A C.Quantitative analysis of lincomycin in animal tissues and bovine milk by liquid chromatography electrospray ionization tandem mass spectrometry[J].J Pharm Biomed Anal,2004,34(3):651-659.
[16]HORNISH R E,GOSLINE R E,NAPPIER J M.Comparative metabolism of lincomycin in the swine,chicken,and rat[J].Drug Metab Rev,1987,18(2/3):177-214.
[17]BERGWERFF A A,SCHERPENISSE P,HAAGSMA N.HPLC determination of residues of spectinomycin in various tissue types from husbandry animals[J].Analyst,1998,123(10):2139-2144.
[18]中国兽药典委员会.中华人民共和国兽药典:兽药使用指南:化学药品卷[M].2010版.北京:中国农业出版社,2011:63-64.
【责任编辑柴焰】
Residue depletion of lincomycin hydrochloride-spectinomycin sulfate injection in pigs
GAO Yan,YUE Jing,HUANG Xianhui,ZENG Zhenling
(National Reference Laboratory Veterinary Drug Residues,South China Agricultural University,Guangzhou 510642,China)
【Objective】The residue depletion of lincomycin hydrochloride-spectinomycin sulfate injection in pigs was investigated in this study,and its withdrawal time was estimated.【Method】In routine breeding conditions,thirty healthy pigs were randomly allocated to six treatment groups.All of them were treated with lincomycin hydrochloride-spectinomycin sulfate injection at a dosage of 15 mg/kg(5 mg lincomycin and 10 mg spectinomycin)once daily for 5 consecutive days.Five medicated pigs were slaughtered at 8,24,72,144,240 and 336 h after intramuscular administration,and muscle,liver,kidney,fat and injection site tissues were sampled.The tissue concentration of lincomycin and spectinomycin was analyzed respectively by liquid chromatography-mass spsectrometry(LC-MS/MS)and high-performance liquid chromatography(HPLC).【Result and conclusion】At 6 days postmedication,all observations of spectinomycin and lincomycin were below the corresponding MRLs.In all of the detected tissues,kidney had the highest drug concentration followed by liver,injection site,muscle and fat with the lowest drug concentration,indicating that kidney was target tissue for spectinomycin and lincomycin.Based on the MRLs,which were established by the Chinese Agriculture Ministry,the withdrawal time in pigs was analyzed by WT1.4 software.The results indicated that the withdrawal time of lincomycin hydrochloridespectinomycin sulfate injection should be 8 days after intramuscular administration of 15 mg/kg in pigs.
residue;pig;lincomycin;spectinomycin
S859.79
A
1001-411X(2014)01-0106-04
高艳,岳静,黄显会,等.林可霉素-大观霉素注射液在猪体内的残留消除研究[J].华南农业大学学报,2014,35(1):106-109.
2013-02-21优先出版时间:2013-11-07
优先出版网址:http:∥www.cnki.net/kcms/detail/44.1110.S.20131107.1500.006.html
高艳(1987—),女,硕士研究生,E-mail:501876793@qq.com;通信作者:曾振灵(1963—),男,教授,博士,E-mail:zlzeng@scau.edu.cn
公益性行业(农业)科研专项经费(201303038-5);广东省农业科技成果转化资金项目(2012NL018)
