大鼠DAI特殊染色观察及NF-κB的表达*
2014-09-06陈仁辉范兆慧
陈仁辉,范兆慧,高 辉
(1.福建警察学院刑事科学技术系,福建 福州 350007;2.福州市公安局仓山分局刑侦大队,福建 福州 350007;3.吉首大学医学院药理学教研室,湖南 吉首 416000)
大鼠DAI特殊染色观察及NF-κB的表达*
陈仁辉1,范兆慧2,高 辉3
(1.福建警察学院刑事科学技术系,福建 福州 350007;2.福州市公安局仓山分局刑侦大队,福建 福州 350007;3.吉首大学医学院药理学教研室,湖南 吉首 416000)
为了分析大鼠弥漫性轴索损伤(DAI)后病理学变化及核因子-κB(NF-κB)的表达,探讨了NF-κB在弥漫性轴索损伤中的作用,构建了大鼠DAI动物模型.运用Glees-Marsland染色法和Weil氏染色法观察伤后不同时间段的病理学改变,并运用免疫组化SABC法观察NF-κB的表达.实验结果表明,大鼠弥漫性轴索损伤后1 h即可观察到部分轴索肿胀、断裂,髓鞘水肿、分层等现象,24 h可见典型轴索收缩球形成,髓鞘崩解呈筛网状改变,72 h轴索断裂数量、范围及髓鞘筛网状改变达到高峰;伤后1 h,脑组织内可见NF-κB阳性细胞,伤后3 h阳性细胞数增多,伤后24 h达到高峰,持续到72 h,伤后7 d,仍可见阳性细胞表达,但数量减少.对照组细胞核未见阳性表达.大鼠弥漫性轴索损伤后NF-κB表达增加,可能与轴索继发性损伤有关.
弥漫性轴索损伤;特殊染色法;NF-κB;免疫组织化学
弥漫性轴索损伤(Diffuse Axonal Injury,DAI)是颅脑损伤的一种重要形式.其最突出的临床表现是在没有明确局灶损伤的情况下出现快速的进行性加重意识障碍.DAI由于缺乏特异性的神经定位体征以及影象学改变,其最终诊断需要通过组织病理学.大量的研究表明,DAI的发生是由机械性的原发损伤引起并与继发性的蛋白水解通路激活共同参与所致,但是最近的研究认为炎症反应可能也参与了DAI的发生发展[1].
NF-κB是一种具有多向性转录激活功能的调节因子,其主要作用是参与多种与免疫、炎症、细胞凋亡等生理和病理过程相关基因的表达调控,通路是炎症反应通路中重要的信号转导通路[2].笔者构建了大鼠DAI动物模型,运用Glees-Marsland染色法、Weil氏染色法观察伤后不同时间段轴索的病理学改变,并对相应时间段NF-κB的表达变化进行观察,探讨NF-κB与DAI经过时间及损伤程度的关系.
1 材料与方法
1.1实验材料
1.1.1 动物分组 健康成年雄性SD大鼠45只(福建医科大学实验动物中心提供),其质量为280~300 g,随机分为8个实验组(分别在打击后30 min,1 h,3 h,6 h,12 h,24 h,72 h,7 d处死)及1个对照组,共9组.每组5只大鼠.
1.1.2 主要试剂 Weil苏木精、4%铁明钒、硝酸银、氯化金(上海化学试剂总厂)、硫代硫酸钠、饱和氨水,兔抗大鼠NF-κB p65多克隆抗体、DAB显色试剂盒及SABC试剂盒(武汉博士德公司).
1.2实验方法
1.2.1 DAI动物模型制作 实验组参照文献[3]中报道的方法建立DAI动物模型,用1%戊巴比妥钠作腹腔注射(每千克大鼠注射35 mg),麻醉成功后,大鼠头部中线切开暴露颅骨,将直径10 mm、厚3 mm的打击垫片用高分子聚脂固定于颅顶的冠状缝与人字缝之间的中央部,然后将大鼠俯卧固定已知厚度及弹性系数的海绵床上,待大鼠恢复意识,有肢体活动时,移至有机玻璃管下端,垫片正对管中央.质量为450 g的铁棒从2 m高度自管内自由坠落至打击垫片上,立即移开海绵床以免二次损伤.在设定的时间点处死大鼠.1.2.2 组织及切片处理 打开颅骨后迅速用4%多聚甲醛液预固定,取出大鼠全脑于多聚甲醛液后固定12 h,沿大脑正中裂矢状切开大脑、小脑、脑干,于正中切面左右外侧3 mm处切取左右大脑皮质、胼胝体、丘脑以及脑干组织各一块,分别做常规石蜡包埋.切片厚度为5 μm,分别作HE染色、Glees-Marsland染色、Weil氏染色[4]及NF-κB免疫组织化学染色.
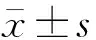
2 实验结果
2.1Glees-Marsland染色
打击后1 h即可观察到部分神经纤维不规则增粗、肿胀、呈波浪样改变,6 h神经纤维明显增粗、肿胀并呈串珠状、螺旋状改变,断端收缩球形成,12 h收缩球较为明显,24 h可见典型轴索收缩球,72 h轴索断裂数量及范围达到高峰(图1).对照组神经纤维排列整齐有序.
2.2Weil氏染色
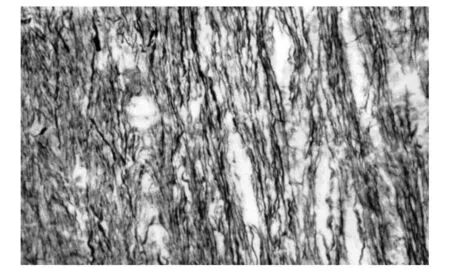
图1 脑损伤后脑干轴索肿胀、断裂改变(G-M×400)
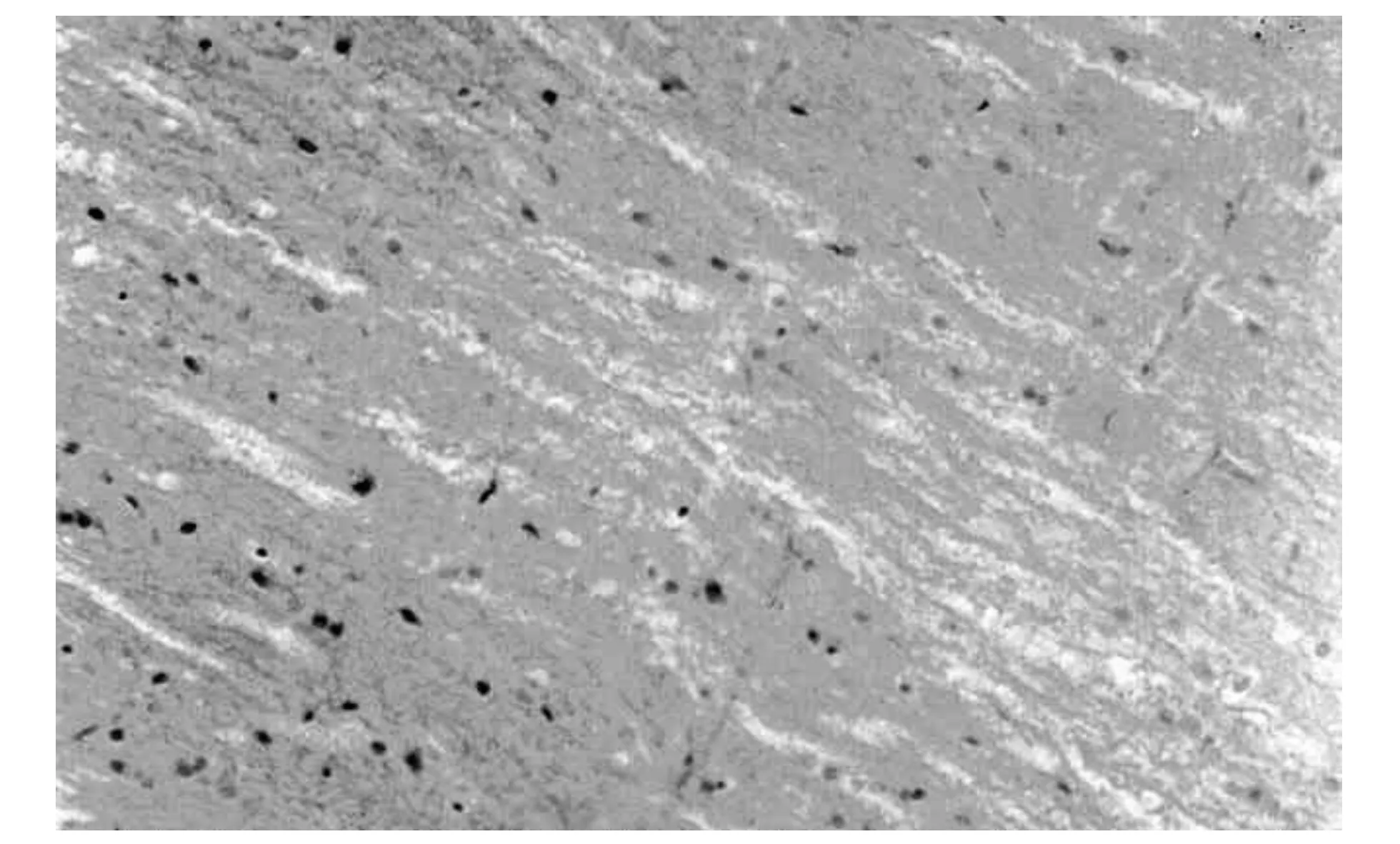
图2 脑损伤后脑干神经纤维脱髓鞘改变(Weil×400)
打击后1 h神经髓鞘水肿、分层,6 h可见髓鞘崩解,聚集成团,12~24 h髓鞘病变范围扩大,组织结构排列紊乱,部分呈空泡状、筛网状改变,72 h髓鞘筛网状改变达高峰(图2).对照组髓鞘无水肿、分层改变.
2.3NF-κB免疫组织化学染色
图3 脑损伤后1 h阳性表达(SABC×400)
DAI后1 h,在脑组织内可见NF-κB少量细胞核表达(图3),呈棕黄色颗粒,着色较浅;伤后3 h染色细胞核增多,着色加深(图4),呈散分布,与对照组比较有统计学意义(p<0.05),随着损伤时间的延长,阳性细胞数增加,染色加深;伤后24 h,表达达到高峰(图5),持续到72 h,伤后7 d,仍可见阳性细胞表达,但数量减少,与对照组比较有统计学意义(p<0.05).最显著的表达区域在大脑皮层、脑干,其他部位的表达略有差异,但表达趋势一致.对照组细胞核未见阳性表达.NF-κB表达情况见表1(例数n=5).
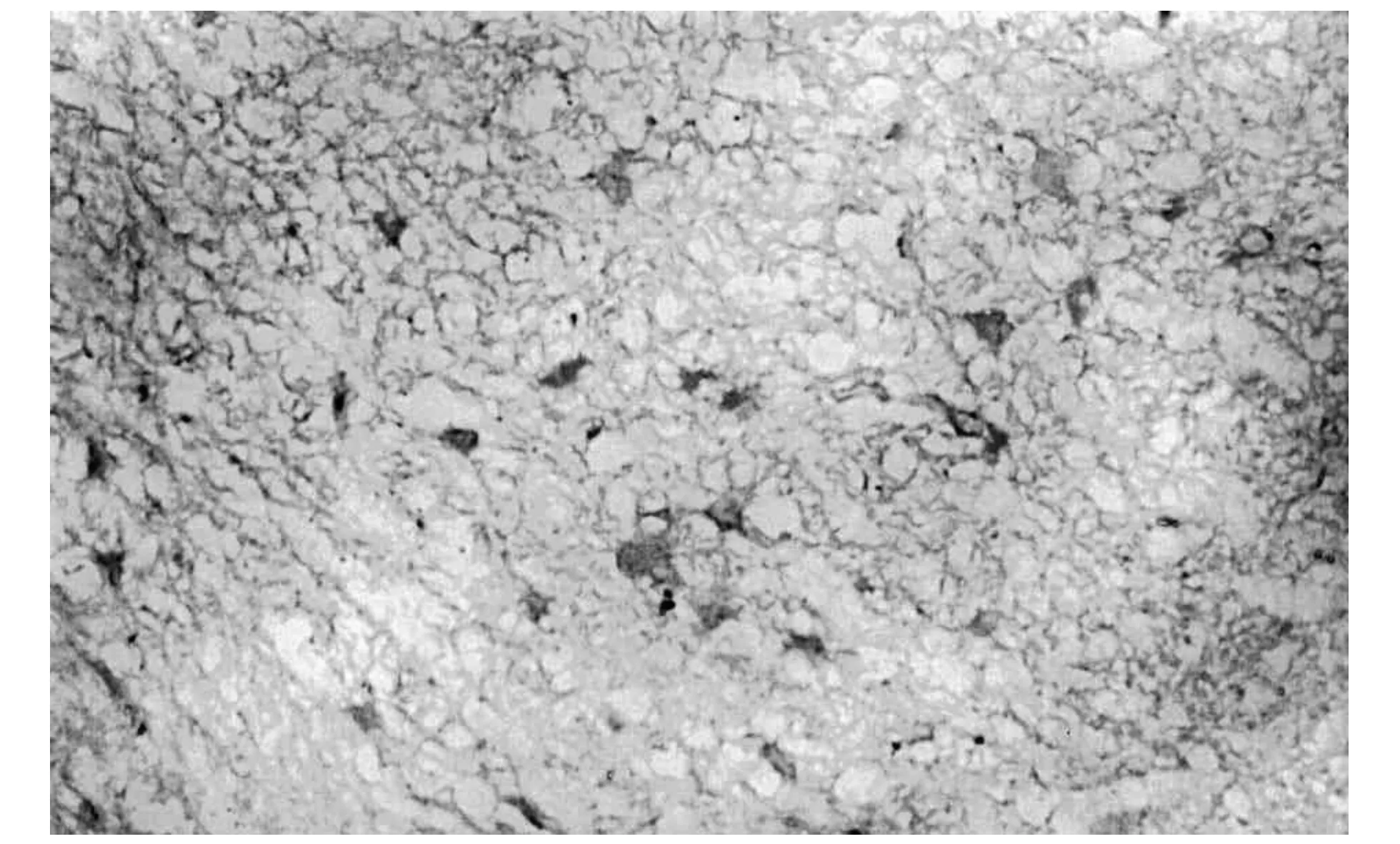
图4 脑损伤后3 h阳性表达(SABC×400)
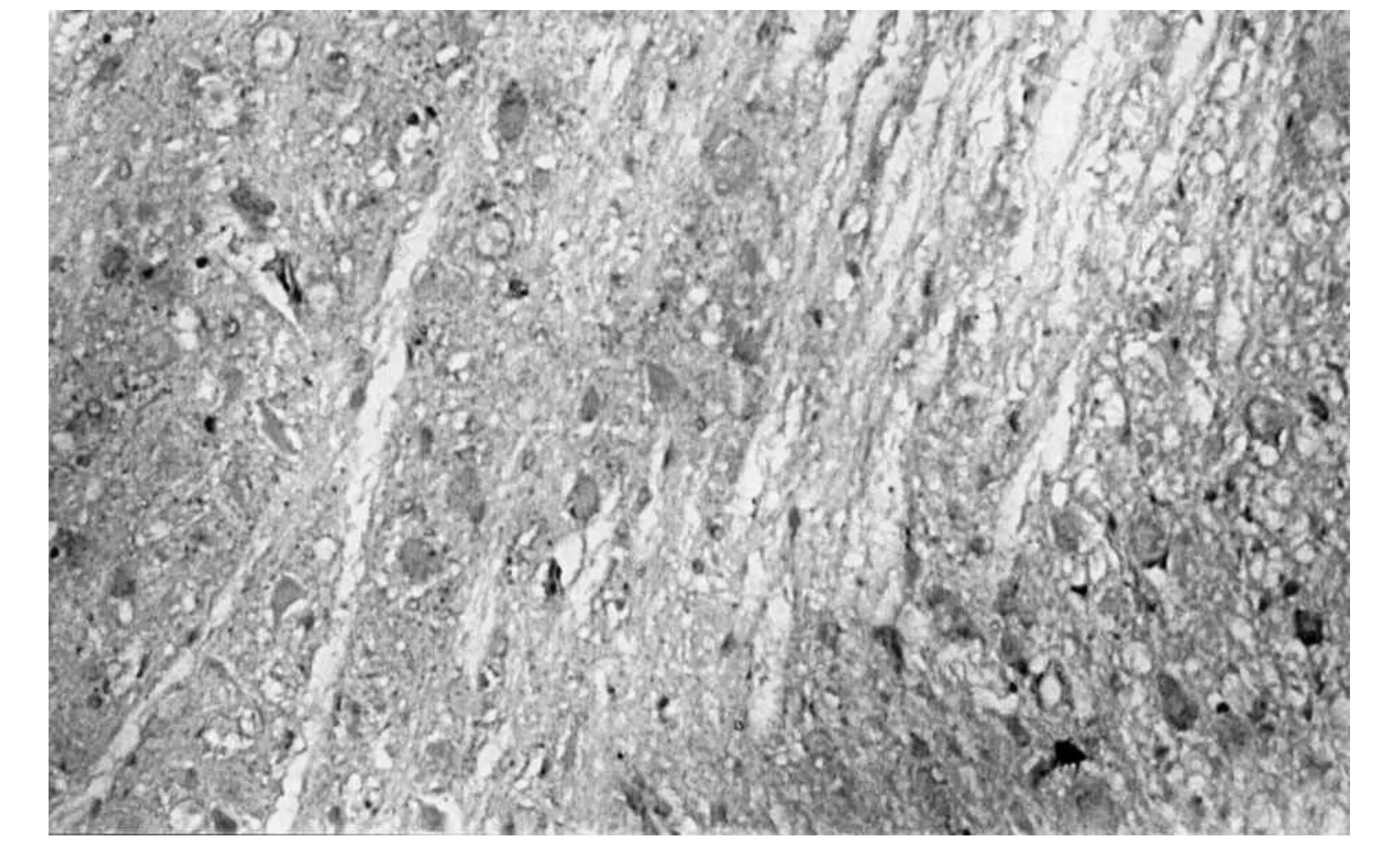
图5 脑损伤后24 h阳性表达(SABC×400)
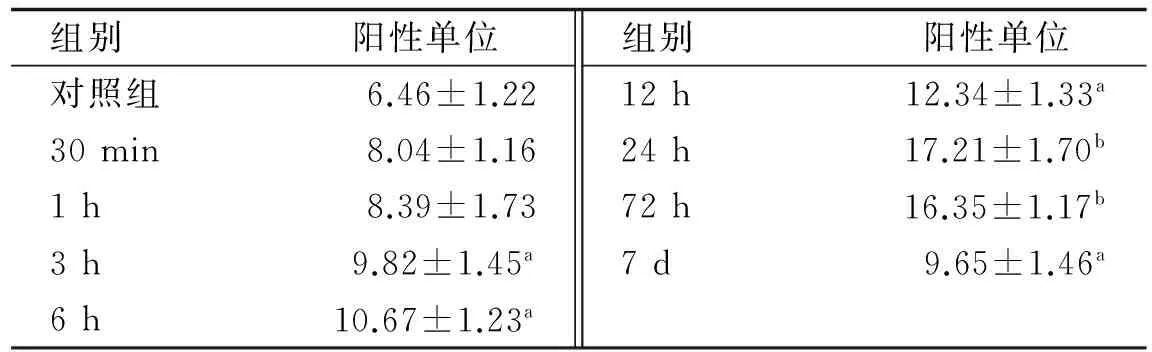
表1 对照组及DAI组脑组织中NF-κB阳性单位值
注 肩标a表示P<0.05,肩标b表示P<0.01.
3 讨论
弥漫性轴索损伤一般发生在头部遭受剪切力或加速性外力作用后,脑内不同密度的组织产生不同的位移,造成这些界面处轴索的肿胀断裂,其主要病理改变集中于神经轴索聚集区,如灰白质交界处、胼胝体、脑干、小脑及内囊基底节区,轴缩球的形成是确认弥漫性轴索损伤的主要依据.轴索的膨胀和断裂可由外力直接作用引起,但绝大多数情况下则是伤后病理生理变化的结果,轴缩球的形成是一个继发的病生过程,病理学称之为非中断性轴索损伤[6].非中断性轴索损伤后至延迟性轴索断裂及轴缩球的形成,这期间是一个复杂的病理生理学过程.Glees-Marsland染色、Weil氏染色作为神经组织特殊染色方法,可以很好地显示神经纤维轴索、髓鞘的病理学改变.笔者研究发现DAI后早期仅可见部分神经纤维不规则增粗、肿胀,呈波浪样改变,随着损伤时间的延长,轴索肿胀程度加重,出现了断裂、轴索球的形成,并于伤后72 h轴索断裂数量及范围达到高峰.在损伤早期仅见少量髓鞘水肿、分层改变,随着损伤时间的延长,髓鞘出现崩解,髓鞘病变范围扩大,呈空泡状、筛网状改变,于伤后72 h达高峰.上述病理学改变,主要位于脑干、胼胝体等脑中线部位,脑白质部位多见,这与DAI损伤的生物力学机制有关,也与神经纤维的分布有关.特殊染色结果证实轴索断裂不是单纯外力即可作用所致,“继发性脑损伤”因素在DAI的发展中起着重要的作用.
NF-κB在神经系统中广泛存在,并且在脑组织内的活性相对高于其他组织.在正常情况下,它以非活性形式存在胞浆中,当细胞受到外界刺激时,NF-κB被激活,并由胞质移位至胞核[7].文中研究结果表明:DAI后1 h,在脑组织内可见NF-κB在少量细胞核表达,随着时间的延长,阳性细胞数增加,染色加深,伤后24 h,表达达到峰值,持续到72 h,伤后7 d,仍可见阳性细胞表达,但数量减少.NF-κB的表达规律和神经纤维损伤程度变化规律具有某种程度的一致性.
最新的研究表明,炎症反应参与了DAI的发生发展,轴索损伤时髓鞘崩解产物激活炎性细胞,如小胶质细胞、巨噬细胞,上调炎症因子如肿瘤坏死因子(TNF)-α、(IL)-1等,参与DAI的发展[1].NF-κB作为真核细胞转录因子,参与调控基因的转录功能,是许多生理活动的分子基础,其中对编码炎性分子基因的转录是NF-κB最主要的功能.钱伟等[8]研究发现,颅脑损伤后NF-κB存在高度活化,并长时间维持,通过上调炎症因子TNF-α的表达直接或间接导致颅脑的损伤.文中研究结果表明,DAI后随着损伤时间的延长,神经纤维损伤程度逐渐加重,轴索髓鞘崩解产物增多,NF-κB表达也逐渐增强,提示NF-κB的激活程度和DAI损伤程度有关联,可能通过启动炎症反应通路参与DAI的继发性损伤.
目前DAI尚无特异性的治疗手段,这与其发病机制的复杂性有关.炎症反应作为新的DAI发病机制,积极控制炎症反应也应是治疗DAI的策略之一.NF-κB在DAI中的表达激活提示,它可能通过启动的炎症反应通路参与DAI的发生发展,阻断NF-κB活化途径,抑制NF-κB活性,减少NF-κB的活化因素,是可能会成为减轻DAI的有效途径之一.
[1] YANG X F,WANG H,WEN L,et al.From Myelin Debris to Inflammatory Responses:A Vicious Circle in Diffuse Axonal Injury[J].Med. Hypotheses,2011,77:60-62.
[2] ALTAVILLA D,DEODATO B,CAMPO G M,et al.IRFI 042,a Novel Dual Vitamin E-Like Antioxidant,Inhibits a ctivation of Nuclear Factor-Kappa B and Reduces the Inflammatory Response in Myocardial Ischaemia-Reperfusion Injury[J].Cardiovasc Res.,2000,47(3):515-528.
[3] FODA M A,MARMAROU A.A New Model of Diffuse Brain Injury in Rats.Part II:Morphological Characterization[J].Neurosurg,1994,80(2):301-313.
[4] C.F.A卡林,著.组织病理学与组织化学技术手册[M].孔庆雷,译.第1版.北京:科学出版社,1982:445-446.
[5] 申 洪,陆药丹.免疫组织化学染色的定量方法研究[J].生物医学工程学杂志,1993,10(4):281-284.
[6] POVLISHOCK J T,CHRISTMAN C W.The Pathobiology of Traumatically Induced Axonal Injury in Animals and Humans:A Review of Current Thoughts[J].J. Neurotrauma,1995,12(3):555-564.
[7] SEEGERS H,GRILLON E,TRIOULLIER Y,et al.Nuclear Factor-Kappa B Activation in Permanent Intraluminal Focal Cerebral Ischemia in the Rats[J].Neurosci. Lett.,2000,288(3):241-245.
[8] 钱 伟,钱志远,沈合春,等.大鼠颅脑损伤后脑NF-κB的活性和NF-κB mRNA表达的变化及意义[J].中华医学杂志,2013(7):2 024-2 027.
(责任编辑 陈炳权)
SpecialStainingPathologicChangesandtheExpressionofNF-κBAfterDiffuseAxonalInjuryinRats
CHEN Renhui1,FAN Zhaohui2,GAO Hui3
(1.Department of Criminal Sciences and Technology,Fujian Police Institute,Fuzhou 350007,China;2.Criminal Investigation Detachment of Public Security Bureau Cangshan Branch,Fuzhou 350007,China;3.Department of Pharmacology,Medical College of Jishou University,Jishou 416000,Hunan China)
To observe the pathologic changes and the expression of nuclear factor-kappa B(NF-κB)after diffuse axonal injury(DAI) in rats,its mechanism is firstly explored.The rat DAI model was established.Immunohistochemical SABC method was used to observe the expression of NF-κB,combining Glees-Marsland and Weil staining to observe the pathologic changes in different stage of DAI.Swollen and ruptured axon were found in brain tissue 1 h after DAI,and myelin sheath showed edema,delamination,marked axonal retraction ball and screen shape changes were detected after 24 h,and those morphological changes reached the peak after 72 h.The expression of NF-κB could be detected 1h after injury,the positive cells increased after 3 h,peaked after 24 h,and kept this tendency for 72 h.The positive cells decreased after 7 d.The control group showed negative staining.The findings showed that the expression of NF-κB increased in rat DAI model.The NF-κB may play an important role in secondary axonal injury.
diffuse axonal injury;special staining;nuclear factor-kappa B(NF-κB);immunohistochemistry
1007-2985(2014)05-0063-04
2014-03-20
福建省教育厅科技项目(JA13339);湖南省科技厅科技计划资助项目(2013SK3179)
陈仁辉(1979—),男,安徽宁国人,福建警察学院刑事科学技术系讲师,博士生,主要从事闭合性颅脑损伤的分子病理学研究.
R89
B
10.3969/j.issn.1007-2985.2014.05.015
