QuEChERS/高效液相色谱法同时测定水产品中16种多环芳烃
2014-09-01万译文黄向荣陈湘艺曾春芳
万译文,黄向荣,陈湘艺,曾春芳
(1.农业部渔业产品质量监督检验测试中心(长沙),中国 长沙 410153;2.湖南省水产科学研究所,中国 长沙 410153)
QuEChERS/高效液相色谱法同时测定水产品中16种多环芳烃
万译文1,黄向荣2*,陈湘艺1,曾春芳2
(1.农业部渔业产品质量监督检验测试中心(长沙),中国 长沙 410153;2.湖南省水产科学研究所,中国 长沙 410153)
建立了水产品中有16种多环芳烃药物残留量同时测定的高效液相色谱分析方法.样品经乙腈提取,C18与中性氧化铝净化后,采用荧光-紫外检测器串联的方法对多环芳烃进行检测.实验结果表明,16种多环芳烃分离效果好,检出限(LOD)为0.5~5.0μg/kg,相对标准偏差为1.7%~9.2% (n=6),加标回收率达到71.8%~98.8%.该方法具有比较高的重现性和选择性,对于水产品中多环芳烃的残留测定具有很好的应用价值.
QuEChERS;高效液相色谱法;多环芳烃;水产品
多环芳烃(PAHs)类化合物是一种惰性较强的碳氢化合物.PAHs具有疏水性、半挥发性及难降解等特点,容易在生物体内富集[1-3].PAHs能够抑制植物的生长,对人类有明显的“三致”效应(致癌、致畸、致突变),已成为世界范围的研究热点[4-5].欧盟食品科学委员会与美国环保局(USEPA)在2002年将16种PAHs列为优先控制污染物;我国环保总局将其中的7种PAHs列入优先控制污染物的黑名单中.
由于我国工业化及城市化的快速发展,燃煤、燃油被广泛地应用,产生的污染物不断排入水域中,对渔业养殖带来很大的危害,并影响到我国人民的身体健康和水产品的出口.随着PAHs的环境污染越来越严重,环境中PAHs的相关研究也越来越多,目前PAHs的检测方法有液相色谱法、气相色谱法、气相色谱-质谱法联用等[6-8],但大部分是基于环境方面的研究,例如水质、土壤以及沉积物等[9-11].对于水产品的检测技术目前研究得较少,钟惠英等[12]利用气相色谱-质谱法测定水产品中16种多环芳烃;方杰等[13]利用气相色谱-离子阱质谱法测定贝类中的16种多环芳烃;孙秀梅等[14]采用高效液相色谱-荧光法测定水产品中15种多环芳烃.
由于水产品成分比较复杂,基质中含有大量的脂肪、蛋白质、碳水化合物以及色素等杂质,而多环芳烃作为亲脂性化合物分布在样品的脂质部分,同大分子物质紧密结合,因此,目前水产品中PAHs的提取过程中均采用皂化来去除脂类物质的干扰[12-14].而皂化过程不仅耗时长且需要大量的化学试剂,前处理比较麻烦.QuEChERS方法是一种快速、简单、经济、高效、抗干扰、安全的样品前处理方法,其原理是利用吸附剂填料与基质中的杂质相互作用,吸附杂质达到除杂净化的目的[15-17].本文通过采用QuEChERS技术进行样品处理,通过对试验条件的筛选和试验方法的改进,利用高效液相色谱-荧光紫外联用来同时测定水产品中的16种多环芳烃,缩短了前处理时间,灵敏度高,能实现对多环芳烃的快速检测,满足水产品质检以及相关基础研究的要求.
1 实验部分
1.1 仪器与试剂
Waters Alliance 2695高效液相色谱仪,配备2489紫外可见光检测器和2475多波长荧光检测器;Waters LC-PAH柱(4.6 mm×250 mm,5 μm);高速冷冻离心机(日本日立公司);氮气吹扫仪(美国Organomation公司);固相萃取装置(美国Agilent公司);超声波清洗器(昆山超声波仪器厂);精密电子天平(梅特勒—托利多称重设备系统有限公司);微型漩涡混合仪(上海沪西分析仪器厂).
16种多环芳烃混合标液:萘、苊、菲、蒽、芴、芘、崫、荧蒽、苊烯、苯并[α]蒽、苯并[b]荧蒽、苯并[k]荧蒽、苯并[α]芘、二苯并[α,h]蒽、苯并[g,h,i]苯和茚并[1,2,3-cd]芘,浓度为200 mg/L(美国Accustandard公司);乙腈(色谱纯,德国Merck公司);C18吸附剂(0.063~0.212 mm,即70~230目,上海安谱科学仪器有限公司);无水硫酸镁(分析纯,Adamas试剂公司);无水乙酸钠(分析纯,Alfa Aesar天津化学有限公司).
1.2 样品前处理
称取2 g样品至于50 mL离心管中(精确至0.01 g),加入5 mL超纯水及15 mL乙腈,在漩涡混合仪上充分混合2 min,接着加入6 g无水硫酸镁和1.5 g无水乙酸钠,放入超声波清洗器中超声提取10 min后,放入离心机8 000 r/min离心10 min,待分层后移取上清液8 mL至新的50 mL离心管中,待净化.将0.5 g无水硫酸镁、0.5 g C18吸附剂及0.2 g 中性氧化铝加入装有8 mL提取液的离心管中,混匀1 min,6 000 r/min离心5 min,准确移取5 mL上清液至10 mL离心管中,于45 ℃氮气吹干后,加入1.0 mL乙腈溶解,过0.22 μm滤膜后,待测.
1.3 色谱条件
色谱柱为Waters LC-PAH柱(4.6 mm×250 mm,5 μm);柱温30 ℃;进样量为20 μL;流动相A为乙腈,B为超纯水;洗脱梯度为0~11 min,60%A;11~20 min,60%A~90%A;20~32 min,90%A;流速为1.2 mL/min.
2475多波长荧光检测器,采用程序定时控制荧光检测波长变化,测定除苊烯以外的15种多环芳烃,见表1. 2489紫外可见光检测器,检测波长229 nm(测苊烯),与荧光检测器串联.

表1 PAHs的荧光检测程序
2 结果与讨论
2.1 色谱条件的优化
欧盟规定将16种多环芳烃采用Waters 2695荧光检测器检测,但是由于苊烯的荧光响应值低,而在紫外检测器中响应值较高,因此本文采用荧光和紫外串联的方法对16种多环芳烃进行检测,荧光检测器根据各种化合物保留时间、最大吸收和最大发射波长来设置相应的检测条件,紫外检测器在229 nm处测苊烯.
由于普通的C18柱对PAHs中的菲和蒽、苯并[b]荧蒽和苯并[k]荧蒽的分离效果不好,本文采用Waters的PAH专用柱,同时对流动相、柱温以及流速等因素进行了优化,因此在本文所选色谱条件(1.3)下16种多环芳烃均能得到较好的分离,色谱图见图1.


A.荧光检测色谱图;B.紫外检测色谱图1.萘; 2.苊烯; 3.苊; 4.芴; 5.菲; 6.蒽; 7.荧蒽; 8.芘; 9.苯并[α]蒽; 10.崫; 11.苯并[b]荧蒽;12.苯并[k]荧蒽; 13.苯并[α]芘; 14.二苯并[α,h]蒽; 15.苯并[g,h,i]苝; 16.茚并[1,2,3-cd]芘
2.2 提取溶剂的选择
水产品常用的提取溶剂有乙腈、甲醇和乙酸乙酯等,而采用QuEChERS方法是采用单一溶剂乙腈提取分离.本文比较了乙腈、甲醇和乙酸乙酯在提取PAHs上的不同,发现乙腈和甲醇均能较好的沉淀蛋白质,乙腈与蛋白质形成致密沉淀,甲醇与蛋白质形成絮状沉淀,通过离心后,乙腈与蛋白质所形成的致密沉淀更容易去除,蛋白质含量低有利于下一步的QuEChERS净化;而采用乙酸乙酯提取时,对鱼肉中的杂质提取液较多,在氮吹浓缩过程中会残留很多杂质吹不干,影响目标物的回收率.因此本文选择乙腈作为PAHs的提取溶剂.
在提取过程中,比较了直接加乙腈和先加水再加乙腈2种不同的提取方式,结果表明,先加水再加乙腈提取能获得更高的回收率,原因可能是先加水将样品混匀后,加大样品的分散程度,使样品与提取溶剂能更充分的接触,而且乙腈能与水互溶,可加大乙腈的渗透性,使提取效果最佳,PAHs各种目标物的回收率更高.
2.3 提取方式的选择
在前处理过程中常用的提取方式有索氏提取、振荡提取、超声波提取及超临界流体萃取法等.采用传统的索氏法提取水产品中的PAHs,回收率满足要求,但是提取时间过长,消耗溶剂较多,实验效率不高[18].美国环保局(EPA)推荐采用超声波提取食品中的多环芳烃,具有简单快捷,回收率高等特点[19].传统的QuEChERS方法采用将样品匀浆后加入提取试剂充分的振荡进行提取,本文采用将提取试剂加入样品中混匀后,结合超声波提取,使样品与提取试剂充分的接触,保证提取完全.实验表明,采取振荡与超声混合提取后,目标物的回收率均在85%以上,且与传统的索氏提取耗时10~24 h相比,本实验的提取方式只需要12 min即可完成.
2.4 净化方式的选择
QuEChERS方法采用的是分散型固相萃取进行净化,常用的吸附剂有PSA(乙二胺-N-丙基硅烷)、C18、中性氧化铝、弗罗里硅土及石墨化炭黑(GCB).GCB常用于去除提取液中的类甾体、叶绿素等色素;PSA含有伯胺和仲胺基团,可通过离子交换去除食品中的色素、糖类和有机酸等[20];C18和中性氧化铝也是一种常用的吸附剂,常用于非极性至中等极性物质的吸附,具有良好的除脂能力.吸附剂的选择和用量根据不同的样品基质来决定,对于水产品来说,由于鱼肉中含有丰富的蛋白质及脂肪,本文选取PSA、C18及中性氧化铝作为吸附剂进行优化.将同一浓度的PAHs混合标准溶液中分别加入0.2 g以上3种吸附剂充分混匀后,过0.22 μm滤膜进入液相分析,发现经C18吸附后目标物的回收率要高于PSA,且C18成本低于PSA,可对吸附剂的组合进一步优化.考虑到样品提取液中残留着水分和脂肪,本文考察了0.2~1.0 g无水硫酸镁、0.5~1.0 g C18以及0.2~1.0 g中性氧化铝不同比例组合的净化效果.结果表明:当采用0.5 g无水硫酸镁、0.5 g C18吸附剂及0.2 g 中性氧化铝作为分散型固相萃取吸附剂时,溶液清亮,基质干扰小,目标物回收率高.
2.5 线性范围与灵敏度
配置0.005、0.01、0.02、0.05、0.1、0.5 mg/L的系列标准工作溶液,以待测物的浓度X(mg/L) 为横坐标,待测物的峰面积Y为纵坐标制作标准曲线,得到PAHs的回归方程和相关系数(见表2).由表2可知,PAHs在0.005~0.5 mg/L范围内其标准曲线的线性关系良好,可满足定量分析的要求.在方法规定的取样质量条件下,在阴性样品中添加PAHs混合标准溶液,以3倍信噪比(S/N=3)得到检出限.

表2 16种PAHs的线性范围和灵敏度
2.6 回收率与精密度
为了确保分析数据的准确性、精密性和可比性,在空白样品中添加10、50、100 mg/g 3个水平的添加实验,每个添加水平进行3次实验,每次平行测定6次,按1.2节所述条件进行加标回收率实验,所得结果为回收率为71.8%~98.8%,相对标准偏差为1.7%~9.2%.方法学考察详细结果见表3.

表3 PAHs在空白样品中的添加回收率和相对标准偏差(RSDs,n=6)
2.7 实际样品测定
运用本文建立的方法对市场中的对虾样品进行了分析检测.结果表明:市场上有部分样品存在PAHs污染,其中低环与中环的PAHs检出率较高,其中芘含量最高,达到22.4 ng/g(见表4).本方法适用于实际样品的测定,可为PAHs在水产品中的消除规律及毒理评价提供灵敏、准确的分析手段.
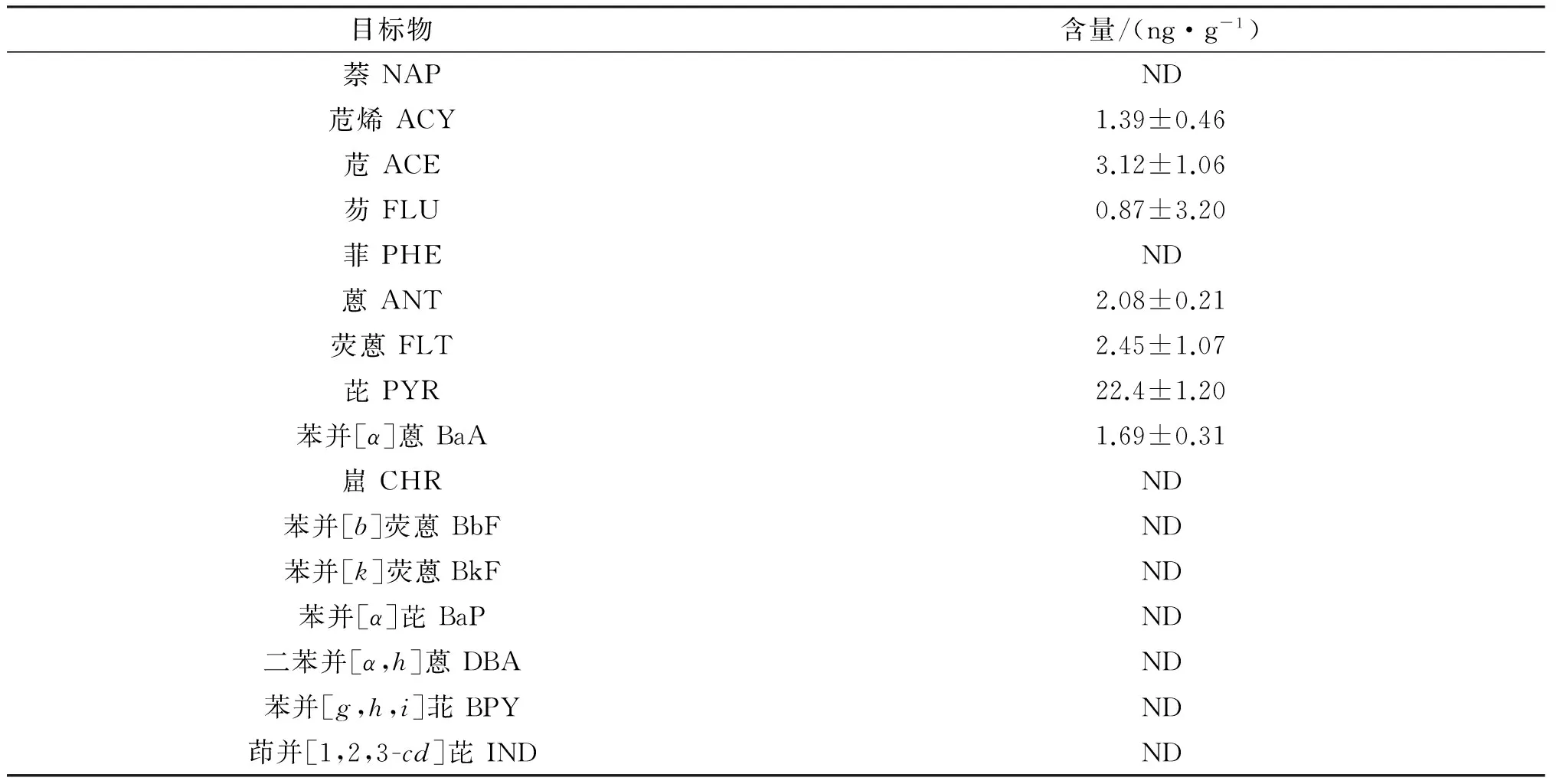
表4 水产品中PAHs的含量(n=3)
ND: No detected.
3 结论
本文建立了QuEChERS/高效液相色谱法测定水产品中PAHs含量的检测方法.通过对前处理条件及色谱条件的优化,PAHs在0.005~0.5 mg/L范围内其标准曲线的线性关系良好,检出限LOD在0.5~5.0 mg/g之间;在不同的添加水平下,PAHs各组分的平均回收率在为71.8%~98.8%,相对标准偏差为1.7%~9.2%,符合国内外有关标准和法规的要求.该方法并可为PAHs在水产品中的消除规律及毒理评价提供灵敏、准确的分析手段,对水产食品的安全工作提供了有力的保障.
[1] BERTOLOTTO R M, GHIONI F, FRIGNANI M,etal. Polycyclic aromatic hydrocarbons in surficial coastal sediments of the Ligurian sea[J]. Baseline/Mar Poll Bull, 2003,46(7):903-917.
[2] RANU T, RAKESH K, MOHAN K R M,etal. Distribution, sources and characterization of polycyclic aromatic hydrocarbons in the sediment of the River Gomti, Lucknow, India[J]. Bull Environ Contam Toxicol, 2009,83(3):449-454.
[3] 卢腾腾,林 钦,柯常亮,等. 珠江口彾仃洋水域沉积物种多环芳烃及其生态风险评价[J]. 中国水产科学, 2012,19(2):336-347.
[4] 陈世军,祝贤凌,冯秀珍,等. 多环芳烃对植物的影响[J]. 生物学通报, 2010,45(2):9-11.
[5] DONG R A, LIN Y T. Characterization and distribution of polycyclic aromatic hydrocarbon contaminations in surface sediments and water from Gao-ping River, Taiwan[J]. Water Res, 2004,38(7):1733-1744.
[6] 林直宏,袁彦华,候镜德,等. HPLC测定油漆中的16种多环芳烃[J]. 中国测试, 2012,38(4):44-46.
[7] SARRAZIN L, DIANA C, SCHEMBRI T,etal. HPLC determination of polycyclic aromatic hydrocarbons (PAHs) in the littoral urban sewage area of Cortiou (Marseille France) [J]. Int J Environ Stud, 2004,61(4):413-425.
[8] SIMKO P. Determination of polycyclic aromatic hydrocarbons in smoked meat products and smoke flavouring food additives[J]. J Chromatogr B, 2002,770(1/2):3-18.
[9] 王 谢,崔师伟,张 伟,等. 豫南地区地表水多环芳烃污染分析[J]. 环境卫生学杂志, 2012,2(6):262-267.
[10] TERESA P M, LUIS P, CARMEN C M,etal. Sample preparation of sewage sludge and soil samples for the determination of polycyclic aromatic hydrocarbons based on one pot microwave assisted saponification and extraction[J]. Anal Bioanal Chem, 2007,387(7):2559-2564.
[11] 冯精兰,申君慧,翟梦晓,等. 超声萃取-高效液相色谱测定沉积物中的多环芳烃[J]. 河南师范大学学报:自然科学版, 2011,39(6):88-90.
[12] 钟惠英,郑 丹,杨家峰,等. 中华人民共和国水产行业标准-SC/T 3042-2008, 水产品中16种多环芳烃的测定:气相色谱-质谱法[S]. 北京:中国农业出版社,2008.
[13] 方 杰,王凯雄. 气相色谱-离子阱质谱法测定海洋贝类中多残留有机氯农药、多氯联苯和多环芳烃[J]. 分析化学, 2007,35(11):1607-1613.
[14] 孙秀梅,梅光明,陈雪昌,等. 高效液相色谱-荧光检测法测定水产品中15种多环芳烃[J]. 南方水产科学, 2012,8(3):48-53.
[15] LEHOTAY S J. Quick, easy, cheap, effective, rugged, and safe approach for dertermining pesticide residues[M]. New Jersey: Human Press, 2006:239-261.
[16] LEHOTAY S J, MASTOVSKA K, YUN S J. Evaluation of two fast and easy methods for pesticide residue analysis in fatty food matrixes[J]. J AOAC Int, 2005,88(2):630-638.
[17] 刘亚伟,董一威,孙宝利. QuEChERS在食品中农药多残留检测的应用研究进展[J]. 食品科学, 2009,30(9):285-288.
[18] 毕鸿梁,张浩原,孙翠香,等. 蔬菜中多环芳烃的GC-MS分析[J]. 分析测试学报, 2007,26(4):530-532.
[19] 戴廷灿,李伟红,廖且根,等. 改进的QuEChERS-液相色谱法检测蔬菜中的苯并[α]芘[J]. 分析测试学报, 2011,30(5):570-572.
[20] DIEZ C, TRAG W, ZOMMER P,etal. Comparison of all acetonitrile extraction partitioning and “dispersive solid-phase extraction” method with classical multiresidue methods for the extraction of herbicide residues in barley samples[J]. J Chromatogr A, 2006,1131(1-2):11-23.
(编辑 杨春明)
Simultaneous Determination of 16 Polycyclic Aromatic Hydrocarbons in Aquatic Products by QuEChERS/HPLC
WANYi-wen1,HUANGXiang-rong2*,CHENXiang-yi1,ZENGChun-fang2
(1.Fishery Products Quality Supervision and Testing Center, Ministry of Agriculture, Changsha 410153, China;2.Hunan Fisheries Science Institute,Changsha 410153, China)
An analytical method for the determination of 16 polycyclic aromatic hydrocarbons (PAHs) in aquatic products by high performance liquid chromatography was established. The sample was extracted with acetonitril, and the extract was cleaned up with C18and Alumina-N, detected with fluorescence and ultraviolet detector for PAHs. The results showed that the 16 PAHs can be separated efficiently. The detection limits of this method were 0.5~5.0 μg/kg. The relative standard deviations were ranging from 1.7%~9.2%, and the recovery rates were from 71.8%~98.8%. The method proposed by this paper possesses higher producibility and selectivity, and has promising applications in determining the PAHs in aquatic products.
QuEChERS; high performance liquid chromatography; polycyclic aromatic hydrocarbons; aquatic products
2013-09-04
国家水产品质量安全监测资助项目(2011C028);湖南省养殖业科研项目(201115)
*
,E-mailhns-11@126.com
TS254.7
A
1000-2537(2014)01-0042-06
