玉屏风散对Hepa1-6肝癌荷瘤小鼠T淋巴细胞表型的影响※
2014-08-31张露蓉江国荣
姚 霏 张露蓉 江国荣
(南京中医药大学附属苏州市中医医院吴门医派研究院,江苏 苏州 215009)
实验研究
玉屏风散对Hepa1-6肝癌荷瘤小鼠T淋巴细胞表型的影响※
姚 霏 张露蓉 江国荣△
(南京中医药大学附属苏州市中医医院吴门医派研究院,江苏 苏州 215009)
目的探讨玉屏风散对肝癌荷瘤小鼠T淋巴细胞表型的影响。方法以皮下接种肿瘤细胞建立荷瘤C57BL/6小鼠模型,随机分为模型对照组、玉屏风散组(20、25、30 g生药/kg),并选取不荷瘤小鼠为正常对照组,每组各5只。玉屏风散组按20 mL/kg灌以生药浓度为1.00、1.25、1.50 g/mL)的玉屏风散浓缩液,每日1次,正常对照组与模型对照组灌以等容积0.9%氯化钠注射液,连续给药2周。2周后处死小鼠制备脾细胞悬液,应用免疫荧光标记法,采用流式技术检测和分析小鼠脾脏中CD4+CD25+、CD4+CD69+、CD8+CD69+、CD8+CD44+、CD8+CD44+CD62L-及CD8+CD44+CD62L+T细胞比例的变化。结果与正常对照组比较,玉屏风散组脾CD4+CD25+T细胞比例均下降(P<0.05,P<0.01);CD4+CD69+、CD8+CD69+、CD8+CD44+、CD8+CD44+CD62L-和CD8+CD44+CD62L+T细胞比例均增加(P<0.05,P<0.01)。与模型对照组比较,玉屏风散组脾CD8+CD44+和CD8+CD44+CD62L-T细胞比例均无变化(P>0.05);玉屏风散20 g生药/kg组、25 g生药/kg组CD8+CD69+T细胞比例增加(P<0.05);玉屏风散30 g生药/kg组CD4+CD25+T细胞比例有降低趋势,差异无统计学意义(P>0.05);CD4+CD69+和CD8+CD69+T细胞比例均下降(P<0.05,P<0.01);CD8+CD44+CD62L+T细胞比例增加(P<0.01)。结论玉屏风散通过降低CD4+CD25+调节性T细胞比例,促进CD8+T细胞活化,增加记忆型CD8+T细胞比例,从而改善肝癌小鼠免疫紊乱状态,发挥抗肿瘤作用。
玉屏风散;肝肿瘤;疾病模型,动物;小鼠;T淋巴细胞;表型
玉屏风散为中医扶正固表的经典名方,出自元·朱丹溪的《丹溪心法》,由黄芪、白术、防风3味药材组方而成。现代药理研究证明玉屏风散具有增强机体免疫力的功能[1-2],可促进荷瘤小鼠T细胞的增殖[3]。本实验室前期研究也表明玉屏风散具有微弱的直接抑瘤作用,主要通过对肝癌荷瘤小鼠免疫调节发挥抗肿瘤效应,提高机体特异性T细胞的免疫功能尤其明显[4]。
T细胞是机体极为重要的免疫细胞,其介导的免疫应答在抗肿瘤免疫中发挥重要作用。它表面存在诸多表面分化抗原CD,包括CD4+T细胞和CD8+T细胞2个亚群,在T细胞的活化过程中发挥重要功能,同时也是鉴定T细胞亚群的重要表面标志[5]。CD4+代表辅助性T细胞,CD8+代表抑制性和细胞毒性T细胞,CD4+、CD8+彼此相互调节,表现出辅助和抑制的作用,是免疫系统的核心[6]。当二者比例失调,这种对立统一的关系被破坏,导致免疫状态失衡,产生免疫功能紊乱。CD4+CD25+T细胞作为一类调节性T细胞[7],在肿瘤患者中表现为比例升高,提示该类细胞在肿瘤免疫中起下调作用[8]。CD69分子被称为活化诱导分子(AIM)[9],静止的T淋巴细胞一般不表达CD69,T细胞通过T细胞抗原受体(TCR)接受CD3/TCR复合物、植物血凝素(PHA)、蛋白激酶C激活物佛波酯(PMA)等刺激信号后,细胞表面就合成和表达一些新的糖蛋白,包括CD69、白细胞介素-2(IL-2)受体CD25、转铁蛋白受体CD71,这些分子被称为活化标志,其中最早表达的是CD69[10-11],刺激后1~2 h即可在T细胞表面发现[12],可用于评价T淋巴细胞的活化状态及活化效率。CD44及选择素-L(Selectin-L,亦称CD62L)为最主要的淋巴细胞归巢受体,介导淋巴细胞与组织中高内皮小静脉(HEV)的内皮细胞相互作用,参与淋巴细胞再循环。而且,细胞活化可致其表面的CD62L脱落。因此,通常认为CD44+CD62L-为效应T细胞的表达,而CD44+CD62L+为记忆型T细胞的表达。
本研究在前期研究的基础上,进一步围绕T细胞不同功能的亚群,观察玉屏风散对荷瘤肝癌小鼠T细胞免疫调节的影响及机制,为临床应用玉屏风散治疗肝癌提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级近交C57BL/6纯系雄性小鼠25只,体质量(20±2) g,购自苏州爱尔麦特科技有限公司实验动物中心,许可证号:SCXK(苏)2009-001。
1.1.2 实验药物 黄芪、白术、防风均由苏州市春晖堂药业有限公司提供(批号均为100601)。按黄芪∶白术∶防风为3∶1∶1的比例,加入加3倍量低温水,浸泡0.5 h,再加入5倍量水,回流提取1.5 h,过滤;取药渣再加入6倍量水,回流提取1 h,合并2次滤液。滤液浓缩适量,使得到浓度为1.00 g、1.25 g、1.50 g/mL(折合生药)的浓缩液,-4 ℃密封保存备用。
1.1.3 细胞株 Hepa1-6小鼠肝癌细胞,由苏州大学生命科学院惠赠。
1.1.4 试剂 DMEM培养液(GIBCO公司,批号1320158);胎牛血清(杭州四季青生物工程材料有限公司,批号100511);叠氮钠(NaN3,上海化学试剂供应站,批号890425);Anti-Mouse CD4 FITC(eBioscience公司,批号E00078-133);Anti-Mouse CD8a PerCP-Cy5.5(eBioscience公司,批号E08300-1630);Rat Anti-Mouse CD44 R-PE(invitrogen公司,批号282899G);Anti-Mouse CD62L APC(eBioscience公司,批号E07168-1630);Anti-Mouse CD25 APC(eBioscience公司,批号E07105-1631);Anti-Mouse CD69 FITC(eBioscience公司,批号E07175-1225);碳酸氢钾、氯化铵、乙二胺四乙酸二钠(EDTA-Na2)、磷酸缓冲盐(PBS)、流式细胞仪检测缓冲液(FACS buffer)等试剂均为国产分析纯试剂。
1.1.5 仪器 微量移液器,美国eppendorf公司;贺利氏二氧化碳培养箱,美国科峻仪器公司;Leica DMIL倒置显微镜,德国徕卡仪器有限公司;Z 320K低温高速离心机,德国HERMLE公司;流式细胞仪,美国BD公司。
1.2 实验方法
1.2.1 分组及给药 选取20只小鼠适应性饲养3 d后用于种瘤。无菌条件下,取对数生长期的Hepa1-6细胞用于实验。将Hepa1-6细胞消化后,用PBS稀释成1×107/mL的细胞悬液,接种于小鼠右腋皮下,每只接种0.2 mL以形成实体瘤,当扪及接种小鼠皮下结节直径约达5 mm时,将小鼠随机分为4组,每组5只。选取5只不荷瘤小鼠为正常对照组。分组当日开始给药,玉屏风散组按20 mL/kg给予生药浓度为1.00、1.25、1.50 g/mL的玉屏风散浓缩液灌胃,正常对照组与模型对照组灌以等容积0.9%氯化钠注射液灌胃,每日1次,连续给药2周。
1.2.2 脾细胞悬液的制备 小鼠末次给药24 h后给予放血断髓处死,快速剖开腹腔,取脾,去除周围的结缔组织,称质量记录,剪碎脾脏,在毛玻片上磨细,过200目尼龙网,收集滤液,1 000 r/min离心5 min,弃上清液,加入10~15 mL红细胞裂解液,混悬脾细胞,静置10~20 min后1 000 r/min离心5 min,弃上清,再用PBS洗一遍细胞,最后加1 mL FACS buffer重新悬浮细胞。以上操作均在冰上进行。利用细胞计数板,镜下计数并记录。
1.2.3 免疫荧光标记法检测 于96孔板中加入50 μL 用FACS buffer悬浮好的脾细胞,加入50 μL 已经用FACS buffer稀释好的各抗体(CD4、CD8、CD25、CD69、CD44及CD62L),与细胞混匀(每孔约1×105~6个细胞),4 ℃避光孵育30 min。每孔加入150 μL FACS buffer洗涤细胞,1 200 r/min离心5 min。弃200 μL上清液,加200 μL FACS buffer洗涤细胞2遍,1 200 r/min离心5 min。加200 μL FACS buffer,转移到流式管中,上流式细胞仪检测。每个样本收集10 000个细胞用于数据分析,采用FLOWJO软件处理样品数据。
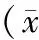
2 结 果
2.1 玉屏风散对Hepa1-6肝癌荷瘤小鼠CD4+CD25+T细胞比例的影响 见表1。
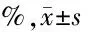
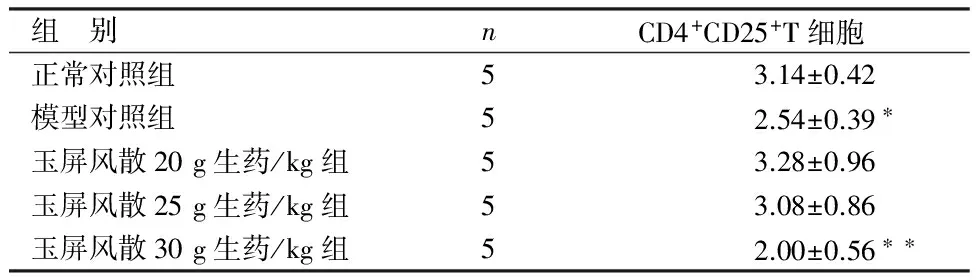
组 别nCD4+CD25+T细胞正常对照组53.14±0.42模型对照组52.54±0.39∗玉屏风散20g生药/kg组53.28±0.96玉屏风散25g生药/kg组53.08±0.86玉屏风散30g生药/kg组52.00±0.56∗∗
与正常对照组比较,*P<0.05,**P<0.01
由表1可见,与正常对照组比较,模型组和玉屏风散30 g生药/kg组CD4+CD25+T细胞比例均明显下降(P<0.05,P<0.01)。与模型对照组相比,玉屏风散20、25 g生药/kg组CD4+CD25+T细胞比例有上升趋势,玉屏风散30 g生药/kg组CD4+CD25+T细胞比例有进一步降低趋势,但差异均无统计学意义(P>0.05)。玉屏风散各剂量组之间互相比较,随着剂量增加,CD4+CD25+T细胞比例呈现逐步降低,但组别之间均无显著变化(P>0.05)。
2.2 玉屏风散对Hepa1-6肝癌荷瘤小鼠CD4+CD69+、CD8+CD69+T细胞比例的影响 见表2。
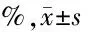
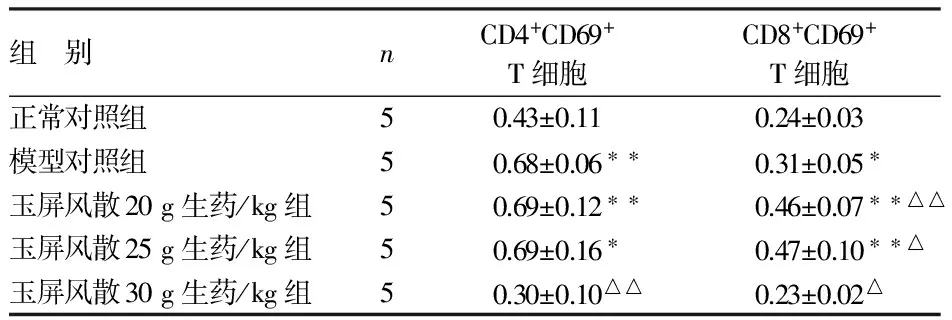
组 别nCD4+CD69+T细胞CD8+CD69+T细胞正常对照组50.43±0.110.24±0.03模型对照组50.68±0.06∗∗0.31±0.05∗玉屏风散20g生药/kg组50.69±0.12∗∗0.46±0.07∗∗△△玉屏风散25g生药/kg组50.69±0.16∗0.47±0.10∗∗△玉屏风散30g生药/kg组50.30±0.10△△0.23±0.02△
与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,△P<0.05,△△P<0.01
由表2可见,与正常对照组比较,模型对照组和玉屏风散20、25 g生药/kg组CD4+CD69+、CD8+CD69+T细胞比例明显增加(P<0.05,P<0.01);但玉屏风散30 g生药/kg组CD4+CD69+和CD8+CD69+T细胞比例均略有下降(P>0.05)。与模型对照组相比,玉屏风散20、25 g生药/kg组CD4+CD69+T细胞比例无变化(P>0.05),CD8+CD69+T细胞比例则明显增加(P<0.05);但玉屏风散30 g生药/kg组CD4+CD69+和CD8+CD69+T细胞比例均明显下降(P<0.05,P<0.01)。
2.3 玉屏风散对Hepa1-6肝癌荷瘤小鼠CD8+CD44+、CD8+CD44+CD62L-及CD8+CD44+CD62L+T细胞比例的影响 见表3。
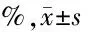

组 别nCD8+CD44+T细胞CD8+CD44+CD62L-T细胞CD8+CD44+CD62L+T细胞正常对照组535.87±1.4024.99±1.3310.88±1.84模型对照组545.09±5.45∗31.02±5.9114.08±2.77玉屏风散20g生药/kg组550.12±6.52∗∗35.59±7.04∗14.54±2.62∗玉屏风散25g生药/kg组549.59±6.41∗∗34.62±7.12∗14.99±2.84∗玉屏风散30g生药/kg组551.09±5.12∗∗31.08±4.57∗20.00±1.71∗∗△△
与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,△△P<0.01
由表3可见,与正常对照组比较,模型对照组和玉屏风散组的CD8+CD44+T细胞比例均明显增高(P<0.05,P<0.01);玉屏风散组的CD8+CD44+CD62L-和CD8+CD44+CD62L+T细胞比例同样明显增加(P<0.05,P<0.01)。与模型对照组相比,玉屏风散组CD8+CD44+和CD8+CD44+CD62L-T细胞比例变化不明显(P>0.05);而玉屏风散30 g生药/kg组的CD8+CD44+CD62L+T细胞比例明显增加(P<0.01)。
3 讨 论
前期实验结果表明,在肿瘤状态下,玉屏风散对CD4+T和CD8+T比例无影响,也无剂量依赖性,反映玉屏风散在一定剂量范围内,发挥对免疫系统的调节作用,以维持免疫系统的稳定[4]。
CD4+CD25+T细胞比例下降,表现为T细胞免疫的增强;高剂量的玉屏风散(30 g生药/kg)可以使其进一步下降,提示玉屏风散可以通过降低CD4+CD25+调节性T比例,上调荷瘤小鼠的免疫状态,达到抗肿瘤的效应。玉屏风散20 g、25 g生药/kg可以使荷瘤小鼠脾脏中CD8+CD69+T细胞比例进一步明显增加(P<0.05),这提示玉屏风散有促进CD8+T淋巴细胞活化的作用,发挥T淋巴细胞,尤其是细胞毒性T细胞杀伤肿瘤细胞的作用。但玉屏风散30 g生药/kg剂量组明显降低荷瘤小鼠脾脏中CD4+CD69+和CD8+CD69+T细胞比例(P<0.05,P<0.01),且降低至正常小鼠的水平,这其中的作用机制还有待于进一步的研究。这可能与玉屏风散对免疫调节作用主要体现维持机体内的免疫平稳状态有关。荷瘤小鼠脾脏中CD8+CD44+CD62L-和CD8+CD44+CD62L+T细胞比例均增高,表明荷瘤小鼠细胞毒性T细胞活性增强;玉屏风散可以保持这种增高状态,而且高剂量玉屏风散(30 g生药/kg)可进一步增加荷瘤小鼠脾脏中CD8+CD44+CD62L+T细胞的比例(P<0.01),提示玉屏风散可保持荷瘤小鼠细胞毒性T细胞活性的免疫增强状态,并增加记忆型CD8+T细胞比例,增强了荷瘤小鼠对Hepa1-6肿瘤细胞的特异性T细胞免疫的激活。
玉屏风散对Hepa1-6肝癌小鼠免疫调节的机制可能是通过降低CD4+CD25+调节性T细胞比例,促进CD8+T淋巴细胞活化,增加记忆型CD8+T细胞比例,从而改善荷瘤小鼠免疫紊乱状态,达到抗肿瘤的效应。但由于实验方法的局限性,需要进一步采用原位种植荷瘤小鼠模型或基因敲除诱导型肿瘤模型,观察玉屏风散对肿瘤免疫调节的特点。
[1] 周若梅,李来秀.玉屏风口服液的药理学研究[J].陕西中医,2004,25(1):71-73.
[2] 周春权,姚欣,林静瑜,等.玉屏风粗多糖的提取及药理实验[J].海峡药学,2004,16(2):38-40.
[3] 张红军,唐小云,鞠宝玲,等.玉屏风散对S180荷瘤小鼠肿瘤生长及免疫功能的影响[J].细胞与分子免疫学杂志,2008,24(7):683-685.
[4] 张露蓉,姚霏,江国荣.玉屏风散对Hepa1-6肝癌荷瘤小鼠免疫调节的影响[J].东南大学学报:医学版,2014,33(1):34-39.
[5] 李凤铭,陈剑华,孙雪文,等.加味玉屏风散对60Coγ照射小鼠T淋巴细胞免疫功能的影响[J].时珍国医国药,2011,22(5):1179-1180.
[6] 王月飞,赵红晔,王玉阁,等.玉屏风散生物转化液对免疫抑制小鼠细胞免疫的干预作用[J].中国实验方剂学杂志,2010,16(14):176-178.
[7] Piccirilllo CA,Shevach EM.Naturally-occurring CD4+CD25+immunoregulatory T cells: central players in the arena of peripheral tolerance[J].Semin Immunol,2004,16(2):81-88.
[8] Terabe M,Berzofsky JA.Immunoregulatory T cells in tumor immunity[J].Curr Opin Immunol,2004,16(2):157-162.
[9] Testi R,D'Ambrosio D,De Maria R,et al.The CD69 receptor: a multipurpose cell-surface trigger for hematopoietic cells[J].Immunol Today,1994,15(10):479-483.
[10] Ziegler SF,Ramsdell F,Alderson MR.The activation antigen CD69[J].Stem Cells,1994,12(5):456-465.
[11] Simms PE,Ellis TM.Utility of flow cytometric detection of CD69 expression as a rapid method for determining poly-and oligoclonal lymphocyte activation[J].Clin Diagn Lab immunol,1996,3(3):301-304.
[12] 付立奎,刘宁宁,高立生.CD69分子在肿瘤抗原体外活化H22肝癌腹水瘤小鼠脾淋巴细胞的表达[J].河北医学,2010,16(6):649-652.
(本文编辑:李珊珊)
·信息·
2013年度中国药学发展奖颁奖
5月7日,2013年度中国药学发展奖颁奖大会在京举行,中国药科大学王广基院士荣获特殊贡献奖。来自中国科学院上海药物研究所、军事医学科学院毒物药物研究所等单位的17位专家分别获得创新药物奖、康辰骨质疏松医药研究奖以及食品药品质量检测技术奖。
中国药学发展奖是经科技部首批批准的26个全国性奖项之一,是由社会力量设立的全国性医药学奖项,每两年颁奖一次。该奖项旨在奖励在医药学领域作出突出贡献或取得重大科技成果的医药学科技工作者,促进医药事业的发展。此次会议由中国药学发展奖奖励工作委员会和中国药学会联合主办。
InfluenceofYupingfengpowderonTlymphocytesphenotypeinHepa1-6HCCtumor-bearingmice
YAOFei,ZHANGLurong,JIANGGuorong.
Wu’sInstituteofMedicalSchool,SuzhouHospitalofTraditionalChineseMedicineAffiliatedtoNanjingUniversityofTraditionalChineseMedicine,Jiangsu,Suzhou215009
ObjectiveTo research the effect of Yupingfeng powder on T lymphocytes phenotype in Hepa1-6 HCC tumor-bearing mice.MethodsA tumor-burdened C57BL / 6 mice model were established by injecting Hepa1-6 cells into mice intradermally. Model mice were randomly divided into model group,low-,middle-,and high-dose (20,25,30g crude drug/kg) Yupingfeng powder group. Not tumor-burdened mice were chosen in the control group. Yupingfeng powder concentrated solution was given in low-,middle-,and high-dose (20,25,30 g crude drug/kg) Yupingfeng powder group,once a day. Control group and model group was fill in with the same amount of saline solution,for two weeks in a row. After two weeks CD4,CD8,CD25,CD69,CD44 and CD62L were analyzed by immunofluorescence method and flow cytometry.ResultsCompared with control group,the proportion of CD4+CD25+T Cells in Yupingfeng powder group were reduced (P<0.05,P<0.01); the proportion of CD4+CD69+,CD8+CD69+,CD8+CD44+,CD8+CD44+CD62L-and CD8+CD44+CD62L+T Cells were increased (P<0.05,P<0.01). There was no difference between model group and Yupingfeng powder group on the proportion of CD8+CD44+and CD8+CD44+CD62L-T cells (P>0.05). The ratio of CD8+CD69+T Cells in mid and low dose Yupingfeng powder group were increased (P<0.05); the proportion of CD4+CD25+T Cells had reducing trend in high dose group,but did not have any statistical significance; the proportion of CD4+CD69+and CD8+CD69+T Cells both reduced (P<0.05,P<0.01); the proportion of CD8+CD44+CD62L+T Cells increased (P<0.01).ConclusionYupingfeng powder have antineoplastic effects which are embodied in these areas,it can reduce the ratio of CD4+CD25+regulatory T Cell,improve the activation of CD8+T cells,raise the ratio of memory CD8+T cells and then improve the immunologic derangement state of C57 mice.
Yupingfeng powder; Liver cancer; Disease models; Animal; Mouse; T lymphocytes; Phenotype
※ 项目来源:2009—2010年度江苏省中医药科技项目(编号:LZ09119);苏州市2009年度高层次人才资助项目(编号:2009-07);2009年苏州市科教兴卫青年科技项目(编号:SWKQ0928);苏州市2010年度第四批科技发展计划(应用基础研究)项目(编号:SYS201053)
△ 通讯作者:江苏省苏州市中医医院吴门医派研究院,江苏 苏州 215009
姚霏(1985—),女,中药师,学士。研究方向:主要从事中药与肿瘤免疫工作。
R289.5;R735.7;R331.125
A
1002-2619(2014)05-0742-04
2013-06-21)
