ClC-3在SIN-1诱导的大鼠海马神经元凋亡中的作用*
2014-08-31金小小张淑玲徐黎娟范洪领钟志超常全忠
金小小,张淑玲,徐黎娟,范洪领,钟志超,李 曦,常全忠#
1)遵义医学院珠海校区生理学教研室 珠海 519041 2)遵义医学院珠海校区儿科学教研室 珠海 519041 3)莆田市第一医院检验科 莆田 351100
ClC-3在SIN-1诱导的大鼠海马神经元凋亡中的作用*
金小小1),张淑玲2),徐黎娟3),范洪领1),钟志超1),李 曦1),常全忠1)#
1)遵义医学院珠海校区生理学教研室 珠海 519041 2)遵义医学院珠海校区儿科学教研室 珠海 519041 3)莆田市第一医院检验科 莆田 351100
#通讯作者,男,1965年5月生,博士,教授,研究方向:缺血性脑损伤及其保护机制,E-mail:cqzchang@sina.com
ClC-3氯通道;3-吗啡斯得酮胺;海马神经元;细胞凋亡;4,4’-二异硫氰基芪-2,2’-二磺酸
目的:探讨ClC-3氯通道在NO供体SIN-1诱导的大鼠海马神经元凋亡中的作用。方法取离体培养12 d的SD大鼠海马神经元,分为对照组、SIN-1组和SIN-1+DIDS组。对照组不作处理,SIN-1组加入终浓度为0.5 mmol/L SIN-1作用18 h,SIN-1+DIDS组加入终浓度为0.5 mmol/L SIN-1和0.1 mmol/L DIDS作用18 h。采用细胞免疫荧光染色和免疫印迹技术检测各组ClC-3氯通道蛋白的表达,实时定量PCR技术检测各组ClC-3氯通道 mRNA的表达。结果各组Caspase-3和ClC-3氯通道表达的差异有统计学意义(蛋白:FCaspase-3=118.330,P<0.001;FClC-3氯通道=102.750,P<0.001;mRNA:FClC-3氯通道=32.955,P<0.001)。SIN-1诱导凋亡神经元ClC-3氯通道蛋白表达增强,氯通道阻断剂DIDS削弱ClC-3氯通道的表达。结论ClC-3氯通道可能参与SIN-1诱导大鼠海马神经元的凋亡。
脑卒中是常见的脑血管疾病,缺血性脑损伤引起者多见,而神经元的凋亡直接影响到缺血性脑损伤的预后[1]。目前,缺血性脑损伤神经元凋亡的机制尚未阐明。近年来氯通道在缺血性脑损伤中的作用成为关注的热点[2-3]。研究[4]显示, 氯通道的激活所引起的心肌细胞容积减少在细胞凋亡过程中起关键作用,推测这种氯通道可能是ClC-3。作者[5]前期的研究结果提示ClC-3在缺血性脑损伤海马神经元凋亡中可能有一定的作用。该研究利用NO供体3-吗啡斯得酮胺(SIN-1)诱导离体大鼠海马神经元损伤,通过细胞免疫荧光染色、Western blot和实时定量荧光PCR技术检测ClC-3在神经元损伤过程中表达的变化,探讨ClC-3活动与缺氧敏感性神经元凋亡的关系。
1 材料与方法
1.1实验动物和试剂新生1 d的SD大鼠,由遵义医学院实验动物中心提供;DMEM/F12和Neurobasal培养基、B27(美国Gibco公司产品);SIN-1、氯通道阻断剂4,4’-二异硫氰基芪-2,2’-二磺酸(DIDS)、ClC-3蛋白抗体、多聚赖氨酸、阿糖胞苷、DMEM/F12和Neurobasal培养液等试剂购自美国Sigma公司;胎牛血清(杭州四季青公司产品)。
1.2离体海马神经元的培养参照文献[5-6]方法,取出生1 d的SD大鼠,雌雄不拘,无菌断头取脑,分离双侧海马并将其剪碎,2.5 g/L胰蛋白酶37 ℃消化15 min,加入DMEM/F12培养液并吹打均匀,200目筛网过滤,1 000 r/min离心10 min,弃上清液,加入DMEM/F12培养液(含有体积分数10%胎牛血清、0.2 mol/L谷氨酰胺和1 U/mL青、链霉素),吹打混匀后接种在培养板内,置于含有体积分数95%空气和5%CO2、37 ℃饱和湿度的培养箱培养,48 h后更换为Neurobasal培养液,加入1×10-5mol/L阿糖胞苷作用48 h。每周更换培养基2次,每次更换原液体的1/3。
1.3实验分组及处理取培养12 d的神经元加入24孔板,随机分为对照组、SIN-1组和SIN-1+DIDS组。对照组常规培养,SIN-1组加入终浓度为0.5 mmol/L SIN-1作用18 h,SIN-1+DIDS组加入终浓度为0.5 mmol/L SIN-1和0.1 mmol/L DIDS作用18 h。每组设6个复孔。
1.4ClC-3蛋白的免疫荧光染色检测取各组细胞,0.1 mol/L PBS漂洗,40 g/L多聚甲醛固定30 min, 0.1 mol/L PBS漂洗,正常山羊血清封闭1 h,加入ClC-3抗体(稀释1 000倍),4 ℃过夜,0.1 mol/L PBS 漂洗后多聚甲醛固定15 min,经0.1 mol/L PBS 漂洗,山羊血清封闭1 h,NeuN抗体(稀释1 000倍),4 ℃过夜,0.1 mol/L PBS漂洗,多聚甲醛固定30 min,加入二抗羊抗兔IgG(稀释2 000倍)、羊抗小鼠IgG(稀释2 000倍)作用1 h,0.1 mol/L PBS漂洗,多聚甲醛固定15 min, PBS漂洗后倒置荧光显微镜下观察。
1.5ClC-3和Caspase-3蛋白的Westernblot检测
取各组细胞,用冰冷0.1 mol/L PBS洗涤后每孔加200 μL细胞裂解液,提取细胞总蛋白,BAC法测定蛋白含量并调节蛋白浓度。加入5×SDS上样缓冲液,煮沸10 min使蛋白变性,SDS-PAGE电泳,NC膜转移,50 g/L脱脂奶粉室温封闭2 h,加入一抗Caspase-3多克隆抗体或ClC-3抗体(400倍稀释),4 ℃过夜,TBST缓冲液漂洗后加入HRP标记的二抗(2 000倍稀释) 37 ℃孵育1 h,TBST缓冲液漂洗5×5 min,ECL显影。以目的蛋白条带与β-actin条带灰度值比值作为目的蛋白的相对表达水平。
1.6ClC-3mRNA表达的实时定量荧光PCR检测ClC-3上游引物:5’-CTACTACCACCACGACTG-3’,下游引物:5’ -TTGTCACACCACCTAAGC-3’,扩增片段大小116 bp;GAPDH上游引物:5’-CTCCCATT CCTCCACCTTTG-3’,下游引物:5’-CCACCACCCTGT TGCTGTAG-3’,扩增片段大小110 bp。参照文献[7]提取各组神经元总RNA,用1.0 g/L琼脂糖凝胶电泳检测其完整性后进行RNA反转录,染料法(SYBR Green I) 进行相对定量分析。反应条件:93 ℃预变性2 min,93 ℃变性30 s,55 ℃退火45 s,72 ℃延伸30 s,共40个循环。PCR反应结束后,进行融解曲线分析。利用ABI PRISM 7000 Sequence Detection System图像分析系统,采用2-ΔΔCt进行相对定量分析,以GAPDH作为内参基因。实验重复6次。
1.7统计学处理应用SPSS 13.0分析,采用单因素方差和SNK-q检验分析比较各组Caspase-3和ClC-3的表达,检验水准α=0.05。
2 结果
2.1ClC-3蛋白的免疫荧光染色结果SIN-1诱导海马凋亡神经元ClC-3蛋白表达增强,氯通道阻断剂DIDS削弱了ClC-3蛋白的表达(图1)。
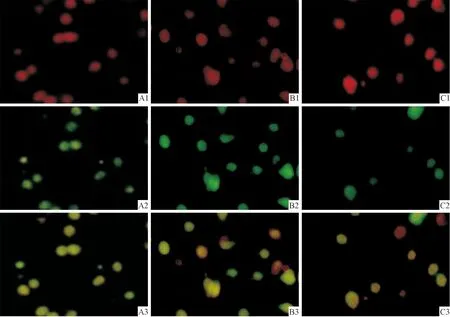
图1 各组ClC-3蛋白的免疫荧光染色结果(×400)
2.2各组Caspase-3和ClC-3蛋白表达的Westernblot结果见图2和表1。
2.3ClC-3mRNA表达的检测结果见表1。
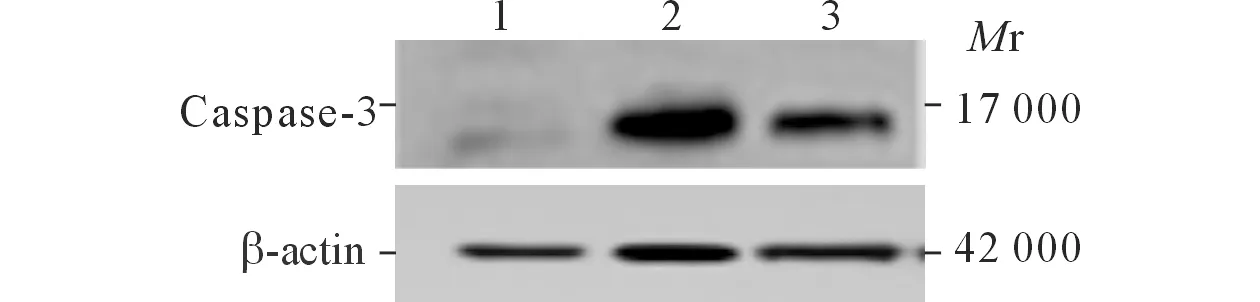
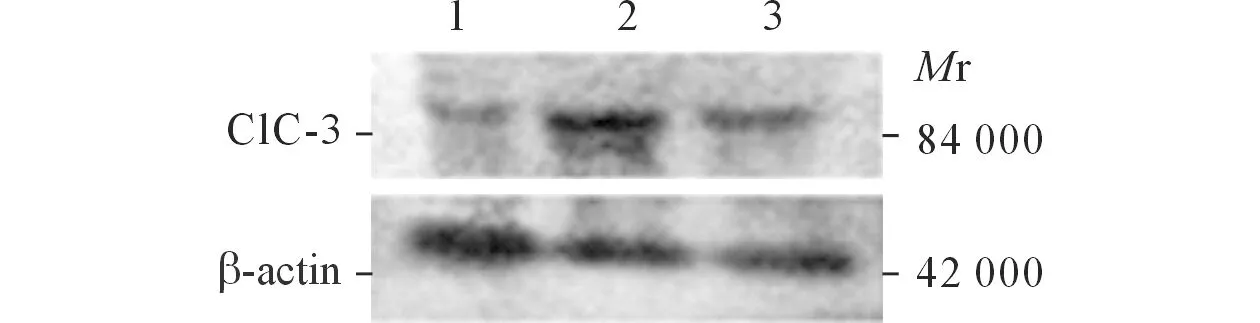
图2 各组Caspase-3(上)和ClC-3(下)蛋白的Western blot 结果
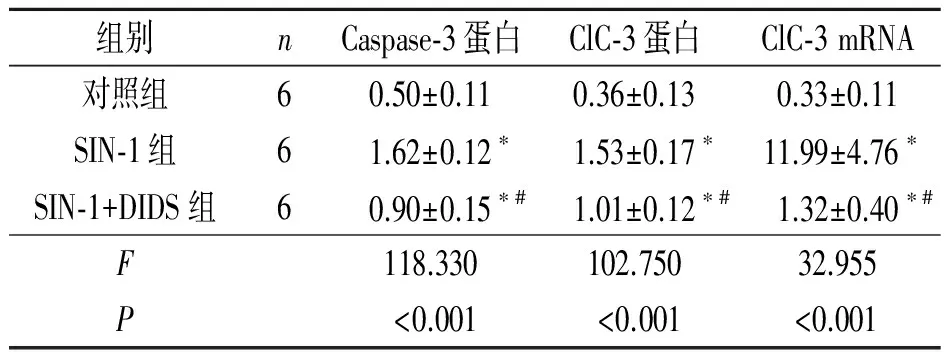
表1 各组Caspase-3和ClC-3表达的比较
*:与对照组比较,P<0.001;#:与SIN-1 组比较,P<0.001。
3 讨论
ClC-3为ClC型氯通道的家族成员之一,相对分子质量为84 000,广泛表达于各种细胞,在大鼠的海马、嗅球和小脑神经细胞上大量表达,参与细胞的多种生理功能[8-9]。氯通道在细胞凋亡中的重要作用逐渐引起重视。有学者[10]认为氯通道可能参与STS诱导的离体小鼠心肌细胞缺血性凋亡。氯通道阻断剂NPPB可通过抑制H2O2激活的氯电流,阻滞细胞凋亡容积减少,从而防止PC12细胞发生凋亡。氯通道也参与了肿瘤细胞的凋亡[11]。
NO的过量产生是缺血性脑损伤后神经元凋亡的机制之一,而生理浓度的NO不会损伤神经元[12-13]。作者模拟缺血性脑损伤神经元凋亡的机制,选用NO供体诱导离体神经元损伤。SIN-1是一种常用的诱导神经元凋亡的NO供体,在水溶液中能产生大量的NO,后者可与O2结合生成自由基。根据文献[14],作者选择0.5 mmol/L SIN-1用于离体海马神经元凋亡的诱导。SIN-1 诱导神经元损伤后ClC-3蛋白和mR NA表达水平增强,而氯通道阻滞剂DIDS能削弱SIN-1诱导的ClC-3的表达。该研究结果提示ClC-3的活动与离体海马神经元凋亡之间有一定关系,ClC-3可能参与了SIN-1诱导的海马神经元凋亡。
ClC-3活动增强引起神经元凋亡的机制尚不清楚。资料[3,15]显示,ClC-3 氯通道具有外向整流特性并具有容积敏感性,氯通道阻断剂SITS和DIDS在阻断细胞容积减少中起重要作用,结合该实验结果推测:缺血性脑损伤后,ClC-3氯通道表达增强,Cl-伴随K+的流出的同时也携带了细胞内水分大量外流,细胞容积减少进而诱发神经元的凋亡。ClC-3氯通道参与细胞凋亡的具体途径有待进一步研究。
[1]方向华,王淳秀,梅利平,等.脑卒中流行病学研究进展[J].中华流行病学杂志,2011,32(9):847
[2]常全忠,张淑玲,尹金宝,等.氯通道阻断剂对NO诱导离体大鼠海马神经元凋亡的保护作用[J].中国药理学通报,2009,25(9):1197
[3]钟志超,范洪领,尹金宝,等,氯通道电流在离体大鼠海马缺血缺氧性神经元凋亡中的变化及SITS的拮抗作用[J].郑州大学学报:医学版,2011,46(3):367
[4]Takahashi N, Wang X, Tanabe S, et al. CIC-3-independent sensitivity of apoptosis to CI channel blockers in mouse cardiomyocytes[J].Cell Physiol Biochem,2005,15(6):263
[5]常全忠,张淑玲,尹金宝.电压依赖性氯通道在3-吗啉斯德酮亚胺诱导的大鼠海马神经元凋亡中的作用[J].中国药理学与毒理学杂志,2010, 24(1): 8
[6]Gomes JR,Costa JT,Melo CV,et al.Excitotoxicity downregulates TrkB.FL signaling and upregulates the neuroprotective truncated TrkB receptors in cultured hippocampal and striatal neurons[J].J Neurosci,2012,32(13):4610
[7]Wong YW, Sia GM, Too HP. Quantification of mouse glial cell-line derived neurotrophic factor family receptor alpha 2 alternatively spliced isoforms by real time detection PCR using SYBR Green I[J]. Neurosci Lett,2002, 320 (3): 141
[8]郭晓强.ClC型氯离子通道[J].生理学进展,2005,36(1):58
[9]Hara-Chikuma M,Yang B,Sonawane ND,et al.CIC-3 chloride channels facilitate endosomal acification and chloride accumulation[J].J Biol Chem,2005,280(2):1241
[10]Machado I,Cruz J,Lavernia J,et al.Superficial EWSR1-negative undifferentiated small round cell sarcoma with CIC/DUX4 gene fusion:a new variant of Ewing-like tumors with locoregional lymph node metastasis[J].Virchows Arch,2013,463(6):837
[11]柏志全,李春英,李缘,等.氯通道在华蟾酥毒基诱导的鼻咽癌细胞凋亡中起重要作用[J].中国病理生理杂志,2011, 27(5):833
[12]Li C, Feng JJ, Wu YP, et al. Cerebral ischemia-reperfusion induces GAPDH S-nitrosylation and nuclear ranslocation[J]. Biochemistry (Mosc),2012,77(6):671
[13]李曦,尹金宝,钟志超,等.DIDS对SIN-1诱导大鼠海马神经元凋亡及PARP-1/AIF表达的影响[J].中国药理学通报,2012,28(11):1540
[14]Wei L,Xiao A Y,Jin C,et al.Effects of chloride and potassium channel blockers on apoptotic cell shrinkage and apoptosis in cortical neurons[J].Pflugers Arch,2004,448(3):325
[15]Yurinskaya VE, Moshkov AV, Wibberley AV, et al. Dual response of human leukemia U937 cells to hypertonic shrinkage: initial regulatory volume increase(RVI) and delayed apoptotic volume decrease(AVD)[J]. Cell Physiol Biochem,2012,30(4):964
(2013-06-05收稿 责任编辑李沛寰)
Effect of ClC-3 on hippocampal neuronal apoptosis of rats induced by SIN-1
JINXiaoxiao1),ZHANGShuling2),XULijuan3),FANHongling1),ZHONGZhichao1),LIXi1),CHANGQuanzhong1)
1)DepartmentofPhysiology,ZhuhaiCampusofZunyiMedicalCollege,Zhuhai519041 2)DepartmentofPediatrics,ZhuhaiCampusofZunyiMedicalCollege,Zhuhai519041 3)DepartmentofClinicalLaboratory,theFirstHospitalofPutianCity,Putian351100
ClC-3 chloride channel;SIN-1;hippocampal neuron;cell apoptosis;DIDS
Aim: To explore the expression of ClC-3 in the hippocampal neuronal apoptosis of rats induced by SIN-1. Methods: The hippocampal neurons from SD rats cultured for 12 days were randomly allocated into control group,SIN-1 group and SIN-1+DIDS group. The neurons in control group were not treated;the neurons in SIN-1 group were treated with 0.5 mmol/L SIN-1 for 18 h,and the neurons in SIN-1+DIDS group were treated with 0.5 mmol/L SIN-1 and 0.1 mmol/L DIDS for 18 h.Immunofluorescent staining, Western blot and PCR method were used to detect the expression of ClC-3 chloride. Results: The expressions of ClC-3 and Caspase-3 were different among the 3 groups(protein:FCaspase-3=118.330,P<0.001;FClC-3=102.750,P<0.001;mRNA:FClC-3=32.955,P<0.001). The expression of ClC-3 was enhanced after the SIN-1 induce neuronal apoptosis. Chloride channel blocker DIDS could significantly weaken the expression of ClC-3 inducing by SIN-1.Conclusion: ClC-3 may participate in the hippocampal neuron apoptosis induced by SIN-1.
10.13705/j.issn.1671-6825.2014.03.006
*国家自然科学基金资助项目 81160157;贵州省优秀科技人才省长基金 201209
R332
