拟南芥对镉胁迫的生理响应
2014-08-28王宇涛陈志勇曾琬淋李韶山
王宇涛, 陈志勇, 曾琬淋, 李韶山
(华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室,广州 510631)
镉(Cd)是一种具有很高生物毒性的重金属元素,也是造成我国农田土壤重金属污染的主要元素之一[1].高等植物虽然可以耐受一定浓度的Cd胁迫[2],但过量的Cd会通过损伤植物细胞结构、抑制细胞分裂、破坏酶活等方式直接或间接抑制植物的生理过程,最终抑制植物生长甚至导致植物死亡[2].Cd能够通过食物链的富集危害人体健康[3],因此阐明Cd 对植物的毒害及其耐性机理对于指导农业生产、环境治理及生态保护都具有重要意义.
拟南芥(ArabidopsisthalianaL.)是广泛应用于植物遗传学、发育生物学和分子生物学研究的模式植物.已有的研究[4-5]表明,Cd胁迫会导致拟南芥体内ROS积累,进而损伤拟南芥的光合系统,并导致其生长受阻.Cd还能使拟南芥体内在电子转移过程中发挥重要作用的金属蛋白质发生毒化,导致蛋白质、脂类及其它生物分子发生非特异性破坏[5-6].在遭受Cd胁迫时,拟南芥会通过自噬以及增强病原蛋白相关基因的表达来提高其对Cd的耐(抗)性[6].总体上,目前关于拟南芥对Cd胁迫的耐受机制以及Cd胁迫引起拟南芥细胞死亡的机制尚不清楚[4,6].本文通过研究拟南芥在不同Cd浓度下的生理响应探讨Cd的毒性效应以及拟南芥的耐性机理,为深入研究Cd对植物毒害的分子机制提供实验依据.
1 材料与方法
1.1 试验材料与处理
实验所用拟南芥为哥伦比亚野生型(ArabidopsisthalianaL. Heynh., Col-0).拟南芥种子经次氯酸钠溶液消毒后播种于含1.5%蔗糖和0.8%琼脂的1/2 MS培养基(pH 5.8),垂直培养.MS培养基中提前添加CdCl2,使Cd2+浓度分别为0、20、40、60和80 μmol/L,每个浓度设置3皿(每皿种植25株拟南芥)作为重复.培养皿放置于拟南芥培养室,培养室温度为22 ℃,光周期为16 h光照/ 8 h黑暗,光照强度为200 μmol/(m2·s).种植时间为14 d.
1.2 指标测定与分析
采取烘干称质量法测量每个培养皿中拟南芥幼苗的总生物量,并计算各皿中拟南芥的单株生物量.采取拍照—Image J软件计算的方法测定根长.根部形态观察:轻轻镊取处理14 d的拟南芥幼苗根部,置于玻片上.滴加0.1% evans blue将根部浸没,避光染色30 min,滴加去离子水将染料冲洗干净,晾干后于光学显微镜下观察并拍照.叶片叶绿素用体积分数80%丙酮提取,然后用分光光度法测定,计算总叶绿素、叶绿素a、叶绿素b以及类胡萝卜素的含量.拟南芥植株的可溶性蛋白、丙二醛(MDA)含量以及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的测定按照李合生[7]的方法. 植物根细胞DNA损伤的检测采用单细胞凝胶电泳法,通过测定嘧啶二聚体的累积量来表征DNA损伤程度,具体步骤参考文献[8-9].总酚含量的测定参考文献[10].类黄酮及花色素苷含量的测定参照文献[11].酸溶性硫醇盐、谷胱甘肽及植物螯合肽(PC)含量的测定参考王业社等[12]提供的方法.
1.3 数据分析
实验所得数据采用Microsoft Excel 2003软件和SPSS 17.0软件进行处理,采用最小显著差法(LSD)检验不同处理之间的差异显著性及处理效应.采用Origin 7.5软件完成作图.
2 结果与分析
2.1 Cd2+对拟南芥幼苗生长的影响
Cd2+处理明显抑制了拟南芥根的生长以及生物量的积累,随着Cd2+浓度的增加抑制作用明显增强(图1).在20 μmol/L的Cd处理下,生长14 d拟南芥幼苗的根长和生物量均极显著低于对照组(P<0.01),表明已经对拟南芥的生长产生了明显的胁迫效应.此外,在80 μmol/L的Cd2+浓度下拟南芥种子的萌发明显推迟,表明高浓度Cd2+处理能够抑制拟南芥种子的萌发.
Cd2+胁迫抑制了拟南芥根的生长,使根部形态发生明显改变(图2).未经Cd2+胁迫的幼苗根部的根毛稀疏且较短.随着Cd2+处理浓度增加,幼苗叶片根毛明显变得长而致密.
2.2 Cd2+对拟南芥光合色素含量的影响
Cd2+处理明显降低了拟南芥幼苗的叶绿素a、叶绿素b以及类胡萝卜素的含量,随着Cd2+浓度的增加抑制逐渐增强(图3).高浓度Cd2+处理下(60和80 μmol/L),拟南芥叶片的叶绿素a、叶绿素b以及类胡萝卜素含量均显著低于对照(P<0.05).
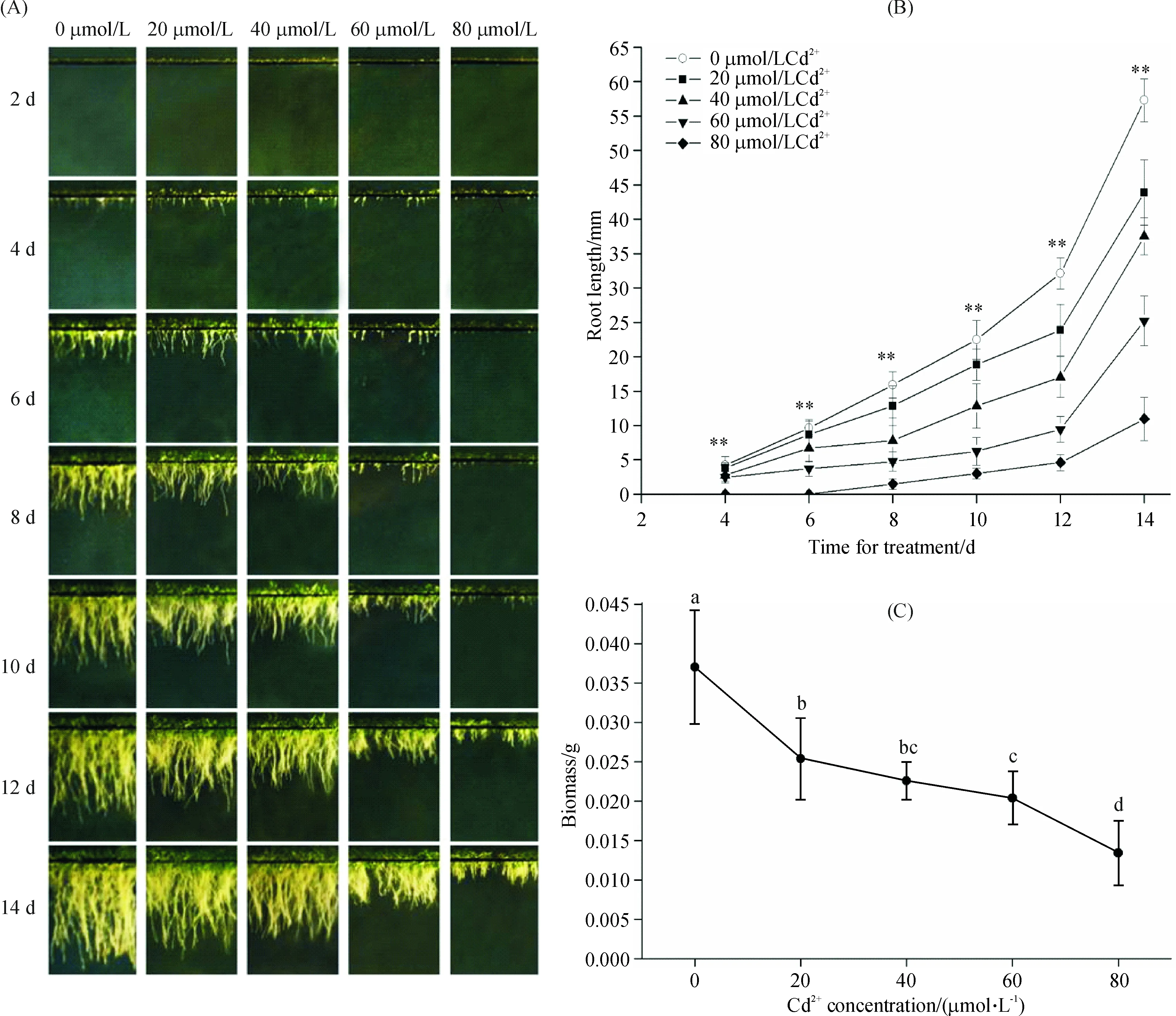
图中数据为平均值±标准差,n=3;图B中**表示在0.01检验水平差异显著;图C中不同字母表示在0.05检验水平差异显著.
2.3 Cd2+对拟南芥幼苗可溶性蛋白、丙二醛以及抗氧化酶的影响
随着Cd2+浓度的增加,拟南芥幼苗的可溶性蛋白以及丙二醛含量也逐渐上升(图4).在40 μmol/L及以上的Cd2+浓度处理下,拟南芥体内可溶性蛋白质含量要显著高于对照组(P<0.05).在60 μmol/L、80 μmol/L的高Cd2+浓度处理下,体内丙二醛含量极显著高于对照组(P<0.01),表明高浓度的Cd2+处理对拟南芥产生严重的氧化损伤.
随着Cd2+浓度的增加,拟南芥幼苗过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性均逐渐下降(图5).在所有的Cd浓度处理下,拟南芥幼苗的POD与SOD活性均极显著的低于对照组(P<0.01),表明在本研究中设置的Cd2+浓度下,拟南芥的抗氧化系统已经受到损伤.
2.4 Cd2+对拟南芥幼苗根部DNA损伤的影响
与对照相比,随着Cd2+处理浓度的增加,拟南芥幼苗根部DNA经电泳后的拖尾变长(图6A).当Cd2+处理浓度达60、80 μmol/L时,拟南芥幼苗根部DNA出现明显的降解现象.定量计算的结果表明,拟南芥中嘧啶二聚体的累积量随着Cd2+处理浓度的增加而显著上升(P<0.01).尤其是在Cd2+浓度达60、80 μmol/L时,嘧啶二聚体累积量急速增加(图6B).
2.5 Cd2+对拟南芥幼苗次生代谢物的影响
拟南芥体内的总酚、类黄酮以及花色素苷的含量均随着培养基中Cd2+浓度的增加逐渐上升(图7).80 μmol/L的Cd2+处理,使拟南芥体内的总酚及类黄酮含量均显著高于对照组(P<0.05).在20 μmol/L及以上的Cd2+浓度处理下,拟南芥体内的花色素苷含量均显著高于对照组(P<0.05).

图2 不同Cd2+浓度处理对拟南芥根部形态的影响
拟南芥体内的酸溶性硫醇盐、谷胱甘肽和植物螯合肽的含量均随着培养基中Cd2+浓度的增加而显著上升(图8).在20 μmol/L及以上的Cd2+浓度处理下,拟南芥体内的酸溶性硫醇盐、谷胱甘肽和植物螯合肽含量均极显著高于对照组(P<0.01).
3 讨论
Cd是植物的非必需元素.土壤或水体中过量的Cd被植物吸收后会对植物产生一系列的毒害作用.本研究中,拟南芥在Cd2+处理下叶绿素a、叶绿素b和类胡萝卜素含量均显著下降(P<0.05),且Cd浓度越高光合色素的含量越低,表明本研究的Cd2+处理对拟南芥体内的叶绿体结构造成了损伤.不少研究也报道,植物在Cd胁迫下叶绿素含量减少,使得PSⅡ活性和光合磷酸化作用明显受到抑制[13].这可能是由于Cd抑制了原叶绿素酸酯还原酶的活性,并影响了氨基-γ-酮戊二酸的合成[14].

A:叶绿素a;B:叶绿素b;C:叶绿素a+b;D:类胡萝卜素
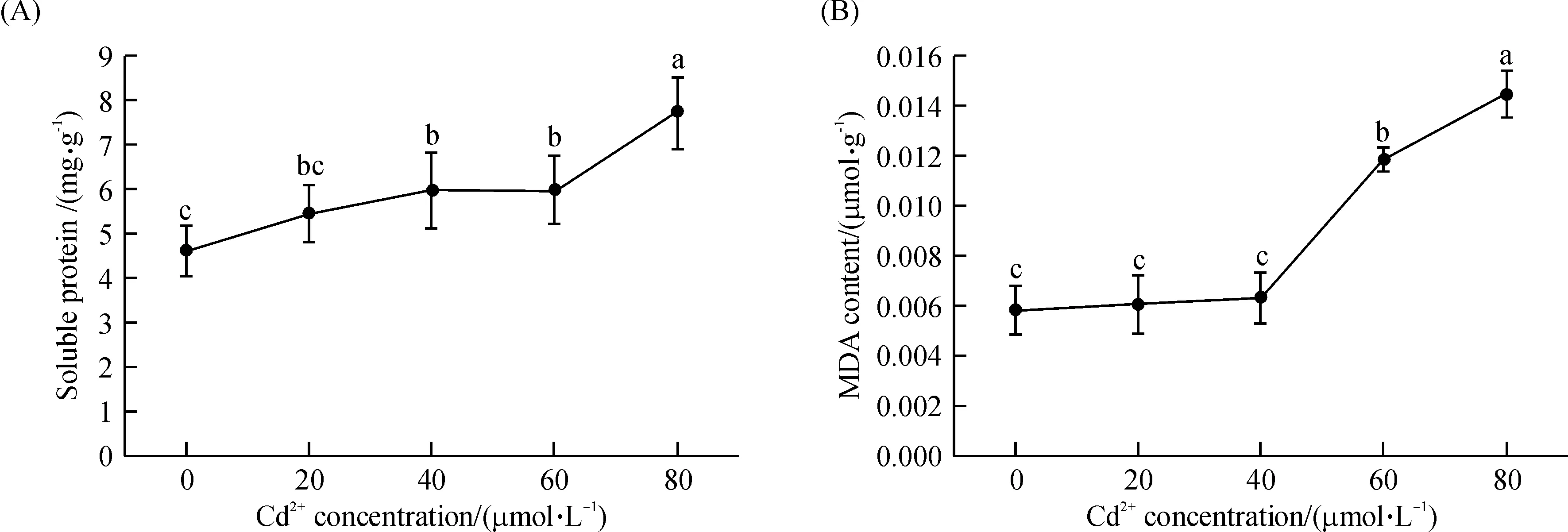
图4 不同Cd2+浓度处理下拟南芥体内可溶性蛋白(A)和丙二醛(B)的含量
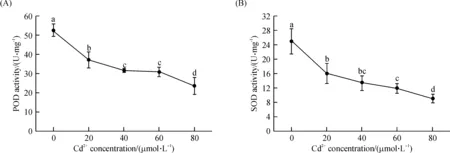
图5 不同Cd2+浓度处理下拟南芥体内过氧化物酶(A)和超氧化物岐化酶(B)的活性
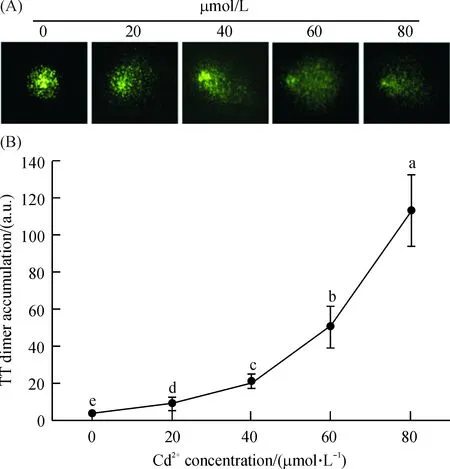
A:彗星检测图片,B:将彗星电泳图片转换成Olive Tail Moment (OTM)值代表嘧啶二聚体的积累量
正常条件下,植物体内活性氧的产生和清除处于动态平衡.受Cd胁迫后,平衡被破坏,导致活性氧大量积累,从而激活植物体内的抗氧化系统,诱导抗氧化酶活性发生改变[15-16].丙二醛是Cd胁迫下植物体内活性氧类物质大量积累所造成的膜脂过氧化的产物之一.在本研究中,受Cd胁迫后拟南芥幼苗的丙二醛含量显著上升,表明拟南芥体内积累的活性氧自由基导致了膜脂过氧化.在相对较低Cd浓度下,植物通过提高抗氧化酶的活性来降低体内的过氧化自由基;但是过高浓度的Cd2+下则会与抗氧化酶的巯基结合,导致酶的催化中心或酶结构受损,造成其活性的降低[16].本研究中,20 μmol/L及其以上的Cd2+处理使拟南芥幼苗的SOD和POD酶活性显著降低,表明该Cd2+浓度已经超过了拟南芥抗氧化酶的防御能力,进而对拟南芥抗氧化系统产生了损伤.
有研究发现,Cd胁迫能够引起植物根尖细胞加速老化、核仁受损,从而影响基因组模板的稳定性,并使DNA合成受阻[17].张旭红等[18]发现Cd诱导蚕豆叶片DNA发生损伤,在高浓度下甚至导致DNA双链断裂.本实验利用一种检测重金属污染对植物遗传效应的快速而敏感的彗星检测方法[8]发现,Cd2+胁迫能够显著诱导拟南芥根部细胞的DNA损伤为重金属胁迫导致植物细胞DNA损伤的直接证据.其作用机制可能是Cd2+通过氧化导致DNA损伤[19],改变碱基配对、破坏糖残基, 最终导致DNA结构破坏、链断裂.
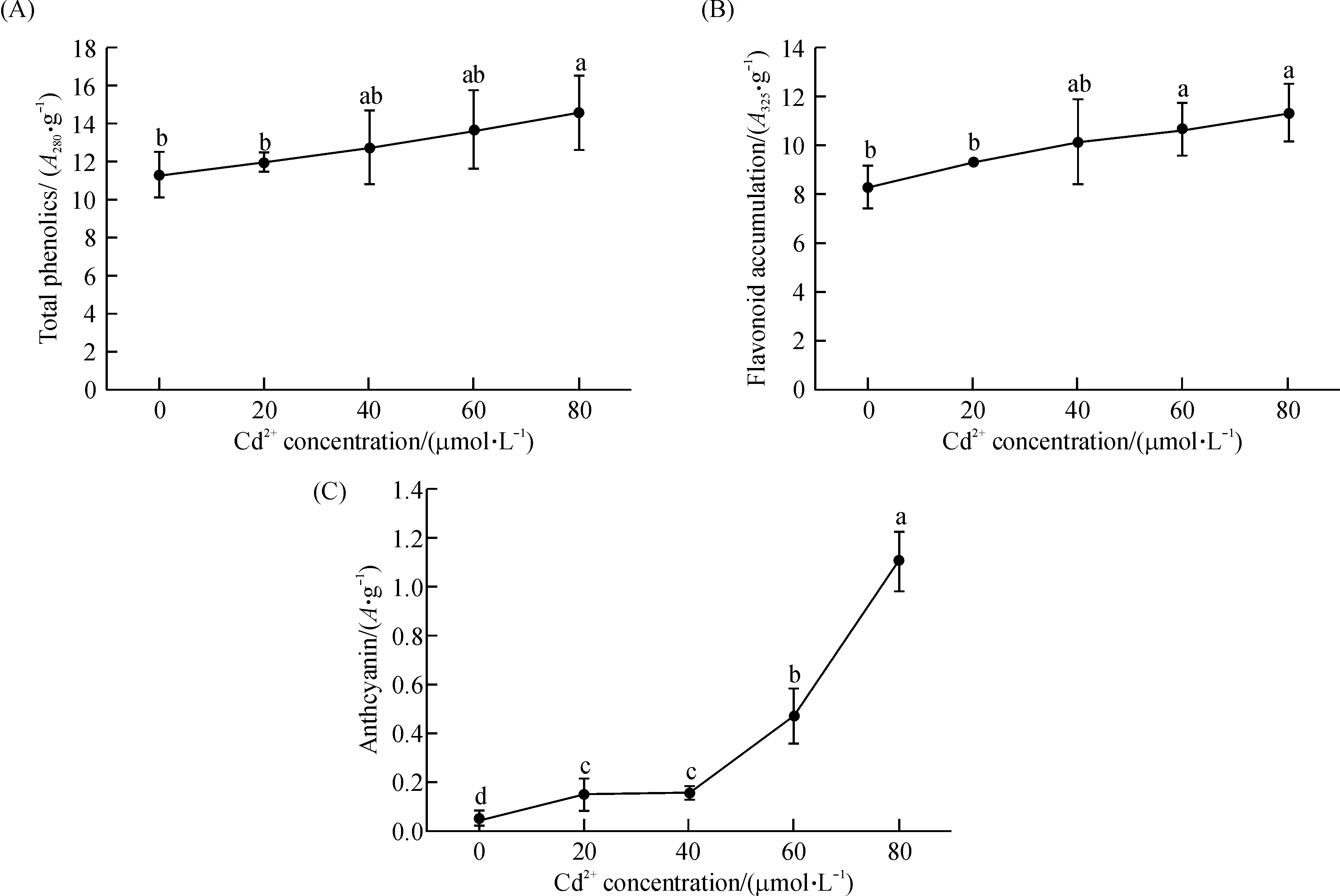
图7 不同Cd2+浓度对拟南芥体内总酚(A)、类黄酮(B)以及花色素苷(C)的影响

图8 不同Cd2+浓度对拟南芥体内酸溶性硫醇盐(A)、谷胱甘肽(B)和植物螯合肽(C)的影响
大量研究表明,重金属能够影响植物的生长,尤其是根的生长,其作用机理主要包括抑制植物根尖细胞的分裂或根的伸长、影响植物激素的分布或细胞死亡等[20].在本研究设置的Cd浓度明显抑制拟南芥根的伸长、生物量积累显著下降.类似的结果在其它植物(如玉米、大豆、番茄等)中已有不少报道[21].值得注意的是,受Cd胁迫后拟南芥根的伸长受到明显抑制,但是根毛却比对照组更长而致密.类似的结果在另外2种拟南芥属植物(Arabidopsisarenosa和Arabidopsishalleri)中也有报道[22].这一现象可能是拟南芥在重金属胁迫下对根长受到抑制的一种补偿效应:它们通过分化出更致密、更长的侧根来确保能够从环境中吸取生长所必须的营养;这种补偿效应对于植物在重金属胁迫下的存活可能至关重要[18].
酚类化合物在植物抗(耐)重金属方面的效应在近年来受到不少学者的关注[23].已经报道Ni、Al、Cd等重金属胁迫下小麦、玉米、菜豆等植物体内酚类物质含量的明显升高[24-25].酚类化合物通常通过螯合重金属离子以及抑制产生ROS的Fenton反应来提高植物的抗氧化能力[23].目前研究最多的酚类化合物是类黄酮,它在植物与环境的相互作用中起重要作用[25].研究表明,类黄酮与细胞膜中的膜磷脂相互作用能够阻止毒性小分子进入到磷脂双分子层的疏水区域,进而保护植物细胞膜的完整性[23].此外,类黄酮独特的化学结构还使得它们能够直接清除细胞内的活性氧自由基[23].花色素苷能够为植物的光合器官提供“保护罩”,以防止强光造成的光合机构损伤[26];它们还能够清除H2O2、O2-·、·OH等活性氧分子,其抗氧化能力约为α-生育酚和抗坏血酸的4倍[27].已知花色素苷抗氧化的一条重要途径是阻止活性氧在胞间连丝间的传播,防止细胞中产生的活性氧向其他细胞扩散[28].Hatier等[29]推测,花色素苷可能与活性氧信号传递途径的下游第二信使之间也存在着交互作用.在本实验中,受Cd胁迫后拟南芥的总酚、类黄酮、花色素苷的含量均呈现出明显的上升趋势,进一步证明了酚类物质(尤其是类黄酮和花色素苷)在拟南芥对Cd的耐(抗)性方面发挥了重要作用.
植物对重金属的耐性与其体内巯基以及谷胱甘肽含量密切相关[30].本研究中酸溶性巯基和谷胱甘肽含量均随着Cd浓度的增加而显著上升,表明它们与在拟南芥抗Cd毒害过程中发挥了重要的作用.其作用机制可能主要包括与Cd结合形成金属硫蛋白以及作为抗氧化剂清除拟南芥体内的活性氧自由基[30].植物螯合肽(phytochelations, PC)是由植物螯合肽合酶催化谷胱甘肽合成的一类生物小分子,在真菌与高等植物耐受重金属胁迫机制中起重要作用[31].不过有研究者认为,PC主要在非重金属耐性植物中发挥作用,而在超积累植物耐受重金属过程中并不重要[32].本研究中,拟南芥受Cd处理后植物螯合肽的含量迅速上升,且Cd2+处理的浓度越大,拟南芥幼苗中的PC含量越高,表明PC在拟南芥抵御Cd毒害作用过程中发挥重要作用.PC的这种作用可能是通过络合Cd2+,并将其转入到拟南芥的液泡中进行区室化保护[33].
综上所述,在不同浓度Cd2+处理下,拟南芥体内积累了较高浓度具有抗氧化活性的酚类物质(包括类黄酮和花色素苷等)以及能够抵御Cd毒害的谷胱甘肽和植物螯合肽.这些物质通过与螯合Cd2+、清除活性氧自由基等方式提高了拟南芥对Cd的耐受性.另一方面,本研究中设置的Cd浓度对拟南芥的生理活动产生了严重的胁迫效应,导致其体内活性氧自由基的积累.这些活性氧一方面造成植物细胞膜损伤、DNA损伤,另一方面还破坏了植物体内的抗氧化系统以及光合系统,并严重抑制了植物主根的生长以及生物量的积累.
参考文献:
[1] Qiu Q, Wang Y T, Yang Z Y, et al. Responses of different Chinese flowering cabbage (BrassicaparachinensisL.) cultivars to cadmium and lead exposure: Screening for Cd +Pb pollution-safe cultivars[J]. Clean-Soil, 2011, 39: 925-932.
[3] 龚玉莲,杨中艺.蕹菜典型品种的根系形态学特征及与Cd 吸收积累的关系[J]. 华南师范大学学报:自然科学版,2012, 44(3):100-106.
Gong Y L, Yang Z Y. Root morphology of typical cultivars of water spinach involved in Cd absorption and accumulation[J]. Journal of South China Normal University: Natural Science Edition,2012,44(3):100-106.
[4] Cuypers A, Smeets K, Ruytinx J, et al. The cellular redox state as a modulator in cadmium and copper responses in Arabidopsis thaliana seedlings[J].Journal of Plant Physiology, 2011,168:309-316.
[5] Zhang W N, Chen W L. Role of salicylic acid in alleviating photochemical damage and autophagic cell death induction of cadmium stress in Arabidopsis thaliana[J]. Photochemistry Photobiology Science,2011,10:947-955.
[6] 高玲, 张卫娜, 陈文利. 镉胁迫对拟南芥的毒害作用及自噬现象的观测[J]. 生物物理学报, 2011, 27(8): 676-686.
Gao L, Zhang W N, Chen W L. Cadmium toxicity and autophagy in Arabidopsis seedlings[J]. Acta Biophysica Sinica, 2011, 27(8): 676-686.
[7] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2005.
[8] Jiang L, Wang Y, Li S S. Application of the comet assay to measure DNA damage induced by UV radiation in the hydrophyte, Spirodela polyrhiza[J]. Physiology Plantarum, 2007,129:652-657.
[9] 聂志刚, 王艳, 李韶山. 重金属诱导拟南芥原生质体DNA损伤的单细胞凝胶电泳检测[J]. 植物学报, 2009, 44: 117-123.
Nie Z G, Wang Y, Li S S. Heavy metal-induced DNA damage in Arabidopsis thaliana protoplasts measured by single-cell gel electrophoresis[J]. Chinese Bulletin of Botany, 2009, 44(1): 117-123.
[10] 李倩, 刘子衿, 叶燕彬, 等. 分光光度法测定仙鹤草总酚含量的方法研究[J]. 首都医科大学学报, 2012, 33(1): 107-110.
Li Q, Liu Z J, Ye Y B, et al. Study on determining of total polyphenols content inagrimoniapilosaledeb. by the spectrophotometry[J]. Journal of Capital Medical University, 2012, 33(1): 107-110.
[11] Nogues S, Baker N R. Effects of drought on photosynthesis in Mediterranean plants grown under enhanced UV-B radiation[J]. Journal of Experimental Botany, 2000, 51:1309-1317.
[12] 王业社, 刘可慧.美人蕉(CannaindicaLinn)镉胁迫的抗氧化机理[J]. 生态学报, 2009, 29(5): 2710-2715.
Wang Y S, Liu K H. Stress responses and resistance mechanism ofCannaindicaLinn to cadmium[J]. Acta Ecologica Sinica, 2009, 29(5): 2710-2715.
[13] Pagliano C, Raviolo M, Vecchia F D, et al. Evidence for PSII donor-side damage and photoinhibition induced by cadmium treatment on rice (OryzasativaL.)[J]. Journal Photochemistry Photobiology B, 2006, 84: 70-78.
[14] Stobart A K, Griffiths W T, Ameenb-Bukhari I, et al. The effect of Cd2+on the biosynthesis of chlorophyll in leaves of barley[J]. Physiology Plantarum, 1985, 63: 293-298.
[15] 魏志琴, 陈志勇, 秦蓉, 等. Cu2+对拟南芥根的局部毒性及诱导DNA损伤、细胞死亡[J]. 植物学报, 2013, 48(3): 303-312.
Wei Z Q, Chen Z Y, Qin R, et al. Cu2+induced local toxicity and DNA damage, cell death in roots ofArabidopsisthaliana[J]. Chinese Bulletin of Botany, 2013,48(3):303-312.
[16] Goncalves J F, Becker A G, Cargelutti D, et al. Cadmium toxicity causes oxidative stress and induces response of the antioxidant system in cucumber seedlings[J]. Journal Plant Physiology,2007,19:156-163.
[17] Liu W, Li P J, Qi X M, et al. DNA changes in barley (Hordeumvulgare) seedlings induced by cadmium pollution using RAPD analysis[J]. Chemosphere,2005,61:158-167.
[18] 张旭红, 林爱军, 苏玉红,等.镉引起蚕豆(Viciafaba)叶片DNA损伤和细胞凋亡研究[J]. 环境科学, 2006, 27(4), 787-793.
Zhang X H, Lin A J, Su Y H, et al. DNA damages and apoptosis induced by Cd in the leaves of horsebeanViciafaba[J]. Environmental Science, 2006, 27(4), 787-793.
[19] Moura D J, Peres V F, Jacques R A, et al. Heavy metal toxicity: Oxidative stress parameters and DNA repair[C]∥Gupta D K, Sandalio L M. Metal toxicity in plants: Perception, signaling and remediation. Berlin: Springer-Verlag, 2012:187-205.
[20] Lequeux H, Hermans C, Lutts S, et al. Response to copper excess inArabidopsisthaliana: Impact on the root system architecture, hormone distribution, lignin accumulation and mineral profile[J]. Plant Physiology Biochemistry,2010,48:673-682.
[21] 王志坤, 廖柏寒, 黄运湘, 等. 镉胁迫对大豆幼苗生长影响及不同品种耐Cd差异性研究[J]. 农业环境科学学报, 2006, 25: 1143-1147.
Wang Z K, Liao B H, Huang Y X, et al. Effects of Cd on growth of Glycine max seedlings and Cd-tolerance differences of different varieties of Glycine max[J]. Journal of Agro-Environment Science, 2006, 25:1143-1147.
[23] Michalak A. Phenolic compounds and their antioxidant activity in plants growing under heavy metal stress[J]. Polish Journal Environmental Studies,2006,15:523-530.
[24] DIáZ J, Bernal A, Pomar F, et al. Induction of shikimate dehydrogenase and peroxidase in pepper (CapsicumannumL.) seedlings in response to copper stress and its relation to lignification[J]. Plant Science,2001,161:179-188.
[25] Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress[J]. Current Opinion in Plant Biology, 2002, 5: 218-223.
[26] Albert N W, Lewis D H, Zhang H B, et al. Light-induced vegetative anthocyanin pigmentation inPetunia[J]. Journal Experimental Botany, 2009, 60: 2191-2202.
[27] Lee D W, Gould K S. Why leaves turn red[J]. American Scientist, 2002, 90: 524-531.
[28] Mittler R, Vanderauwera S, Gollery M, et al. Reactive oxygen gene network of plants[J]. Trends in Plant Science, 2004, 9: 490-498.
[29] Hatier J H B, Gould K S. Anthocyanin function in vegetative organs[C]∥ Gould K. Anthocyanins. New York: Springer, 2009:1-19.
[30] Clemens S. Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants[J]. Biochimie, 2006, 88: 1707-1719.
[31] 张中春, 邱保胜. 植物螯合肽的转运与功能研究进展[J]. 植物生理学报, 2012, 48(5): 425-428.
Zhang Z C, Qiu B S. Research advances of phytochelatin transport and its function[J]. Plant Physiology Journal, 2012, 48(5): 425-428.
[32] Ebbs S, Lau I, Ahner B, et al. Phytochelatin synthesis is not responsible for Cd tolerance in the Zn/Cd hyperaccumulator Thlaspi caerulescens (J. & C. Presl)[J]. Planta, 2002, 214: 635-640.
[33] Cobbett C S. Phytochelatins and their roles in heavy metal detoxification[J]. Plant Physiology, 2000, 123: 825-832.
