高速逆流色谱法分离纯化丹参中丹酚酸B和迷迭香酸
2014-08-25,,,,
,, ,,
(浙江工业大学 药学院,浙江 杭州 310014)
丹参为唇形科植物SalviamiltiorrhizaBge.的干燥根,具有活血通经、祛瘀止痛、清心除烦的药效[1].丹参的化学成分主要为水溶性的丹酚酸类与脂溶性的丹参酮类.丹酚酸B具有强烈的抗氧化和清除氧自由基的活性[2-4],2010版中国药典将丹酚酸B作为丹参的指标成分[1].迷迭香酸是一种天然抗氧化剂,具有抗炎抗氧化等活性[5].在中药研究的过程中[6-7],制备高纯度的单体化合物对中药药效物质基础的深入研究具有十分重要的意义.高速逆流色谱(High-speed counter-current chromatography)作为一种新型液液分配色谱技术,使用液相作为载体,因此有效避免了固体载体吸附、样品损失等缺点.由于HSCCC具有制备量大、回收率高等优点,近年来广泛应用于中药活性成分的制备分离[8-10].研究应用HSCCC分离制备中药丹参中的丹酚酸B与迷迭香酸,以期为丹参有效成分的制备提供快速简便的方法.
1 仪器与材料
Agilent 1260高效液相色谱仪(美国Agilent公司),色谱柱为Phenomenex Gemini C18键合硅胶柱(250 mm×4.60 mm,5 μm);TBE-300A高速逆流色谱仪(上海同田生化技术有限公司);N2000色谱工作站(浙江大学智达信息工程有限公司);恒流泵(北京圣益通技术开发有限公司);紫外检测器(上海同田生化技术有限公司);恒温循环器(北京德天佑科技发展有限公司);旋转蒸发仪(瑞士BUCHI公司);Bruker AVANCE Ⅲ型磁共振波谱仪(TMS为内标,瑞士Bruker公司,500 MHz).
HSCCC分离用溶剂(正丁醇、乙酸乙酯等)为分析纯.HPLC用试剂甲醇、乙腈为色谱纯(美国Tedia).中药材丹参,购于药店,由楚楚博士鉴定为SalviamiltiorrhizaBge,留样保存于浙江工业大学药学院.
2 实验方法
2.1 HPLC分析条件
色谱柱Phenomenex Gemini C18柱(250 mm×4.60 mm,5 μm),流动相为V(甲醇)∶V(乙腈)∶V(甲酸)∶V(水)=30∶10∶1∶59;柱温30 ℃,体积流量0.5 mL/min,检测波长282 nm[1].
2.2 样品处理
2.2.1 提 取
丹参药材粉碎,过60目筛,称取粉末100 g以50%乙醇溶液为提取溶剂,料液比1∶10,加热回流提取3次,每次1 h,过滤,合并滤液并浓缩.
2.2.2 预纯化
将提取浓缩物用乙酸乙酯萃取,旋去溶剂.取乙酸乙酯萃取物10 g用AB-8大孔吸附树脂进行初步分离,上样后静置2~3 h,待树脂充分吸附后,用水洗脱至洗脱液无色,弃去,再分别用6 BV的10%乙醇,30%乙醇,40%乙醇,50%乙醇,60%乙醇,95%乙醇溶液进行梯度洗脱,体积流量3 BV/h,收集洗脱液,回收乙醇,干燥.用HPLC检测洗脱液,将含有目标成分的部分冷冻干燥,用于HSCCC进一步分离纯化.
2.2.3 HSCCC溶剂体系的选择
溶剂体系是HSCCC成功分离的关键.本研究通过测定丹酚酸B在不同溶剂体系中的分配系数K从而优选出合适的溶剂体系.具体操作:将不同溶剂按照一定比例配制,充分混匀,静置平衡后取经预纯化得到的粗品用2 mL上相与2 mL下相的混合液溶解,震荡静置分层后,分别各取10 μL上相、10 μL下相用HPLC进行测定,上相的峰面积记为A1,下相的峰面积记为A2,则分配系数K=A1/A2.
2.2.4 HSCCC分离制备
选择V(正己烷)∶V(乙酸乙酯)∶V(乙醇)∶V(水)=3∶7∶1∶9作为溶剂体系进行分离.将选好的溶剂体系按比例配制,充分混匀后在分液漏斗中静置分层,待两相平衡后,将两相分别放入棕色试剂瓶中,超声脱气20 min后,将固定相(上相)首先泵入HSCCC的分离管中,待上相将整个分离管充满后,开启主机,设定转速为800 r/min,待转速稳定后,将流动相(下相)以1.8 mL/min的体积流量泵入分离管.等到两相平衡后,称取经AB-8大孔吸附树脂吸附分离获得的粗品161 mg,用等体积的上相与下相各5 mL超声溶解,从进样口加入.紫外检测器波长设定为280 nm,利用自动收集器收集流出液.
2.3 单体化合物的鉴定及质量分数检测
采用1H NMR与13C NMR鉴定得到的化合物.用HPLC检测,面积归一化法确定其质量分数.
3 结果与讨论
3.1 提取物的预纯化
丹参提取液的乙酸乙酯萃取物,经过AB-8大孔吸附树脂吸附后,所含杂质减少,目标化合物得到有效初步分离,利于下一步HSCCCC的纯化(图1,2).

图1 乙酸乙酯萃取部分高效液相色谱图
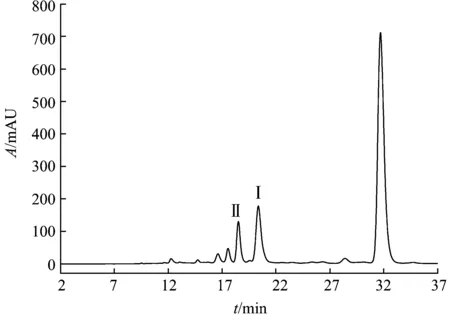
图2 大孔树脂洗脱部分高效液相色谱图
3.2 溶剂体系的选择
HSCCC进行样品分离的理想溶剂系统分配系数应在0.5~2.0之间[11].若分配系数过小,则样品保留时间太短,不能够达到有效分离;若分配系数过大,则保留时间过长,致使峰形变宽,整个分离过程延长.本实验采用HPLC测定样品在两相中的分配系数.根据丹酚酸B在不同溶剂体系中的K值,见表1,选择V(正己烷)∶V(乙酸乙酯)∶V(乙醇)∶V(水)=3∶7∶1∶9作为本研究的溶剂体系.

表1 丹酚酸B在不同溶剂体系中的分配系数
3.3 HSCCC分离
按照选定的溶剂体系进行HSCCC分离,工作站记录得到的色谱图见图3.按照色谱峰减压干燥得到化合物Ⅰ与Ⅱ.
3.4 产物鉴定及质量分数测定
用高效液相色谱仪检测其质量分数,面积归一法,测定化合物Ⅰ与Ⅱ的质量分数分别为98.4%和95.0%(图4).
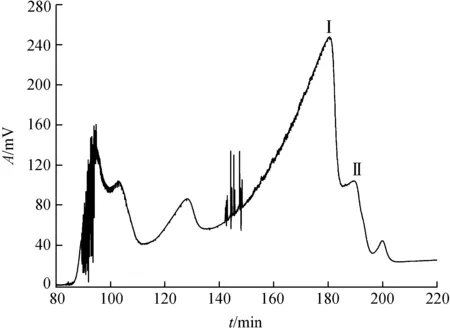
图3 HSCCC分离色谱图
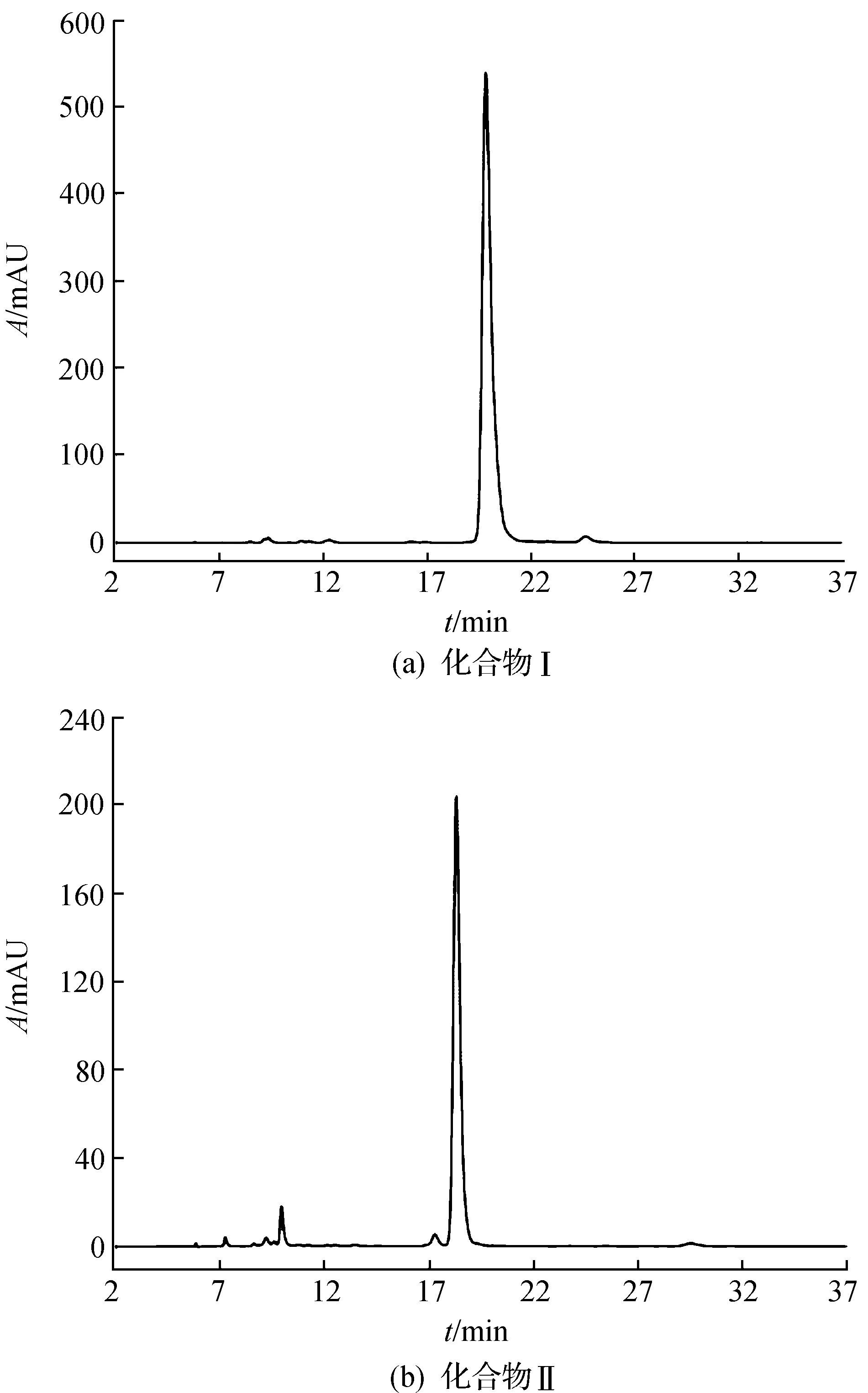
图4 化合物的高效液相色谱图
化合物Ⅰ,(CD3OD,500 MHz,δ)ppm:6.85(1H,d,J=8.4 Hz,H-5),7.17(1H,d,J=8.5 Hz,H-6),7.53(1H,d,J=15.9 Hz,H-7),6.22(1H,d,J=15.9 Hz,H-8),6.78(1H,d,J=2.0 Hz,H-2′),6.76(1H,d,J=3.5 Hz,H-5′),6.65~6.62(1H,m,H-6′),5.87(1H,d,J=4.8 Hz,H-7′),4.37(1H,d,J=4.8 Hz,H-8″),6.75(1H,d,J=2.7 Hz,H-2″),6.72(1H,d,J=8.0 Hz,H-5″),6.67(1H,dd,J=2.1,8.2 Hz,H-6″),2.84(1H,dd,J=9.6,14.3 Hz,H-7″a),3.03(2H,dd,J=4.5,14.3 Hz,H-7″b,H-7‴a),5.19(2H,dd,J=5.8,12.9 Hz,H-8″,H-8‴),6.53(1H,d,J=1.9 Hz,H-2‴),6.56(1H,d,J=8.0 Hz,H-5‴),6.35~6.30(1H,m,H-6‴),3.09(1H,dd,J=4.1,14.3 Hz,H-7‴b).13C NMR(CD3OD,125 MHz,δ)ppm:121.9(C-1),124.8(C-2),146.2(C-3),149.2(C-4),122.2(C-5),122.4(C-6),143.7(C-7),118.5(C-8),168.2(C-9),129.4(C-1′),117.7(C-2′),145.4(C-3′),145.2(C-4′),117.5(C-5′),126.5(C-6′),37.6(C-7′),74.9(C-8′),172.4(C-9′),133.8(C-1″),118.5(C-2″),118.5(C-3″),146.2(C-4″),146.1(C-5″),113.5(C-6″),88.4(C-7″),58.1(C-8″),172.4(C-9″),129.1(C-1‴),116.8(C-2‴),146.9(C-3‴),146.7(C-4‴),116.6(C-5‴),122.2(C-6‴),38.0(C-7‴),75.8(C-8‴),172.4(C-9‴).上述波谱数据与文献报道基本一致[12],可推测该化合物为丹酚酸B.
化合物Ⅱ,1H NMR(CD3OD,500 MHz,δ)ppm:7.06(1H,d,J=1.7 Hz,H-2),6.96(1H,dd,J=8.2,1.7 Hz,H-5),6.81~6.76(2H,m,H-6,2′),7.56(1H,d,J=15.9 Hz,H-7),6.28(1H,d,J=15.9 Hz,H-8),6.71(1H,d,J=8.0 Hz,H-5′),6.63(1H,br d,J=8.0 Hz,H-6′),3.14~2.96(2H,m,H-7′),5.18(1H,s,H-8′);13C NMR(CD3OD,125 MHz,δ)ppm:127.9(C-1),114.8(C-2),146.3(C-3),149.8(C-4),115.4(C-5),123.2(C-6),147.7(C-7),116.6(C-8),168.7(C-9),129.8(C-1′),117.7(C-2′),146.9(C-3′),145.3(C-4′),116.4(C-5′),121.9(C-6′),38.2(C-7),75.7(C-8′),168.7(C-9′).上述波谱数据与文献报道基本一致[13],可推测该化合物为迷迭香酸.
4 结 论
本研究选用V(正己烷)∶V(乙酸乙酯)∶V(乙醇)∶V(水)=3∶7∶1∶9作为溶剂体系进行HSCCC分离制备丹参中的丹酚酸B与迷迭香酸,丹参药材经过萃取、大孔吸附树脂吸附,除去部分杂质,使得目标化合物得到初步分离,然后将161 mg粗品应用制备型HSCCC分离得到丹酚酸B 52.3 mg和迷迭香酸14.5 mg,质量分数分别达到98%与95%以上.结果表明:与直接利用丹参提取物进行HSCCC分离相比,本方法能够避免因提取物中存在杂质过多致使分离制备得到的样品质量分数不高的缺点,为丹参有效成分的进一步开发利用奠定了基础.
参考文献:
[1] 中华人民共和国药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010.
[2] 高枫,孙桂波,任小宇,等.丹酚酸B对大鼠离体心脏缺血再灌注损伤的保护作用[J].中国中药杂志,2012,37(3):358-361.
[3] 石少明,李泽慧,田书林,等.丹酚酸B对脑缺血再灌注损伤大鼠纹状体氨基酸类神经递质的影响[J].北京中医药大学学报,2012,35(8):535-538.
[4] 马丙祥,董宠凯.丹参的药理作用研究新进展[J].中国药房,2014,25(7):663-665.
[5] 张玉杰,徐文清,沈秀.迷迭香酸的提取分离及药理学新发现[J].中国新药杂志,2013,22(4):433-437.
[6] 李行诺,马旭,楚楚,等.泽泻指纹图谱研究[J].浙江工业大学学报,2013,41(2):143-146.
[7] 颜继忠,雷伟,李行诺,等.桑叶中降血糖组分1-脱氧野尻霉素的富集与纯化研究[J].浙江工业大学学报,2013,41(3):241-243.
[8] 秦鸿儒.高速逆流色谱法分离砂地柏球果中有效组分的研究[D].杭州:浙江大学,2013.
[9] TONG Sheng-qiang, SHENG Liu-qing, YAN Ji-zhong, et al. Preparative separation of phenylpropanoid glycoside from scrophularia ningpoensis hemsley by high speed countercurrent chromatography and ESI-MSnanalysis[J]. Journal of Liquid Chromatography Related Technologies,2009,32:2311-2333.
[10] 钱俊青,张江柳,张铮.高速逆流色谱法分离大豆异黄酮中的大豆苷和染料木苷[J].浙江工业大学学报,2012,40(5):493-496.
[11] ITO Y. Golden rules and pitfalls in selecting optimum conditions for high-speed counter- current chromatography[J]. Jouornal of Chromatography A,2005,1065(2):145-168.
[12] 谢婷婷.白花丹参的化学成分研究[D].济南:山东大学,2010.
[13] 吴志军,欧阳明安,杨崇仁,等.苣叶丹参的多酚类化合物[J].云南植物研究,1999,21(3):393-398.
