漆酶催化转化溴酚类化合物的动力学研究
2014-08-25,
,
(浙江工业大学 生物与环境工程学院,浙江 杭州 310014)
目前,世界范围内溴酚类化合物的使用、工业废水的排放等方式,都导致环境中溴酚类物质逐渐增加.在工业中,2,4-二溴酚(2,4-DBP)是环氧聚合物的中间体.很多海产养殖饲料添加溴酚增加海鲜的特殊风味[1-2].2,4,6-三溴酚(2,4,6-TBP)常用作木材防腐剂.很多海洋藻类中也发现了简单的溴酚化合物的存在.溴酚在藻类体内可以生物合成[3].海洋中的溴酚类有机化合物主要来源于海洋藻类次生代谢产物[4],如肠鳃纲囊舌虫体内可以产生并释放大量溴酚[5].漆酶是一种结合多个铜离子的蛋白质,属于铜蓝氧化酶,存在于多种菇、菌及植物中,亦可存活于空气中.大多数漆酶属于单体酶[6].漆酶大多见于植物[7](如漆树、1 000多种藻类[8])、真菌[9]、细菌、动物体[10]中.Bacillus sphaericus[11]等产漆酶的细菌不断地被发现[12].真菌漆酶的催化氧化性能强于植物漆酶[13].漆酶不仅可以降解有机物[14],还可能将有机物转化成较大分子的有机物.漆酶能氧化苯酚类化合物产生自由基,进而引发自由基耦合反应[15].酚类化合物的电势电位为0.5~0.8 V,故漆酶可以催化氧化酚类化合物[16].漆酶催化转化环境中存在的苯酚、苯胺以及其他有机污染物需要氧气的存在.漆酶催化转化酚类化合物的反应主要包括漆酶催化氧化底物产生活性自由基和氧气还原成水两部分[17],漆酶催化氧化酚类化合物产生的自由基很活泼,易引发一系列的后续反应,如聚合反应、解聚反应、水解反应以及歧化反应等[15].还有研究认为,漆酶催化酚类化合物产生半醌自由基,半醌自由基发生歧化反应、互变异构化等形成苯醌或其他有机物[15,18].
本研究主要以4-溴酚(4-BP),2,4-DBP和2,4,6-TBP等为模型化合物,研究漆酶对溴酚的催化转化反应动力学、pH和温度对反应的影响.
1 实验部分
1.1 实验材料
漆酶,2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS),4-BP,2,4-DBP,2,4,6-TBP购于美国Sigma Aldrich公司.4-BP,2,4-DBP,2,4,6-TBP做储备液,色谱纯甲醇做溶剂;实验药品及试剂使用前于4 ℃冰箱冷藏.
1.2 漆酶活性测定
采用ABTS法测定不同pH、不同温度条件下漆酶的活性.用10 mmol/L磷酸缓冲溶液分别配制pH 5.0,6.0,7.0,8.0的0.01 mmol/L的ABTS溶液,加入一定量漆酶,使体系中漆酶质量浓度为0.073 5 g/L,开始反应,测定反应溶液吸光度变化.在pH 7.0条件下,控制反应体系温度分别为15,25,35,45 ℃,测定反应溶液吸光度的变化.
1.3 反应动力学实验
于反应瓶中加入60 mL磷酸盐缓冲溶液,加入一定量的溴酚底物,混匀,添加一定量的漆酶开始反应,不同时间取样.取反应液0.5 mL,加入0.5 mL乙腈淬灭反应.用高效液相色谱-紫外分光光度法(HPLC-UV)分析样品中溴酚残留量.
1.4 pH影响实验
25 ℃条件下,分别在60 mL pH 5.0,6.0,7.0,8.0磷酸盐缓冲溶液中加一定量的溴酚底物,混匀,添加一定量的漆酶开始反应,不同时间取样.样品预处理和分析同上.
1.5 温度影响实验
控制反应体系温度分别为15,25,35,45 ℃,向pH 7.0磷酸盐缓冲溶液中加一定量的溴酚底物,混匀,添加一定量的漆酶开始反应,不同时间取样.样品预处理和分析同上.
2 结果与讨论
2.1 初始浓度对漆酶催化转化溴酚化合物的影响
漆酶催化溴酚转化产生自由基,自由基进而发生聚合反应、解聚反应等后续反应,完成转化过程[15,17].由图1可见:在常温下,pH 7.0缓冲体系中,三种溴酚都可以被漆酶催化转化.在12 h反应过程中,随着反应的进行,溴酚不断减少.不同浓度漆酶催化转化溴酚反应的反应动力学方程为Ct=5×10-6e-kt,符合假一级反应动力学(Ct=C0e-kt);拟合直线的斜率为假一级反应动力学常数k,k的值因漆酶初始浓度不同而不同.另外,随着漆酶浓度的增大,三种溴酚的转化速率常数也呈线性增大(图2),可见反应体系中溴酚的浓度足够大,使得该催化转化反应的速率与漆酶的浓度成正比关系.漆酶催化转化4-BP,2,4-DBP和2,4,6-TBP的反应速率常数分别为0.119 7,0.272 4,0.195 5 mL/(U·h).因此,漆酶催化转化2,4-DBP的速率最快,4-BP稍慢.三者的转化速率皆比漆酶催化转化四溴双酚A(k=0.39 mL/(U·h))和乙酰氨基酚(k=0.024 mL/(U·min))慢[19-20].

图1 不同漆酶浓度下漆酶催化转化溴酚动力学

图2 反应动力学常数与不同漆酶浓度的关系
2.2 pH的影响
pH可以影响漆酶的活性,从而影响漆酶催化转化溴酚的反应.图3为pH对漆酶催化转化溴酚的影响,由图3可见漆酶催化转化溴酚的反应在酸性或碱性条件下皆表现为假一级反应.表1结果表明:漆酶能在较大的pH范围内保持相对较高的活性,但在酸性条件下活性相对较高.漆酶催化转化溴酚的反应在酸性条件下反应更快.4-BP,2,4-DBP和2,4,6-TBP皆在pH 5.0表现出最大反应速率.2,4,6-TBP在酸性条件下比4-BP和2,4-DBP转化更快,在中性和碱性条件下结果相反.这可能由于pH不仅影响漆酶活性,还影响溴酚在反应溶液中的存在形态,影响程度略有差异[19,21].底物与辅酶的结合受其解离程度影响,底物与辅酶的解离受活性中心的必需基团和催化基团的离子状态有关.4-BP,2,4-DBP和2,4,6-TBP的pKa值分别为9.17,7.79和6.08.当溶液pH从8.0变到5.0时,解离态的4-BP,2,4-DBP和2,4,6-TBP逐渐转变为未解离的溴酚分子,反应速率加快,由此可推测溴酚分子更容易被漆酶催化转化.当pH升至8.0时,漆酶活性下降明显,溴酚的转化速率也随之下降.

图3 pH对漆酶催化转化溴酚的影响
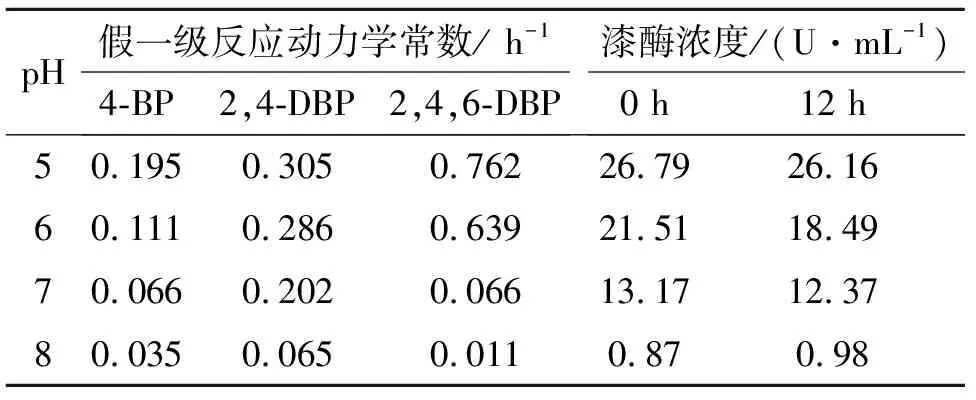
表1 不同pH条件下漆酶催化转化溴酚的假一级反应速率常数及漆酶活性的变化
2.3 温度的影响
在不同温度条件下,漆酶催化转化溴酚的反应遵循假一级反应动力学.由图4和表2可见:在中性溶液且温度较低时,漆酶的活性稳定,可以较高效率地催化转化溴酚.在不同温度条件下,2,4-DBP反应速率最快,2,4,6-TBP次之,4-BP最慢.在pH 7.0且温度为15~45 ℃时,随着温度的升高,漆酶的活性逐渐升高,后出现下降趋势.在低温条件下,活化的漆酶分子相对较少,酶促反应速率降低.温度升高,活化的漆酶分子增多,反应速率升高,当温度升高到一定值,酶蛋白出现热变性现象,随着温度继续升高,热变性作用变成主要因素,反应速率下降.我们实验结果也表明,漆酶的活性在35 ℃达到最大值19.17 U/mL,45 ℃时活性下降.35 ℃和45 ℃时溴酚催化转化速率接近.三种溴酚转化有所差异,并未都在35 ℃时达到最大值.45 ℃时,2,4-DBP和2,4,6-TBP的转化速率趋近于最大值,而4-BP还有继续升高的趋势.这主要是因为温度不仅影响漆酶的活性,还影响反应的活化能.可能是由于漆酶催化转化三种溴酚的活化能不同,受温度的影响有所差异.

图4 温度对漆酶催化转化溴酚反应的影响

表2 不同温度下漆酶催化转化溴酚假一级反应速率常数及漆酶活性变化

表3 漆酶催化转化溴酚反应的活化能
2.4 漆酶催化溴酚转化反应的活化能
由表3数据(-lnk)和(1/T×103),根据阿雷尼乌斯方程lnk=lnA-(Ea/RT)得出pH 7.0的条件下漆酶催化转化溴酚反应的活化能.4-BP,2,4-DBP和2,4,6-TBP反应的活化能分别为37.07,19.18,24.00 kJ/mol.大多漆酶酶促反应的活化能范围在30~60 kJ/mol之间[22].反应活化能低的反应更容易发生,反应速率更快.当反应的活化能稍低于100 kJ/mol时,较少的能量即可以使反应进行[23].因此,漆酶催化转化4-BP,2,4-DBP和2,4,6-TBP在常温下均可进行.
3 结 论
在不同pH和不同温度条件下,漆酶催化转化4-BP,2,4-DBP和2,4,6-TBP的反应皆遵循假一级反应动力学.pH影响漆酶活性的同时影响反应速率.在偏酸性条件下,漆酶活性明显较高,催化转化溴酚的速率明显高于偏碱性条件.2,4-DBP转化反应活化能最低,反应最快,4-BP反应活化能最大,反应最慢,2,4,6-TBP介于二者之间.
参考文献:
[1] BOYLE J L, LINDSAY R C, STUIBER D A. Contributions of bromophenols to marine-associated flavors of fish and seafood[J]. Journal of Aquatic Food Product Technology,1992,1:43-53.
[2] WHITFIELD F B, HELIDONIOTIS F, DREW M. Effect of diet and environment on the volatile flavour components of crustaceans[M]. Australia:Fisheries Research and Development Corporation,1997.
[3] FLODIN C, WHITFIELD F B. Biosynthesis of bromophenols in marine algae[J]. Water Science and Technology,1999,40:53-58.
[4] CHUNG H Y, MA W C J, ANG P O, et al. Seasonal variations of bromophenols inBrownAlgae(Padina arborescens,Sargassumsiliquastrum,andLobophoravariegata) Collected in Hong Kong[J]. Journal of Agricultural and Food Chemistry,2003,51(9):2619-2624.
[5] HIGA T, FUJIYAMA T, SCHEUER P J. Halogenated phenol and indole constituents ofAcornworms[J]. Comparative Biochemistry and Physiology,1980,65(3):525-530.
[6] 万云祥,杜予民.漆酶结构与催化机理[J].化学通报,2007,70(9):662-670.
[7] LIM K T, HU C, KITTS D D. Antioxidant activity of aRhusvernicifluaStokes ethanol extract[J]. Food and Chemical Toxicology,2001,39(3):229-237.
[8] BALDRIAN P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews,2005,30(2):215-242.
[9] BONOMO R P, BOUDET A W, COZZOLINO R, et al.A comparative study of two isoforms of laccase secreted by the “white-rot” fungusRigidoporuslignosus, exhibiting significant structural and functional differencese[J].Journal of Inorganic Biochemistry,1998,71(3/4):205-211.
[10] DIAMANTIDIS G, EFFOSSE A, POTIER P, et al.Purification and characterization of the first bacterial laccase in the rhizospheric bacteriumAzospirillumlipoferum[J].Soil Biology and Biochemistry,2000,32(7):919-927.
[11] CLAUS H, FILIP Z.The evidence of a laccase-like enzyme activity in aBacillussphaericusstrain[J].Microbiological Research,1997,152(2):209-216.
[12] ENGUITA F J, MARTINS L O, HENRIQUES A O, et al.Crystal structure of a bacterial endospore coat component-a laccase with enhanced thermostability properties[J].The Journal of Biological Chemistry,2003,278(21):19416-19425.
[13] 姜标,徐向亚,李祖义.用于生物氧化的蓝色漆酶[J].有机化学,2008,28(10):1715-1723.
[14] BARON C P, BφRRESEN T, JACOBSEN C.Comparison of methods to reduce dioxin and polychlorinated biphenyls contents in fishmeal:extraction and enzymatic treatments[J].Journal of Agricultural and Food Chemistry,2007, 55(4):1620-1626.
[15] EGGERT C, TEMP U, ERIKSSON K E L.The ligninolytic system of the white rot fungusPycnoporuscinnabarinus:Purification and characterization of the laccase[J].Applied and Environmental Microbiology, 1996, 62 (4):1151-1158.
[16] YAVER D S, XU F, GOLIGHTLY E J, et a1.Purification, characterization, molecular cloning, and expression of two laccase genes from the white rot basidiomyceteTrametesvillosa[J].Applied and Environmental Microbiology, 1996, 62(3):834-841.
[17] RIVA S.Laccases:blue enzymes for green chemistry[J].Trends in Biotechnology,2006,24(5):219-226.
[18] HAKULINEN N, KIISKINEN L L, KRUUS K, et a1.Crystal structure of a laccase fromMelanocarpusalbomyceswith an intact trinuclear copper site[J].Nature Structural Biology,2002, 9(8):601-605.
[19] FENG Y P, COLOSI L M, GAO S X.Transformation and removal of tetrabromobisphenol A from water in the presence of natural organic matter via laccase-catalyzed reactions:Reaction rates, products, and pathways[J].Environmental Science and Technology,2013,47(2):1001-1008.
[20] LU J, HUANG Q, MAO L.Removal of acetaminophen using enzyme-mediated oxidative coupling processes:I.Reaction rates and pathways[J].Environmental Science and Technology,2009, 43:7062-7067.
[21] AURIOL M, FILALI-MEKNASSI Y, TYAGI R D, et al.Laccase-catalyzed conversion of natural and synthetic hormones from a municipal wastewater[J].Water Research,2007,41:3281-3288.
[22] AKTAS N, TANYOLAC A.Reaction conditions for laccase catalyzed polymerisation of catechol[J].Bioresource Technology,2003,87(3):209-214.
[23] 陈辉,张剑波,王维敬,等.固定化漆酶催化去除水中2,4-二氯苯酚[J].北京大学学报,2006,42(4):484-489.
