平衡透析法测定具栖冬青苷和毛冬青酸的大鼠血浆蛋白结合率
2014-08-20赵文珠居文政孙冰婷臧雨馨谈恒山南京中医药大学药学院南京20029南京中医药大学附属医院临床药理科南京20029南京军区总医院南京20002
赵文珠,居文政,孙冰婷,臧雨馨,谈恒山(.南京中医药大学药学院,南京 20029; 2.南京中医药大学附属医院临床药理科,南京 20029;.南京军区总医院,南京 20002)
具栖冬青苷和毛冬青酸是从毛冬青干燥根中提取出的活性成分[1]。毛冬青酸具有抗血栓作用,一方面能增加血浆优球蛋白的溶解活性及血小板内环腺苷酸的含量,另一方面能抑制由二磷酸腺苷和胶原诱导产生的血小板聚集。在临床上,血小板聚集率升高、血液黏度增加均会加速冠心病的发生和发展[2]。此外,毛冬青酸不仅是毛冬青的主要成分,也是毛冬青皂苷类成分在体内的主要代谢产物。药物血浆蛋白结合率直接影响药物进入体内后的分布、代谢及排泄速率,因此,其是与药物药效及药理作用密切相关的一项药代动力学参数。因此,研究药物血浆蛋白结合率具有重要意义。有关具栖冬青苷和毛冬青酸血浆蛋白结合率的研究,尚未见文献报道。文中以平衡透析法研究具栖冬青苷和毛冬青酸在大鼠体外血浆中的蛋白结合率,为毛冬青在临床联合用药提供参考。
1 仪器与材料
1.1仪器 Agilent 1100,配脱气机、G1311A四元泵、G1314A自动进样器、G1316A柱温箱和G1314A检测器,Chemstation色谱工作站;Micro-17R冷冻离心机(美国Thermo公司);Mettler AE240电子天平(上海梅特勒-托利多有限公司);Direct-Q5超纯水机(法国Millipore公司);WH-2微型旋涡混合仪(上海市沪西分析仪器厂);透析袋(14000D,压平宽度25 mm,美国联合碳化)。
1.2试药 具栖冬青苷(成都艾科达化学试剂有限公司,质量分数>98%);毛冬青酸(成都普菲德生物技术有限公司,质量分数>98%);肉桂酸(中国药品生物制品检定所,质量分数>98%);甲醇为色谱纯;其他试剂均为分析纯。
1.3动物 SD大鼠,180~220 g,雌雄各半,由南京中医药大学动物实验中心提供。合格证号:SCXK(苏)2009-0001。
2 样品检测方法的考察
2.1对照品溶液的配制 精密称取具栖冬青苷和毛冬青酸对照品适量,加甲醇定容,摇匀,分别制成每1 mL含具栖冬青苷3.08 mg、含毛冬青酸3.15 mg的对照品储备液,备用。
2.2色谱条件 色谱柱:Agilent Zorbax SB-C18(150 mm×4.6 mm,5 μm);流动相:甲醇-1.0 mL·L-1磷酸(65∶35);流速:1.0 mL·min-1;柱温:40 ℃;检测波长:215 nm;进样量:20 μL。
2.3生物样品(血浆或透析液)预处理 精密吸取100 μL血浆或透析液样品,加入10 μL 3.776 mg·L-1肉桂酸溶液(内标),涡旋30 s,再加入800 μL乙酸乙酯,涡旋3 min,离心10 min(12 000 r·min-1)。取750 μL上清液,氮气流吹干(40 ℃)。加体积分数75%甲醇100 μL复溶,离心5 min(12 000 r·min-1),取20 μL上清液,进样分析。
2.4方法的专属性 在本色谱条件下,肉桂酸、具栖冬青苷和毛冬青酸的Rt分别为2.91,4.40和11.84 min,内源性物质及其他成分对测定无干扰,见图 1。

图1 HPLC图
2.5线性关系
2.5.1血浆样品标准曲线 取适量具栖冬青苷、毛冬青酸储备溶液,用体积分数75%甲醇稀释,配制成6个不同质量浓度的对照品混合溶液,取空白血浆6份,每份100 μL,分别加10 μL混合对照品溶液,按2.3项下的方法对样品进行处理,精密取20 μL进样。以质量浓度为横坐标、各成分峰面积与内标峰面积的比值为纵坐标,进行线性回归,得标准曲线方程见表1。
2.5.2透析液样品标准曲线 按照血浆样品标准曲线中混合对照品溶液的配制方法,配制成6个不同质量浓度的混合对照品溶液,取空白缓冲液(pH7.4)6份,每份100 μL,分别加入10 μL混合对照品溶液,按2.3项下的方法对样品进行处理,精密取20 μL进样。以质量浓度为横坐标、各成分峰面积与内标峰面积的比值为纵坐标,进行线性回归,得标准曲线方程见表1。
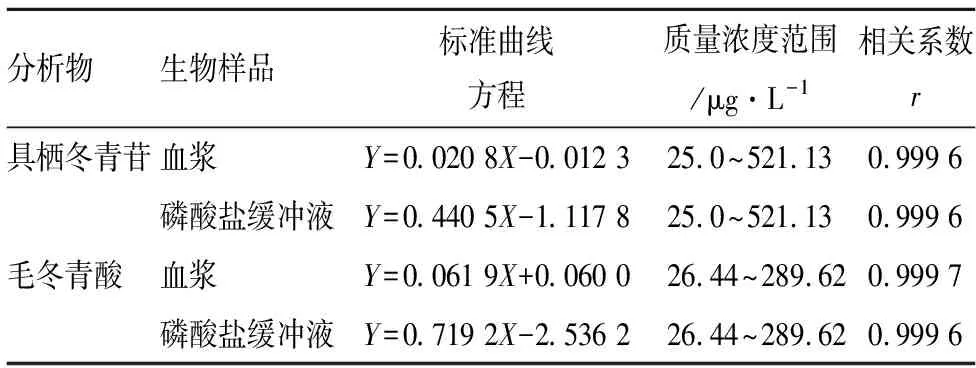
表1 具栖冬青苷和毛冬青酸的标准曲线
2.6精密度、准确度、提取回收率 按2.5项中配制血浆样品、透析液样品的方法,配制高、中、低3种质量浓度的质控样品。按照各样品的处理方法进行操作,考察其精密度和准确度。
空白血浆和空白透析液各取100 μL,按标准曲线制备方法,配制成3种不同质量浓度的血浆样品和透析液样品,分别含具栖冬青苷51.15,153.46和251.17 μg·L-1及毛冬青酸51.15,153.33和264.38 μg·L-1。按样品处理项下进行操作,精密取20 μL进样分析;另外各取10 μL 3个不同质量浓度的混合对照品溶液,分别加入10 μL肉桂酸溶液(内标),氮气流吹干(40 ℃),加体积分数75%甲醇100 μL复溶,离心5 min(12 000 r·min-1),取20 μL上清液,进样分析,计算提取回收率,结果见表 2。

表2 具栖冬青苷和毛冬青酸的准确度、精密度和提取回收率
2.7稳定性 2.5项下质控样品于室温条件保存,分别在0,4,8,12和24 h取样,同时取4 ℃冷藏保存0,1,2和3 d的质控样品,按各生物样品处理方法进行操作, HPLC分析其稳定性。按当日所得的标准曲线计算,结果显示,各个质量浓度样品RSD<4%,说明样品于室温保存24 h内和4 ℃冷藏保存3 d均稳定。
3 药物血浆蛋白结合的实验方法与评价
3.1PBS溶液的配制[3]精密称取K2HPO4·3H2O 18.37 g、KCl 11.18 g、KH2PO42.74 g,溶于1 L超纯水,所得PBS溶液的pH为7.4。
3.2实验方法[4]取管状透析袋,进行预处理,然后用棉线结扎一端,精密移取大鼠空白血浆(眼眶取血)1 mL于袋内,系牢另一端,袋内始终保留一定空气,透析袋悬浮于盛有10 mL PBS缓冲液的平底玻璃管中,PBS缓冲液中加入适量对照品,配制成3种不同质量浓度的溶液,分别含具栖冬青苷、毛冬青酸,最后封口膜封紧瓶口,置于4 ℃冰箱中平衡。定时搅拌溶液,加速平衡。待溶液平衡72 h,精密移取血浆样品、PBS缓冲液各100 μL,按照样品处理项下操作,分别测定透析袋内外具栖冬青苷和毛冬青酸的质量浓度,计算血浆蛋白结合率。
3.3透析膜吸附考察 将透析袋内、外分别加入空白PBS缓冲液1 mL( 设体积为V1)和已知药物质量浓度CA的PBS 缓冲液10 mL( 设体积为V2), 待透析袋内外游离型药物质量浓度相等即达到平衡状态,测定此时透析袋外药物浓度CE[5],按下列公式计算透析膜对药物的吸附率X(数据见表3)。由表3可知,透析膜对药物有微量的吸附,且吸附作用与剂量无依赖性。

表3 具栖冬青苷和毛冬青酸对透析膜的吸附率
3.4平衡时间的考察 在透析袋内以磷酸盐缓冲液代替血浆,按3.2方法操作,分别于12,24,36,48和72 h取样,测定透析袋内外药物浓度。结果见表 4,表明具栖冬青苷和毛冬青酸透析达到平衡时间约需72 h。

表4 具栖冬青苷和毛冬青酸在透析袋内外达到平衡的时间
3.5血浆蛋白结合率 血浆蛋白结合率=(袋内血浆中药物的质量浓度-袋外PBS溶液中药物的质量浓度)/袋内血浆中药物的质量浓度×100%。采用上述公式,对具栖冬青苷、毛冬青酸血浆蛋白结合率进行计算,结果见表5。

表5 具栖冬青苷和毛冬青酸的大鼠血浆蛋白结合率
4 讨论
研究药物与血浆蛋白结合有各种实验方法,一般常用的有平衡透析法、超速离心法、超滤法和透析法等[6-7],其中平衡透析法是一种最常用的经典方法。本文采用平衡透析法测定具栖冬青苷和毛冬青酸在大鼠体外血浆中的蛋白结合率,方法简单易行。
实验依次考察了生物样品中蛋白的去除方法,包括甲醇、乙腈沉淀法和乙酸乙酯萃取法,同时对乙酸乙酯的用量也进行了考察,结果表明,乙酸乙酯萃取时不仅干扰少,而且提取回收率比较高。此外,通过比较不同内标(替硝唑、人参皂苷Rb1、黄芪皂苷等),发现同等实验条件下,肉桂酸灵敏度高、提取回收率高、稳定。
采用平衡透析法时,一般可选择37 ℃或4 ℃作为测定的平衡温度。参考文献[8],实验选择4 ℃为平衡温度。
实验结果显示,具栖冬青苷和毛冬青酸在大鼠体外血浆的蛋白结合率范围是35%~65%,属于中等结合型,且在实验质量浓度范围内,蛋白结合率与PBS溶液中药物质量浓度无关。药物进入体内后就会与血浆蛋白结合,不同的药物结合率不同。血浆蛋白结合率越高的药物,在临床相互用药时发生不良反应的可能性就会越大。因此,研究药物的蛋白结合率,对临床联合用药具有重要意义。
参考文献:
[1] 蔡雄,刘中秋,祝晨蔯,等.毛冬青化学成分、药理作用及临床应用研究进展[J].广东药学,2001,11(1): 4-6.
[2] 靳荣光,王秋娟,刘继平,等.红景天苷治疗冠心病相关药理作用研究进展[J].西北药学杂志,2013,28(2): 213-215.
[3] 景春杰,陈晓辉,刘璇,等.丹酚酸B与大鼠血浆蛋白结合率的测定[J].药学学报,2010,45(3): 343-346.
[4] 卢来春,蒋学华,杨俊毅,等.阿莫西林对格列美脲血浆蛋白结合率的影响[J].华西药学杂志,2003,18(4): 246-250.
[5] 刘颖,陈志强,陶蓓蕾,等.蟾毒灵血浆蛋白结合率的测定[J].中国中药杂志,2009,34(21): 2817-2820.
[6] Bertucci C, Domenici E. Reversible and covalent binding of drugs to human serum albumin: methodological approaches and physiological relevance[J].Curr Med Chem, 2002, 9(15): 1463-1481.
[7] 周大炜,李乐道,李发美.药物-蛋白结合作用的分析方法研究[J].色谱,2004,22(2): 116-120.
[8] 林朝展,蔡昭喜,桂浩凌,等.高效液相色谱法测定毛冬青酸在大鼠体内的血药浓度[J].广州中医药大学学报,2010,27(5): 503-506.
