电针对局灶脑缺血/再灌注模型大鼠缺血海马区血管再生的影响及其机制
2014-08-15谢宸宸罗勇高祥庞月珊李满汶海琪陈瑞芳
谢宸宸,罗勇,高祥,庞月珊,李满,汶海琪,陈瑞芳
(1.重庆医科大学附属第一医院神经内科 重庆市神经病学重点实验室,重庆 400016;
2.成都铁路分局医院肾内科, 成都 610081)
缺血性脑血管病是临床常见病,具有高死亡率、高致残率。针刺作为祖国的传统医学,用于治疗缺血性脑血管病已有数千年历史,并已得到广泛推广和认可。针刺可从多种途径治疗和改善缺血性脑血管病的病症,其中改善脑血流循环,增加脑血流量、改善半暗带供血、促进血管再生等是治疗和预后的关键途径[1]。而近年内皮祖细胞(endothelial progenitor cells,EPCs)在缺血组织血管再生中的作用受到广泛关注[3]。EPCs主要存在于骨髓[2],基质细胞衍生因子-1α(stromal cell derived factor-1α,SDF-1α)及其受体CXCR4可有效动员骨髓EPCs至外周血参与缺血组织的血管再生[4]。研究发现,电针可上调脑缺血皮质区SDF-1α/CXCR4的表达而促进血管再生[5],但此作用是否与电针促进EPCs归巢相关并不明确。故本研究通过观察局灶脑缺血/再灌注后电针及CXCR4特异性拮抗剂AMD3100作用下海马SDF-1α/CXCR4的表达变化及EPCs源性血管形成的情况,以期深入探讨电针促进局灶脑缺血/再灌注后脑内血管再生的机制。
1 材料与方法
1.1 实验动物与分组
SPF级成年雄性SD大鼠180只,体重(250±20)g,由重庆医科大学动物中心【SCXK(渝)2012-0002】提供。重庆医科大学附属第一医院实验研究中心【SYXK(渝)2010-0002】提供实验操作平台,并按实验动物使用的3R原则给予人道的关怀。大鼠随机分为假手术组(Sham组)、模型组(I/R组)、电针组(I/RE组)、CXCR4特异性拮抗剂AMD3100药物组(I/RA组)、AMD3100+电针组(I/REA组)五组,每组36只。根据局灶脑缺血2 h再灌注后观察的时间点,各组分为1 d、3 d、7 d 三个时相点,每个亚组12只。
1.2 主要试剂及仪器
兔抗大鼠VEGFR2抗体(Cell Signal Technology公司,美国)、藻红蛋白(PE)标记小鼠抗大鼠CD34抗体(Santa Cruz Biotechnology公司,美国)、异硫氰酸荧光素(FITC)标记羊抗兔二抗(北京鼎国生物有限公司,中国)、RNA提取试剂盒和逆转录试剂盒等PCR相关试剂(Takara公司,日本)。SDF-1α、CXCR4引物由上海生物生工有限公司合成。G6805型电针治疗仪购自北京精工仪器厂。
1.3 动物模型制备
根据Longa等[6]报道的方法,结合以往实验[7,8]及本课题组罗勇等[9]报道的经验方法,线栓法规范化制备右侧大脑中动脉梗塞/再灌注模型(middle cerebral artery occlusion/reperfusion,MCAO/R)。大鼠术前禁食一晚,不禁饮。用10%水合氯醛(1 mL/100 g)腹腔麻醉大鼠后仰卧位固定、消毒、做颈部正中切口,暴露大鼠右侧颈总动脉(CCA),分离颈外动脉(ECA)、颈内动脉(ICA)颅外段,分离ECA、ICA交通支后结扎ECA远端,将ECA残端下拉与ICA成直线,在其ECA残端剪一小口,将事先做好的直径约0.25~0.27 mm线栓插入ECA,经CCA分叉处进入ICA离分叉处约18~20 mm,遇阻力即表明线栓头端已进入大脑中动脉起始处,将线栓固定于ECA。清理手术野,缝合皮肤。缺血2 h后剪开缝合线,暴露手术视野,拔出线栓至ECA残端,实现再灌注,再次缝合皮肤。假手术组线栓只插入颈内动脉10 mm,不阻断大脑中动脉。整个实验过程中大鼠置于37℃恒温台。实验中尽可能避免造模外因素对实验结果的影响。大鼠清醒后按照Longa方法[7]评分:0分:无神经功能缺失症状;1分:轻度局灶神经功能缺失(不能完全伸展左侧前肢);2分:中度局灶神经功能缺失(向左侧转圈);3分:重度神经功能缺失(向左侧倾斜);4分:不能自发行走,意识水平降低。评分为2~3分者视为造模成功,入选实验。凡因各种原因导致各实验组动物数不足预定数量者,均通过随机抽样原则补齐实验动物。
1.4 电针及药物AMD3100干预方法
根据中国针灸学会实验针灸委员会制定的动物穴位图谱,选取大鼠“百会”穴(GV 20)及左侧“四关”穴(合谷LI 4/太冲LR 3)为电针穴位;利用华佗牌不锈钢银针(直径为0.38 mm,长度为1寸)取“百会”穴斜刺入头皮1 mm,直刺“合谷”穴及“太冲”穴2 mm,针刺“百会”穴及“四关”穴通电刺激,“百会”穴连接电针方式:一侧电极接通“百会”穴位上的针灸针,与“百会”穴形成环路的另外一电极包湿纱布,固定于动物右侧后肢。电针治疗仪采用频率为2/20 Hz,波型为疏密波,刺激时间为30 min,强度以大鼠肢体轻度颤动为度,I/RE组及I/REA组大鼠各时相点每天电针一次,直至取材。另外对I/RA及I/REA组皮下注射CXCR4特异性拮抗剂AMD3100每次 1.25 mg/kg,每日2次。
1.5 检测指标和方法
1.5.1 逆转录聚合酶链反应(RT-PCR)
提取各组大鼠缺血区海马总RNA,通过琼脂糖凝胶电泳检测RNA的完整性,测定RNA的纯度和浓度,并调浓度一致。根据PubMed上GenBack 提供的基因序列,引物由上海生工生物工程技术服务有限公司合成。SDF-1α上游引物:5’-CATCAGTGACGGTAAGCCAGT-3’,下游引物:5’-CAACAATCTGAAGGGCACAGT-3’。CXCR4上游引物:5’-CCTCCTGACTATCCCTGACATC-3’,下游引物:5’-CAGTAACAGGACAGGATGACGA-3’。β-actin上游引物:5’-AGATGACCCAGATCATGTTTGA-3’,下游引物5’-TTGGCATAGAGGTCTTTA-3’。逆转录扩增为cDNA后,进行配胶、上样、电泳、照相,采用Quantity One软件对进行结果分析。
1.5.2 免疫荧光双标
各组大鼠到观察时间点后,3.5%水合氯醛腹腔注射麻醉大鼠,经左心室4%多聚甲醛灌注以固定脑组织后取脑,取视交叉前后2 mm的脑组织,制作连续冠状面冰冻切片(厚约10 μm)。切片每隔10张取1张,每个组织各取10张做免疫荧光染色。切片固定修复后,山羊血清37℃封闭30 min,加VEGFR2抗体(1∶300)4℃孵育过夜,同时用PBS代替一抗做为阴性对照。37℃烤箱复温1 h,PBS冲洗后加PE-CD34(1∶50)及FITC标记羊抗兔二抗(1∶50)孵育1 h。PBS反复冲洗后封片,激光共聚焦显微镜(Leica TCS SP2,Germany),观察CD34、VEGFR2双阳性血管的表达并照相。
1.6 统计学处理
2 结果
2.1 电针及AMD3100干预对局灶脑缺血/再灌注大鼠缺血海马区SDF-1α mRNA表达的影响
模型组海马SDF-1α mRNA表达在再灌注后1d时开始增高,3 d时达高峰(P<0.05),7 d时表达低于3 d但仍高于再灌注后1 d。电针组各时间点均高于模型组,差异有统计学意义(P<0.05),电针+AMD3100组SDF-1α mRNA表达在再灌注后1 d时明显高于电针组(P<0.05),但3 d、7 d表达逐渐下降,7 d时明显低于电针组(P<0.01)。药物组1 d表达高于模型组(P<0.01),至7 d时明显低于模型组(P<0.05)。见图1。

注:M: Marker; 1-5: Sham,I/R,I/RE,I/REA,I/RA; a:P<0.05与I/R组比较; b:P<0.05与I/RE比较。
2.2 电针及AMD3100干预对局灶脑缺血/再灌注大鼠缺血海马区CXCR4 mRNA表达的影响
模型组与电针组再灌注后各时间点海马CXCR4 mRNA的表达均高于假手术组,电针组各时间点均明显高于模型组(P<0.05)。电针+AMD3100组CXCR4 mRNA表达在再灌注后1 d时明显高于电针组与模型组(P<0.01),而后逐渐下降,7 d时明显低于电针组(P<0.01)。药物组再灌注后1 d表达高于模型组(P<0.01),7 d明显低于模型组(P<0.01)。见图2。

注:M: Marker; 1-5: Sham,I/R,I/RE,I/REA,I/RA; a:P<0.05与I/R比较; b:P<0.01与I/RE组比较。
2.3 电针及AMD3100干预对局灶脑缺血/再灌注缺血海马区CD34+VEGFR2+EPCs源性血管表达的影响
模型组与电针组CD34+VEGFR2+血管数量随着时间延长逐渐增多,7 d时增至最多(P<0.01)。与模型组比较,再灌注后1 d电针组血管数量差异无统计学意义(P>0.05),但再灌注后3 d、7 d时电针组明显高于模型组(P<0.05)。与电针组比较,电针+AMD3100组再灌注后1 d、3 d血管表达差异无统计学意义(P>0.05),但至7 d时电针+AMD3100组明显低于电针组(P<0.01)。与模型组比较,AMD3100组再灌注1 d、3 d血管数量表达差异无统计学意义,但7 d时明显低于模型组,差异有统计学意义(P<0.01),见图3、4(图4见彩插5)。

注:a: P<0.05与I/R组比较; b: P<0.05与I/RE组比较。
2.4 局灶脑缺血/再灌注后各组缺血海马区SDF-1α mRNA与CD34+VEGFR2+血管表达的相关性分析
对局灶脑缺血/再灌注后第7 天模型组、电针组、电针+AMD3100组、AMD3100组缺血海马区SDF-1α mRNA与CD34+VEGFR2+血管表达的相关性分析,得回归方程:Y=15.016x + 4.415,R2=0.6148。相关系数R=0.784,P<0.01。表明两者呈正相关且显著相关。提示局灶脑缺血/再灌注后脑内缺血海马区的CD34+VEGFR2+血管表达变化与SDF-1α的表达变化具有显著相关性。结果见图5。
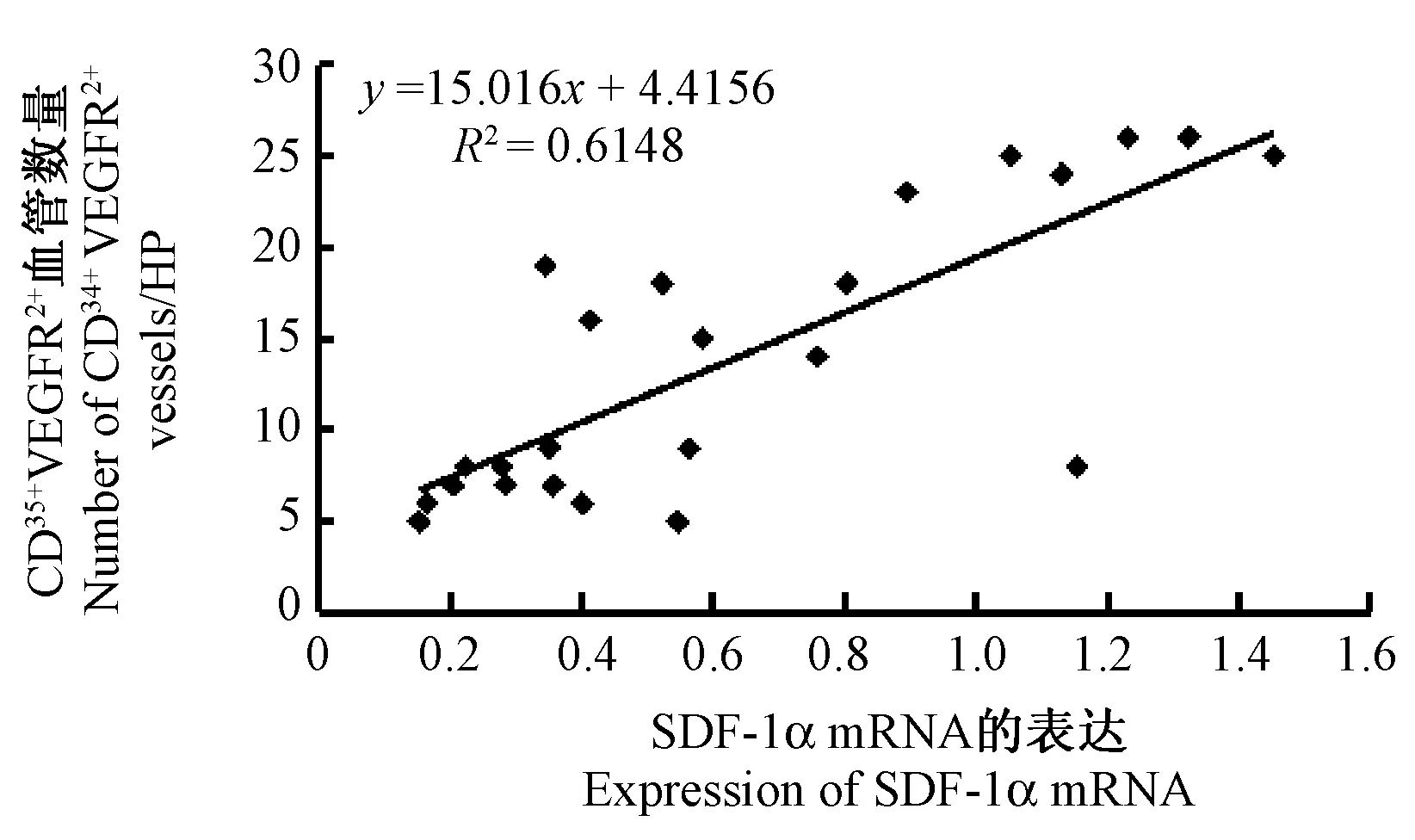
图5 局灶脑缺血/再灌注后7d各组缺血海马区SDF-1α mRNA与CD34+VEGFR2+血管表达的相关性分析
3 讨论
针刺作为脑缺血的一种“非药物”治疗手段,可有效地改善脑缺血的症状及预后[10]。本研究选取“百会”穴与“四关”穴作为电针穴位,“一气一血”、“一阳一阴”、“一上一下”相互调节相互影响,能够达到醒脑开窍、舒经活络、平肝熄风、祛瘀化痰的作用,是脑卒中治疗最常选取的基础穴。本研究发现,电针可明显上调局灶脑缺血/再灌注后缺血海马区SDF-1α/CXCR4的表达,增加海马区CD34+VEGFR2+血管表达,且CD34+VEGFR2+血管表达变化与SDF-1α的表达变化具有显著相关性。CXCR4特异性拮抗剂AMD3100在脑缺血/再灌注后早期1 d时并不能抑制SDF-1α的表达,反而明显增加SDF-1α的表达,但7 d时可明显抑制由电针或脑缺血诱发的SDF-1α/CXCR4表达及CD34+VEGFR2+EPCs源性血管表达的上调。
EPCs可参与脑缺血后的脑内血管再生修复[11]。遗憾的是目前仍没有特异鉴定EPCs的方法,回顾多项研究发现,CD34、VEGFR2表面抗原的结合鉴定EPCs具有敏感性、特异性和可靠性,是目前科研和临床研究中较好的选择[12,13]。王秀志等[14]发现电针可增加局灶脑缺血/再灌注大鼠外周血VEGFR2+PECAM+EPCs数量。赵瑛等[15]发现电针可增加局灶脑缺血/再灌注大鼠外周血CD31+VEGFR2+EPCs数量,从而促进脑缺血区的血管再生修复。本研究进一步发现电针可增加脑缺血后缺血海马区CD34+VEGFR2+EPCs源性血管数量,推测电针可能促进骨髓EPCs动员至外周血归巢至脑内缺血区参与血管形成。
SDF-1α/CXCR4轴是EPCs动员的关键调控因素之一[16,17],SDF-1α能增强EPCs的迁移粘附及其成血管能力,急性局灶性脑缺血患者的SDF-1α水平与早期外周血EPCs数量密切相关[4,18]。孙宏毅等[19]发现电针可上调外周血SDF-1α的表达,增加骨髓和外周血VEGFR2+EPCs、CXCR4+EPCs数量。CXCR4特异性阻断剂AMD3100体外长期干预可明显抑制EPCs的增殖迁移及成血管能力[20]。但AMD3100的早期作用反而是促进EPCs的动员[21]。本课题组早期研究发现电针亦可上调脑缺血皮质区SDF-1α/CXCR4的表达,促进微血管形成[5]。为进一步深入研究,故本研究的主要研究对象为脑内另一重要解剖区“脑缺血海马区”,探讨电针对脑缺血海马区SDF-1α/CXCR4轴表达的影响。且本研究采取CD34和VEGFR2双标EPCs源性血管,观察电针对CD34+VEGFR2+EPCs源性血管表达的影响,本研究发现AMD3100在脑缺血早期并不能抑制反而增加SDF-1α的表达,至中晚期时才可明显抑制由电针或脑缺血诱发的SDF-1α/CXCR4及CD34+VEGFR2+EPCs源性血管表达的上调,且脑缺血中晚期CD34+VEGFR2+血管表达变化与SDF-1α的表达变化显著相关。Petit等[22]认为在缺血早期AMD3100对SDF-1α/CXCR4轴的阻断作用,可能导致SDF-1α短暂性处于较高水平,从而诱导EPCs动员入血并归巢至脑内参与血管再生,故出现SDF-1α表达增高,EPCs数量增多的情形。但长期应用AMD3100,EPCs的增殖迁移及成血管能力受到抑制,SDF-1α表达逐渐降低,即可阻断EPCs动员归巢,从而抑制EPCs参与脑内血管再生。由此可见AMD3100作为CXCR4的特异性阻断剂在局灶脑缺血/再灌注中晚期可阻断电针促进脑内血管再生的作用,进一步阐明电针促进脑内血管再生的机制与上调SDF-1α/CXCR4的表达密切相关。
结合以往研究,推测SDF-1α/CXCR4所诱导的EPCs的动员、迁移、归巢,可能是电针促进脑缺血/再灌注后脑内血管再生中的一个极其重要的机制,而其更为全面的机制还需进一步探索。
(本文图4见彩插5。)
[1] 张慧敏,费宇彤,时宇静,等.针刺“百会”“太阳”改善局灶性脑缺血脑微血管内皮细胞功能的动态观察 [J].针刺研究,2006,31(2):67-73.
[2] 崔碧,李健丁,张瑞平.大鼠骨髓内皮祖细胞SPIO 标记及检测 [J].中国医药导报,2011,8(9):33-35.
[3] Urbich C,Dimmeler S.Endothelial progenitor cells: characterization and role in vascular biology [J].Circ Res,2004,95(4):343-353.
[4] Bogoslovsky T,Spatz M,Chaudhry A,et al.Stromal-derived factor-1[alpha] correlates with circulating endothelial progenitor cells and with acute lesion volume in stroke patients [J].Stroke,2011,42(3):618-625.
[5] 赵旺,罗勇.电针对局灶脑缺血/再灌注大鼠大脑皮质基质细胞衍生因子-1表达的影响及其促进脑内血管再生的作用 [J].中华物理医学与康复杂志,2010,32(6):409-413.
[6] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats [J].Stroke,1989,20(1):84-91.
[7] 赵浩,李永宁,王任直,等.大鼠局灶性脑缺血模型的有效制备 [J].中国实验动物学报,2009,17(6):432-436.
[8] 何学令,尹海林.脑缺血动物模型的研究进展 [J].中国比较医学杂志,2004,14(4):248-252.
[9] 罗勇,董为伟.Wistar大鼠插线法局灶性脑缺血/再灌注模型的实验研究 [J].重庆医科大学学报,2002,27(1):1-4.
[10] 曹莹,戴建武,胡志兵,等.依达拉奉联合电刺激小脑顶核治疗急性脑梗死疗效观察 [J].中国医药导报,2009,6(16):100-101.
[11] Navarro-Sobrino M,Rosell A,Hernandez-Guillamon M,et al.Mobilization,endothelial differentiation and functional capacity of endothelial progenitor cells after ischemic stroke [J].Microvasc Res,2010,80(3):317-323.
[12] Fadini GP,Losordo D,Dimmeler S.Critical reevaluation of endothelial progenitor cell phenotypes for therapeutic and diagnostic use [J].Circ Res,2012,110(4):624-637.
[13] Asahara T,Kawamoto A,Masuda H.Concise review: circulating endothelial progenitor cells for vascular medicine [J].Stem Cells,2011,29(11):1650-1655.
[14] 王秀志,张莉,蔡绍皙,等.电针对脑缺血再灌注大鼠缺血局部脑血管形成的影响 [J].针灸临床杂志,2010,26(8): 61-63.
[15] 赵瑛,陈斯佳,于文娟,等.电针刺激对脑缺血大鼠内源性EPCs及相关血清细胞因子的影响 [J].生物医学工程学杂志,2010,27(6):1322-1326.
[16] Liekens S,Schols D,Hatse S.CXCL12-CXCR4 axis in angiogenesis,metastasis and stem cell mobilization [J].Curr Pharm Des,2010,16(35):3903-3920.
[17] 姚峰,周军媚,王佐,等.SD大鼠SDF-1α基因克隆与序列分析 [J].中国实验动物学报,2008,16(1):14-18.
[18] 姚峰,周军媚,王佐,等.SDF-1α对单核细胞的黏附作用 [J].中国比较医学杂志,2009,19(3):32-34.
[19] 孙宏毅,罗勇,卢桃利,等.电针对局灶性脑缺血/再灌注大鼠外周血和骨髓内皮祖细胞的作用 [J].针刺研究,2012,37(3):179-185.
[20] Yin Y,Huang L,Zhao X,et al.AMD3100 mobilizes endothelial progenitor cells in mice,but inhibits its biological functions by blocking an autocrine/paracrine regulatory loop of stromal cell derived factor-1 in vitro [J].J Cardiovasc Pharmacol,2007,50(1):61-67.
[21] Shepherd RM,Capoccia BJ,Devine SM,et al.Angiogenic cells can be rapidly mobilized and efficiently harvested from the blood following treatment with AMD3100 [J].Blood,2006,108(12):3662-3667.
[22] Petit I,Jin D,Rafii S.The SDF-1-CXCR4 signaling pathway: a molecular hub modulating neoangiogenesis [J].Trends Immunol,2007,28(7):299-307.
