基底细胞癌、鳞状细胞癌组织中PinX1、hTERT的表达及意义*
2014-08-15瓦庆彪陈前明
袁 伟,方 杰,瓦庆彪,陈前明
(1.遵义医学院附属医院 皮肤科,贵州 遵义 563099;2.成都市第二人民医院 皮肤科,四川 成都 610017)
端粒酶活性增强可导致细胞永生化、肿瘤形成。内源性端粒酶抑制基因PinX1(PIN2/TERF1 interacting, telomerase inhibitor 1)基因是在人类细胞中发现的一个能与端粒酶逆转录酶hTERT(human telomerase reverse transcriptase)直接相互作用的端粒酶/端粒调控因子,能下调端粒酶活性,缩短端粒长度,进而诱导肿瘤细胞凋亡,被推测为潜在的抑癌基因。目前已发现PinX1在人类包括肝癌、膀胱癌、肺癌、鼻咽癌、食管癌等多种肿瘤中的表达明显降低或无表达[1-3],而且在皮肤肿瘤中已有研究表明端粒酶活性高于正常皮肤组织[4]。本研究旨在通过检测PinX1、hTERT在基底细胞癌(basal cell carcinomas,BCC)、鳞状细胞癌(squamous cell carcinoma,SCC)中的表达,探讨PinX1、hTERT在BCC、SCC发生发展中的作用。
1 资料与方法
1.1 标本资料 实时定量PCR应用新鲜组织标本,采集2012年3月至2013年3月遵义医学院附属医院及成都第二人民医院手术标本,包括BCC13例(男5例,女8例,年龄40~88岁,平均56.85±15.07岁)、SCC22例(男10例,女12例,年龄51~93岁,平均68.68±12.67岁)及正常皮肤组织15例(男性9例,女性6例,年龄22~65岁,平均39.66±11.85岁)。取材部位:头、面、四肢、躯干。所有标本采集离体10 min内置入冻存管内,放入-80 ℃低温冰箱保存。免疫组化石蜡标本为遵义医学院附属医院及成都市第二人民医院2008年12月至2012年6月明确诊断的病变组织石蜡标本。取材部位:头、面、四肢、躯干。其中30例BCC(男11例,女19例,年龄40~84岁,平均65.33±11.91岁)、46例SCC(男21例,女25例,年龄41~95岁,平均66.63±11.99岁)及正常皮肤组织17例(男8例,女9例,年龄15~60岁,平均38.54±14.12岁)。研究对象选择标准如下:①基底细胞癌及鳞状细胞癌均有典型或较为典型的皮损,术前均未经放疗、光动力治疗以及其它特殊治疗,经皮肤病理检查证实具有其相应的典型病理改变;②对照组正常皮肤为接受美容或整形外科手术的个体,均无免疫性疾病和系统性疾病。
1.2 主要实验试剂 实时定量PCR主要试剂:逆转录反应体系试剂盒(大连TakaPa公司)、SYBR Green I嵌合荧光法试剂盒(大连TakaPa公司)、PinX1与hTERT引物及内参还原磷酸甘油醛脱氢酶(GAPDH)引物均由上海Sangon公司设计合成,引物序列(见表1)。免疫组化主要试剂:兔抗人PinX1多克隆抗体(美国Assay生物公司)、兔抗人TERT多克隆抗体(北京博奥森生物技术有限公司)、PV-9000免疫组化染色试剂盒 (北京中杉金桥生物公司)、DAB显色试剂盒(北京中杉金桥生物公司)。PinX1多克隆抗体工作液浓度为1∶75,hTERT多克隆抗体工作液浓度为1∶200。
表1 PinX1、hTERT及GAPDH引物序列

基因引物长度PinX1Forward: 5'-GGTGGTCTAAAG-GAAAGGGTTT-3'Reverse: 5'-ATGGGCAATCCAGTTGTCTT-3'127hTERTForward: 5'-CTCCCATTTCATCAGCAAGTTT-3'Reverse: 5'-CTTGGCTTTCAGGATGGAGTAG-3'96GAPDHForward: 5'-AGAAGGCTGGGGCTCATTTG-3'Reverse: 5'-AGGGGCCATCCACAGTCTTC-3'258
1.3 实验方法
1.3.1 实时荧光定量PCR ①提取总RNA,合成cDNA:取组织100 mg采用Trizol一步法提取组织内总RNA。所提取的总RNA用紫外分光光度计测定A260/A280含量并检测其纯度,1.5%甲醛变性琼脂糖凝胶电泳检测RNA完整性。筛选所有比值在1.8~2.0且无降解的样品,取2 μg总RNA按逆转录反应体系试剂盒说明合成cDNA。cDNA放入-20 ℃冰箱中保存备用。②扩增及电泳:以cDNA为模板,利用Bio-RAD荧光定量PCR仪(美国Bio-RAD公司)按照SYBR Green I嵌合荧光法试剂盒说明书检测PinX1、hTERT基因mRNA在基底细胞癌、鳞状细胞癌及正常皮肤组织中的表达。扩增反应条件:PinX1 PCR:预变性95 ℃10 s,1个循环:变性95 ℃10 s,退火(复性)55 ℃30 s,40个循环;GAPDH PCR:预变性95 ℃10 s,1个循环;变性95 ℃10 s,退火60 ℃30 s,40个循环;hTERT PCR:预变性95 ℃10 s,1个循环;变性95 ℃10 s,退火60 ℃30 s,40个循环。采用2-△△ct法对有特异性扩增的目的基因进行相对定量。反应结束后分析PCR扩增曲线及熔解曲线,并进行2%琼脂糖凝胶电泳实验检测扩增特异性。
1.3.2 免疫组化 石蜡标本4 μm连续切片。采用免疫组化SP法,行pH6.0柠檬酸盐缓冲液高压修复抗原,具体方法参照试剂盒说明书进行。DAB显色,苏木精复染。PBS代替一抗作为阴性对照。PinX1免疫组化结果以胞核内出现棕黄色或棕褐色颗粒为阳性;hTERT免疫组化结果以胞核或(和)胞浆内出现棕黄色或棕褐色颗粒为阳性。染色范围以免疫染色最多的区域,每个标本在400倍图像下等距随机选10个视野,按一定顺序计数500个细胞,计算阳性细胞率并评分:基本无染色为0分,浅棕黄色为1分,棕色为2分,棕褐色为3分;着色细胞占计数细胞百分率≤5%为0分,6%~30%为1分,3l%~60%为2分,>61%为3分。评分=着色程度得分×着色细胞百分率得分。<2分为阴性(-),≥2分为阳性(+)[5]。
1.4 统计学处理 采用SPSS 13.0统计软件进行统计学分析,对实时定量PCR各组数据进行单因素方差分析;免疫组化实验组与对照组之间阳性表达率比较采用2检验进行比较分析,两样本相关性分析用Spearman相关检验,以α=0.05为检验标准。
2 结果
2.1 实时荧光定量PCR结果
2.1.1 总RNA纯度和完整性 A260/A280样本比值在1.8~2.0,提示总RNA纯度良好;在紫外线灯下可见28S、18S和5S三条大小和比例合适的条带,表明提取的总RNA无降解。
2.1.2 PinX1及hTERT mRNA的表达水平 PinX1基因PCR扩增产物电泳图在127bp处可见明显的电泳条带,hTERT基因PCR扩增产物电泳图在96 bp处可见明显的电泳条带,GAPDH基因PCR扩增产物电泳图在258bp处可见明显的电泳条带(见图1)。

注:M为DNA Marker 2000;1、2、3为PinX1扩增片断(127bp);4、5、6为GAPDH扩增片断(258bp);7、8、9为hTERT扩增片断(96bp)。 图1 PinX1、GAPDH和hTERT电泳图
2.1.3 PinX1及hTERT基因mRNA的相对表达量 BCC、SCC组织中PinX1 mRNA的相对表达量均低于正常对照组,差异有统计学意义(P<0.05),BCC与SCC组织中PinX1 mRNA的相对表达量差异无统计学意义(P>0.05);BCC、SCC组织中hTERT mRNA的相对表达量均高于正常对照组,差异有统计学意义(P<0.05),BCC与SCC组织中hTERT mRNA的相对表达量差异无统计学意义(P>0.05,见表2)。


组别例数PinX1hTERTBCC132.26±1.38*5.90±2.94*SCC222.68±1.71*6.28±4.01*Control154.25±2.021.62±0.99
注:*:与对照组相比,P<0.05。
2.2 免疫组化结果
2.2.1 BCC、SCC组织中PinX1蛋白的表达 PinX1蛋白阳性产物主要定位于胞核,SP染色呈粗细不一的棕黄色颗粒。正常皮肤组织中PinX1蛋白呈阳性表达(见图2A)。基底细胞癌、鳞状细胞癌中,可见到PinX1蛋白呈不同程度的表达(见图2B、2C)。两组PinX1阳性表达率均明显低于正常组织,差异有统计学意义(基底细胞癌与鳞状细胞癌组织PinX1阳性表达率差异无统计学意义(2=0.241,P>0.05,见表3)。
表3 PinX1蛋白在皮肤肿瘤组织和正常皮肤组织中的表达
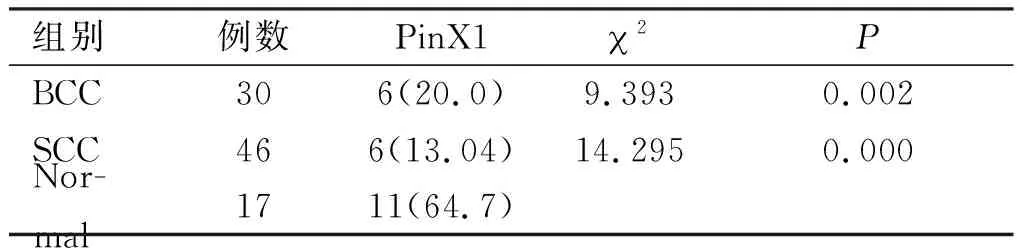
组别例数PinX12PBCC306(20.0)9.3930.002SCC466(13.04)14.2950.000Nor-mal1711(64.7)

注:A:PinX1蛋白在正常皮肤组织中的表达;B:PinX1蛋白在BCC组织中的表达;C:PinX1蛋白在SCC组织中的表达;D:hTERT蛋白在正常皮肤组织中的表达;E:hTERT蛋白在BCC组织中的表达;F:hTERT蛋白在SCC组织中的表达。 图2 PinX1、hTERT蛋白在各组组织中的表达(SP ×100)
2.2.2 BCC、SCC组织中hTERT蛋白的表达 hTERT蛋白阳性产物主要定位于细胞核或(和)细胞浆中,SP染色呈棕黄色颗粒。正常组织中多数hTERT表达呈阴性(见图2D)。基底细胞癌、鳞状细胞癌中,hTERT蛋白均有表达(见图2E、2F),其阳性表达率均明显高于正常组织,差异有统计学意义(基底细胞癌、鳞状细胞癌之间hTERT蛋白阳性表达率差异均无统计学意义(2=0.163,P>0.05,见表4)。
表4 hTERT在皮肤肿瘤组织和正常皮肤组织中的表达

组别例数hTERT2PBCC3019(63.3)11.6750.001SCC4627(58.7)11.0050.001Nor-mal172(11.8)
2.2.3 PinX1与hTERT蛋白表达的相关性分析 通过对PinX1与hTERT蛋白在组织中的阳性表达及阴性表达例数进行Spearman等级相关分析,结果表明:基底细胞癌组织中二者表达呈负相关(r=-0.439,P<0.05);鳞状细胞癌组织中二者表达呈负相关(r=-0.476,P<0.05);基底细胞癌及鳞状细胞癌两种皮肤肿瘤中二者表达呈负相关(r=-0.460,P<0.05)。
3 讨论
端粒酶能以自身RNA为模板合成端粒DNA,并加至端粒末端以维持端粒长度的稳定,抵消因各种原因造成的端粒的缩短及不稳定。正常人体细胞端粒酶活性缺乏,细胞分裂同时端粒就会相应缩短,当端粒缩短到一定长度时,保护染色体末端的功能丧失,最终导致细胞衰老或凋亡;而在肿瘤细胞中,端粒酶被重新活化,使端粒长度稳定,细胞因此逃过死亡而无限增殖,导致肿瘤细胞永生化[6-8]。
人端粒酶的主要组成为:①人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT);②端粒酶相关蛋白(telomerase associated protein, TP);③人端粒酶RNA(human telomerase RNA,hTR)。在端粒酶的活性起调控中,端粒酶催化亚单位TERT最为重要,是关键的限速酶,而端粒RNA及端粒酶相关蛋白均不能决定端粒酶活性[9]。hTERT为RNA依赖的DNA 聚合酶,可识别单链富含G的寡核苷酸引物,以其RNA组分的碱基为模板与端粒重复序列进行碱基互补配对,在合成、延伸碱基序列中起催化作用[10]。
作为内源性端粒酶抑制基因,PinX1基因由7个外显子组成,有两种转录形式,分别编码174个氨基酸和328个氨基酸[11]。其定位于8p23,该区域同时也是一个在多种人类肿瘤中发生高频杂合缺失(loss of heterozygosity,LOH) 的区域。有体外实验证据表明,PinX1与其端粒酶抑制结构域TID可以与hTERT相互作用,下调端粒酶活性[11-12]。同时,PinX1还可依赖TERT结合端粒酶的RNA组分,阻断端粒酶RNA,从而使其丧失活性,破坏其模板功能,从而抑制端粒酶活性[13-14]。
PinX1在正常人体组织内广泛存在,而在肿瘤组织中则低表达或者不表达[11];hTERT在肿瘤组织中存在高表达,而在正常组织中低表达或不表达[15]。本实验结果显示PinX1在基底细胞癌、皮肤鳞状细胞癌组织中的表达水平明显低于正常组(P<0.05),部分低表达或不表达,提示作为内源性端粒酶抑制基因,PinX1可能参与皮肤组织细胞端粒酶活性的下调,维持细胞的正常凋亡,抑制肿瘤的生长,由于PinX1的损伤或缺失,端粒酶在基底细胞癌、鳞状细胞癌组织中活化,使细胞永生化肿瘤生长。hTERT在基底细胞癌、鳞状细胞癌组织中的表达水平明显高于正常组(P<0.05),hTERT作为端粒酶的活性调控关键的限速酶,其在基底细胞癌、鳞状细胞癌组织中呈高表达,提示端粒酶活性在基底细胞癌、鳞状细胞癌及日光性角化病组织中可能强于正常皮肤组织,hTERT的高表达可能促进基底细胞癌、鳞状细胞癌的发生。基底细胞癌、鳞状细胞癌组织中PinX1表达和hTERT 表达呈负相关,推测二者可能存在着一定的拮抗,可能因为PinX1下调,hTERT不能被有效结合并抑制,致使端粒酶活性增强,端粒长度得到维持,因此细胞不能正常衰老或凋亡而无限增殖,从而导致肿瘤生长。
综上所述,检测PinX1和hTERT的表达可能对评价基底细胞癌、鳞状细胞癌的发展有重要的临床价值,PinX1、hTERT有可能成为基底细胞癌、鳞状细胞癌新的检测指标,而且通过调控PinX1、hTERT的表达可能成为治疗基底细胞癌、鳞状细胞癌的一条新途径。
[参考文献]
[1] 马英玉,武良,李继承.Pinx1表达与端粒酶活性及肿瘤的关系[J].细胞生物学杂志, 2008,30(4):472-474.
[2] 赖肖芬,申聪香,文忠,等. 端粒酶抑制因子PinX1基因在鼻咽癌细胞中的表达及作用效应分析[J].中国耳鼻咽喉颅底外科杂志, 2011,17(3):161-163.
[3] 左静,王大虎,张祥宏,等.PinXl在食管鳞状细胞癌中的表达及其与临床病理特征的关系[J].中国老年学杂志, 2012,32(1):259-260.
[4] Chen Z,Smith K J,Skelton H G,et al.Telomerase activity in Kaposi's sarcoma,squamous cell carcinoma,and basal cell carcinoma[J].Exp Biol Med, 2001,226(8):753-757.
[5] 张晋卿,梁虹,王珊珊,等.Survivin和COX-2在鲍温病和皮肤鳞状细胞癌中的表达及意义[J].中国皮肤性病学杂志, 2010,24(9):801-803.
[6] Grandin N,Charbonneau M. Protection against chromosome degradation at the telomeres[J].Biochimie, 2008,90(1):41-59.
[7] Bianchi A, Shore D. How telomerase Reaches Its End: Mechanism of Telomerase Regulation by the Telomeric Complex [J]. Mol Cell, 2008,31(2):153-165.
[8] Rhyu M S. Telomeres, telomerase, and immortality[J]. J Natl Cancer Inst,1995,87(12):884-894.
[9] Marcia B, Christophe N. Regulation of Telomerase and Telomeres:Human Tumor Viruses Take Control [J]. J Natl Cancer Inst, 2008,100 (2):98-108.
[10] Gillis A J, Schuller A P, Skordalakes E. Structure of the Tribolium castaneum telomerase catalytic subunit TERT[J]. Nature, 2008,455(7213):633-637.
[11] Zhou X Z, Lu K P.The Pin2/TRF1-interacting protein PinX1 is a potent Atelomerase inhibitor[J]. Cell, 2001,107(3).347-359.
[12] Johnson F B. PinX1 the tail on the chromosome[J]. J Clin Invest, 2011,121(4):1242-1244.
[13] Banik S S, Counter C M. Characterization of interactions between PinX1 and human telomerase subunits hTERT and hTR[J]. J Biol Chem, 2004,279(50):51745-51748.
[14] Lin J, Blackburn E H.Nucleolar protein PinX1p regulates telomerase by sequestering its protein catalytic subunit in an inactive complex lacking telomerase RNA [J]. Genes Dev, 2004,18(4):387-396.
[15] Zang G , Miao L , Mu Y, et al. Adenoviral mediated transduction of adenoid cystic carcinoma by human TRAIL gene driven with hTERT tumor specific promoter induces apoptosis [J]. Cancer Biol Ther, 2009,8(10):966-972.
