近交系小鼠移植性肝癌模型建立及对比分析
2014-08-14李晓娟汤紫荣李瑞生
李晓娟,汤紫荣,李 蓓,李瑞生
(1.解放军第302医院实验技术研究保障中心,北京 100039;2.解放军第302医院感染控制科,北京 100039)
肝癌是严重威胁人类健康的恶性肿瘤之一,其起病隐匿,病程短,死亡率高,且发病率还呈逐年上升趋势[1]。由于肝癌的各种临床疗效不佳,预后不良,因此肝癌的研究已成为临床和基础研究的热点[2],但肝癌的发生机制至今仍未完全阐明。而建立理想的肝癌动物模型是研究肝癌发病机制的重要手段[3]。许多研究者[4-5]复制肝癌模型的小鼠品系不尽相同,而这些不同品系小鼠所建立的肝癌模型成模率、发病机制是否存在差异,目前还未见评价和报道。因此本实验选取C57、C3H和BALB/c三种常用的近交系小鼠,利用肝内注射的方法建立原位移植性肝癌动物模型,并对其成模效果进行综合对比分析,以期筛选出一种最佳的品系小鼠,来建立更优质、更理想的原位移植性肝癌小鼠动物模型,为深入研究肝癌的致病机制提供良好的研究平台,也为今后肝癌的临床治疗和药物筛选奠定基础。
1 材料和方法
1.1 实验动物
选择近交系C3H、C57和BALB/c小鼠,均为SPF级,雄性,各10只,单鼠体质量为20~22 g,C3H小鼠购自北京维通利华实验动物技术有限公司【SCXK(京)2011-0009】,BALB/c小鼠和C57小鼠购自军事医学科学院实验动物中心【SCXK(军)2012-0004】。本实验室具有SPF级实验动物使用许可证【SYXK(军)2012-0010】。
1.2 细胞株制备
H22肝癌细胞株来自本实验室,将H22肝癌细胞株复苏后腹腔注射小鼠体内,8 d后抽取含有肝癌细胞的腹水,离心弃上清,台盼蓝染色计数,将癌细胞数调整至1×108/mL备用。
1.3 实验分组及肝癌模型制备
将选取的10只C57小鼠作为模型组Ⅰ,10只C3H小鼠作为模型组Ⅱ,10只BALB/c小鼠作为模型组Ⅲ。造模方法:将小鼠麻醉固定,沿胸骨下缘2 cm处沿腹中线向上剪开皮肤约1 cm,暴露肝脏,轻压腹部挤出肝脏左叶,用注射器吸取H22细胞悬液0.2 mL,刺入肝实质内,深度约2~3 mm,缓慢注入后拨出针头,用棉球轻压注射部位几秒,然后将肝脏再移回腹腔,缝合切口[6]。术后小鼠均正常饮食。
1.4 形态学观察
术后每日观察各组小鼠的生活状态,15 d后处死小鼠,测其腹水量,观察各组肝脏肿瘤生长情况,并用游标卡尺测量肿瘤的长径和短径,计算肿瘤体积(V):V=a×b2/2(a为长径,b为短径)[7]。将三组小鼠肝脏肿瘤组织置入10%甲醛固定,采用HE染色,并观察其形态学。
1.5 统计学方法
采用SPSS17.0统计软件对模型组Ⅰ、模型组Ⅱ和模型组Ⅲ的腹水量及肿瘤体积进行方差分析。
2 结果
2.1 三组小鼠肝移植瘤成功率及腹水量对比分析
术后各组小鼠恢复良好,均未出现死亡,存活率均为100%。术后第15天所有小鼠均开腹观察:模型组Ⅰ的10只小鼠肝脏表面全部有灰白色病灶,肿瘤移植成功率为100%,全部小鼠均产生腹水,腹水量平均为(7.24±1.24)mL。模型组Ⅱ的10只小鼠有6只的肝脏表面有灰白色病灶,肿瘤移植成功率为60%,其中有8只产生腹水,腹水量平均为(6.95±3.45)mL。模型组Ⅲ的10只小鼠仅有3只小鼠的肝脏表面有灰白色病灶,肿瘤移植率为30%,其中有7只小鼠产生腹水,腹水量平均为(6.31±2.75)mL。三组的腹水量之间不存在统计学意义(表1)。
2.2 三组小鼠肝移植瘤外观的对比分析
模型组Ⅰ的10只小鼠肝脏表面全部有大块紧实的灰白色结节,肿瘤体积平均为(62.21±5.25)mm3。模型组Ⅱ的6只小鼠的肝脏表面有大块松散的灰白色结节,肿瘤体积平均为(43.18±2.47)mm3。模型组Ⅲ的3只小鼠的肝脏表面出现如小米粒大小的灰白色结节,肿瘤体积平均为(5.54±1.01)mm3。三组的肝肿瘤平均体积之间均存在显著的统计学差异(P< 0.05)(表1和图1)。
2.3 三组小鼠肝移植瘤的组织形态学分析
模型组Ⅰ和Ⅱ肝脏肿瘤光镜下可见肿瘤组织呈巢状,肝小叶组织已经完全破坏,肿瘤灶内瘤细胞丰富,排列拥挤。瘤细胞异型性明显,嗜酸性,核分裂像多见。局灶见坏死,瘤细胞间可见裂隙样血管,部分瘤细胞围绕血管生长。模型组Ⅲ肝脏肿瘤光镜下可看到肿瘤细胞与正常细胞交界,肿瘤细胞大小不等,较正常肝细胞体积明显增大,形态各异,核大、核膜极不规则,部分肿瘤组织压迫周围肝细胞,癌细胞常常向周围正常肝组织内浸润性生长(图2)。
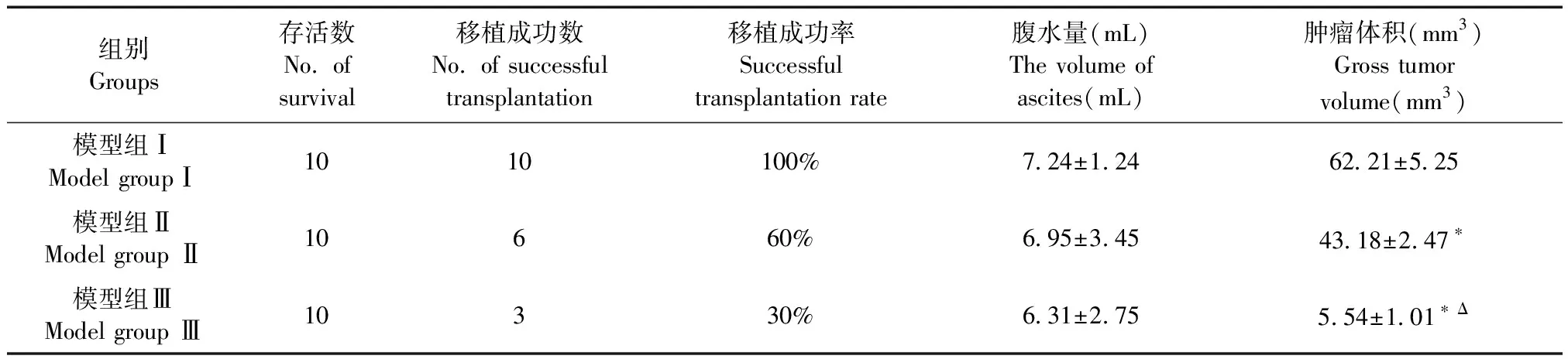
表1 三组小鼠肝癌肿瘤移植成功率、腹水量及肿瘤体积分析
3 讨论
原发性肝癌的发病率和死亡率越来越高,严重威胁着人类的健康。目前由于还缺乏有效的治疗手段和预防措施,建立一个理想的与人类接近的动物肝癌模型对于研究肝癌的发病机制有极大的应用价值[8]。而利用小鼠进行肝癌的原位移植能够很好地模拟人肝癌体内的血供和生长环境,提供与肝癌病人相似的肝癌生物学特性[9]。李银鹏等[10]利用C57小鼠建立了原位肝癌移植模型并使用高频超声技术对小鼠肝原位癌进行可靠的非侵入性监测分析。李清等[11]利用BALB/c小鼠研究半乳糖基壳聚糖/5-氟尿嘧啶纳米粒来抑制小鼠原位肝癌移植肿瘤,取得了良好地效果。沈艳等[12]对比分析了两种免疫缺陷动物人肝癌模型的肿瘤生物学特性。本人还曾利用PLCε基因敲除小鼠成功建立了原位移植性肝癌动物模型[13]。但对于这些不同品系小鼠所建立的原位移植性肝癌模型之间是否存在一定的差异和不同,国内未见报道。
因此本实验选取了近交系C3H、C57和BALB/c小鼠复制原位移植性肝癌模型,并对三种小鼠的成模效果进行了对比分析:三种小鼠在实验过程中均未出现死亡,其存活率为100%,说明该操作方法是可行的。15 d后开腹观察三组小鼠发现均产生不同程度的腹水,这与H22为腹水型瘤株基本相符[14]。而不同组小鼠的肝脏外观显示:C57组小鼠肝癌移植成功率为100%,显著高于60%的C3H组和30%的BALB/c组,提示C57小鼠的肝癌成瘤率最高,最易形成原发性肝癌病灶。同时C57组肝脏肿瘤全部为大块紧实灰白色病灶,比C3H组和BALB/c组的肝脏肿瘤都大,虽然病理结果显示三组小鼠肝脏的灰白色病灶均为典型的肝细胞癌病变,但C57组小鼠的肿瘤平均体积明显大于后两组,提示C57小鼠的成瘤效果最好,可利于其来研究原发性肝癌的发病机制。这与Ruian Xu等[15]使用C57来复制原位移植性肝癌模型进行相关研究的理念基本一致。而C57小鼠具有最好的成瘤效果可能与该小鼠的遗传背景和遗传基因具有相关性,有待进一步对其成瘤机制进行研究和探讨。
综上所述,本实验针对三种不同小鼠所建立的原位移植性肝癌模型的成模效果进行了综合分析,证实了C57小鼠是最理想的复制原位移植性肝癌模型的实验动物,为今后建立原位移植性肝癌模型选择合适的实验动物提供了实验依据和理论参考,也为进一步研究原位肝癌的发病机制、临床治疗和药物筛选提供了研究平台。
参考文献:
[1] 周倜,陈勇,尤楠,等.二乙基亚硝胺诱导大鼠肝癌模型的建立及评价[J].现代生物医学进展,2010,10(20):3812-3815.
[2] 陈利平,文天夫.兔肝VX2移植癌模型的建立[J].现代预防医学,2011,38(11):2124-2125.
[3] 毛庭枝,周巧灵,梁荣感,等.仓鼠胰腺癌细胞株移植性肝癌模型的建立及其生物学特性[J].世界华人消化杂志,2009,17(18):1827-1831.
[4] 吴浩,沈顺利,匡铭,等.小鼠皮下移植性肝癌模型的热消融研究[J].中国普通外科杂志,2012,21(8):973-977.
[5] 唐晓勇,唐迎雪,唐由君.复肝注射液对H22肝癌模型小鼠作用的实验研究[J].山东中医药大学学报,2012,36(3):248-250.
[6] 徐玉音,陈莉.肝癌动物模型建立的方法[J].临床与实验病理学杂志,2011,27(4):405-409.
[7] 张海英,李艳茹,王健君,等.小鼠原位移植性肝癌模型的建立及生物学特性[J].吉林大学学报(医学版),2009,35(1):5-8.
[8] 崔智,李瑞生,李晓娟,等.DEN诱发PLCε基因敲除小鼠肝癌模型的分析[J].中国比较医学杂志,2013,23(3):17-20.
[9] Lee IJ,Li ZS,Lee YN,etal.Hepatocellular carcinoma model cell lines with two distinct migration models[J].Biochem Biophys Res Commun,2006,346(4):1217-1227.
[10] 李银鹏,朱惠明,吴本华.C57BL /6J小鼠原位肝癌模型的建立及高频超声对原位癌的监测[J].胃肠病学和肝病学杂志,2010,19(2):145-147
[11] 李清,庄婵娟,程明荣,等.半乳糖基壳聚糖/5-氟尿嘧啶纳米粒抑制小鼠原位肝癌移植模型的实验研究[J].现代生物医学进展2012,12,35:6819-6823.
[12] 沈艳,廖菁,周文江,等.比较两种免疫缺陷动物人肝癌模型的肿瘤生物学特性[J].上海交通大学学报( 农业科学版),2009,27(4):335-340.
[13] 李晓娟,靳雪源,白冰珂,等.PLCε基因敲除小鼠移植性肝癌模型的建立与分析[J].中国比较医学杂志,2014,24(4):5-7.
[14] 胡卫,陈涛.鼠移植性肝癌模型研究进展[J].河南肿瘤学杂志,2003,16(6):463-466.
[15] Ruian Xu,Xueying Sun,Lai-Yin Tse,etal.Long-Term Expression of Angiostatin Suppresses Metastatic Liver Cancer in Mice[J].HEPATOLOGY,2003,15(4):1451-1460.
