莫诺苷对局灶性脑缺血再灌注大鼠Wnt7a和APC表达的影响
2014-08-14薛金龙孙芳玲刘婷婷侯虹丽魏仁平向本旭艾厚喜王玉兰石淑先
薛金龙,孙芳玲,刘婷婷,侯虹丽,魏仁平,向本旭,艾厚喜,王玉兰,张 丽,石淑先,王 文
(1.北京化工大学材料科学与工程学院,北京 100029;2.首都医科大学宣武医院药理研究室,北京 100053;3.河北北方学院,河北 张家口 075000)
脑血管病(cerebral vascular diseases,CVD)是危害人类健康和生命的三大疾病之一,而缺血性脑血管病(ischemic cerebralvascular disease,ICD)更是占了其中的50%以上。缺血性脑损伤病理机制复杂,一直是神经科学领域研究的热点。Wnt信号通路是调控细胞生长增殖分化的关键途径,在大脑的可塑性中起至关重要的作用。此前对于Wnt信号通路在神经发生的作用已经有了一定的研究,最近研究表明,Wnt 信号通路在缺血性脑损伤的修复过程中和神经血管稳态重构中作用机制明显[1]。Wnt7a是Wnt信号通路上游重要配体,对调解Wnt信号通路作用关键,并且Wnt7a 可以调节加速细胞的生长和分化的进程,抑制神经胶质再生[2]。APC是Wnt信号通路的抑制剂,可以通过抑制Wnt信号通路的激活调节细胞的增殖分化[3]。
中药山茱萸是山茱萸科植物山茱萸(cornus offcinalisSieb.et Zucc)的干燥成熟果肉,具有补肝益肾、涩精固脱的作用。本实验室对其有效成分山茱萸环烯醚萜苷进行进一步分离,得到单体化合物莫诺苷(morroniside)。我们的前期研究发现,莫诺苷能减小局灶性脑缺血再灌注大鼠脑梗死体积,增强皮层抗氧化、抗炎和抗凋亡能力[4-9],并在体外和体内实验对血小板聚集有一定抑制作用[10-13]。我们推测莫诺苷对缺血性脑损伤有神经保护作用,并且能够促进缺血性脑损伤的神经修复。本文通过体内实验研究莫诺苷对缺血性脑损伤大鼠皮层Wnt7a和APC含量的影响,初步探讨莫诺苷促进缺血性脑损伤后神经发生的机制。
1 材料和方法
1.1 动物
SPF级雄性Sprague-Dawley大鼠50只,体重250~280 g,购自北京斯贝福实验动物科技有限公司【SCXK(京)2011-0004】。由首都医科大学宣武医院SPF级实验动物室常规饲养【SYXK(京)2010-0013】,自由进食进水,温度25±1℃,相对湿度55±5%。
1.2 药物
莫诺苷:由本室从山茱萸中提取制备,采用高效液相分析,纯度约98.5%,蒸馏水溶解配制新鲜溶液。
1.3 试剂和仪器
一抗Anti-APC antibody(批号:ab40778),Abcam(香港);一抗 Anti-Wnt7aantibody(批号:ab100792);小鼠抗β-catenin一抗(批号:TA09);山羊抗鼠IgG(批号:ZB-2010)和山羊抗兔IgG(批号:ZB-2301),北京市中杉金桥生物技术有限公司。
超声波细胞破碎粉碎机:JY92-II型,宁波市新芝科技研究所;台式微量冷冻离心机:Microfuge 22R,美国Beckman Coulter公司;电泳仪:Bio-Rad 043BR1549,美国BIORAD公司;小型垂直电泳槽:1658004,美国BIORAD公司;高分辨率多模式分子成像系统:Image Station 4000R,美国Carestream Health公司;全波长酶标仪:Multiskan Spectrum,美国Thermo Fisher公司。
1.4 方法
1.4.1 模型制备
采用Longa等[14]所介绍的大脑中动脉线栓模型(middle cerebral artery occlusion,MCAO)并稍加改进。大鼠术前禁食12 h。10%水合氯醛(400 mg/kg)腹腔注射麻醉后,切开右侧颈部,沿胸锁乳突肌分离肌肉和筋膜,暴露右侧颈总动脉。分离右侧颈外动脉和颈内动脉。于近心端结扎颈总动脉,且在颈总动脉分岔处结扎颈外动脉。动脉夹夹闭颈内动脉,在近心端距颈总动脉分岔约4 mm处用眼科剪剪一斜行细小动脉切口,将直径0.28 mm的栓线从颈总动脉插入颈内动脉约18 mm,此时栓线已进入大脑中动脉,到达大脑前动脉起始部,阻断大脑中动脉的所有血供,造成大脑中动脉供血相关区的梗死灶。栓塞30 min后缓慢拔出栓线,实现再灌注。假手术组只分离动脉结扎,不插线。
1.4.2 分组及给药
大鼠苏醒后提尾时出现对侧前肢内收屈曲,爬行时向对侧转圈,站立时向对侧倾倒等症状即为MCAO模型成功。随机将MCAO成模大鼠分为:模型组,莫诺苷小、中、大高剂量组(30 mg/kg,90 mg/kg,270 mg/kg),每组10只。采用灌胃给药,每天1次,连续给药7 d。假手术组和模型组给予蒸馏水灌胃。
1.4.3 western-blot 分析Wnt7a和APC 蛋白表达
取新鲜大鼠右侧皮层脑组织裂解提取蛋白,进行SDS-PAGE 电泳(分离胶10%,浓缩胶5%),每孔加入50 pg蛋白质,先恒压70 V电泳40 min;然后恒压100 V 电泳至分离胶底部,电转移到硝酸纤维素膜上,5%脱脂奶粉封闭2 h,加入1∶1000 稀释的兔抗大鼠APC 单克隆抗体和1∶500稀释的兔抗大鼠Wnt7a多克隆抗体,4℃过夜,TBST 洗涤3 次,每次10 min,再加入1∶2000稀释的羊抗兔IgG-HRP,室温摇床孵育2 h,TBST 洗涤3次,ECL试剂显色、曝光并拍照,以β-actin作为内参,将曝光后的图片导入软件Quantity One中分析。实验重复3次。
1.3 统计学处理
采用SPSS 13.0 软件进行处理,实验数据均以(x±s)表示,组间比较采用ANOVA 方差分析和t 检验,以α=0.05 为检验水准。
2 结果
2.1 免疫印迹法观察莫诺苷对缺血性脑损伤后Wnt7a表达的影响
造模后7 d,模型组大鼠大脑皮层Wnt7a蛋白表达水平比假手术组升高(P< 0.01);与模型组相比,莫诺苷大剂量组(270 mg/kg)大鼠大脑皮层Wnt7a蛋白表达水平升高显著,差异有统计学意义(P< 0.01)(图1,表1)。
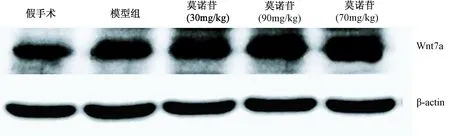
图1 免疫印迹检测缺血性脑损伤大鼠皮层Wnt7a表达
表1免疫印迹法检测Wnt7a表达变化统计结果
Tab.1The statistical results of Wnt7a expression changed by western blot
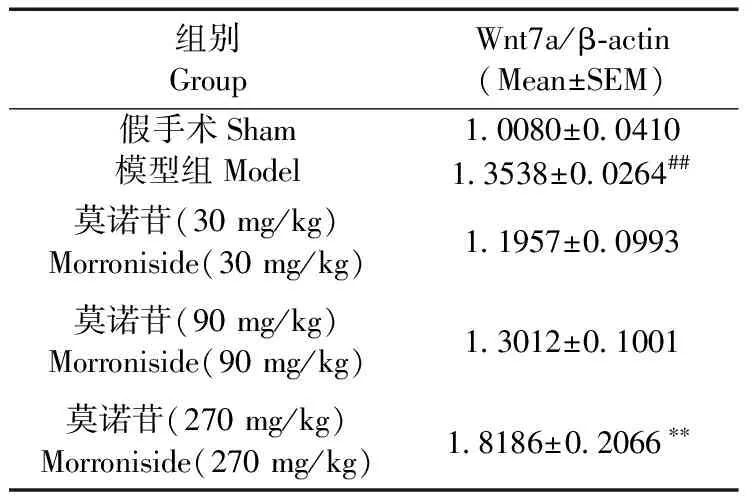
注: n=5,Meam±S.E.M. ** P < 0.01与模型组相比; ## P < 0.01,与假手术组相比。
2.2 免疫印迹法观察莫诺苷对缺血性脑损伤后APC表达的影响
造模7 d后,模型组大鼠大脑皮层APC蛋白表达水平比假手术组显著降低(P< 0.001);与模型组大鼠相比,莫诺苷小、中、大剂量组(30 mg/kg, 90 mg/kg, 270 mg/kg)大鼠大脑皮层APC蛋白表达水平均降低显著,差异有统计学意义(P< 0.001,P< 0.001,P< 0.001)(图2,表2)。
3 讨论
脑卒中有着高发病率、高死亡率、高致残率、高复发率的特点,给社会和家庭造成巨大负担,研发有效的治疗缺血性脑损伤的药物至关重要,也是今后发展的必然趋势。
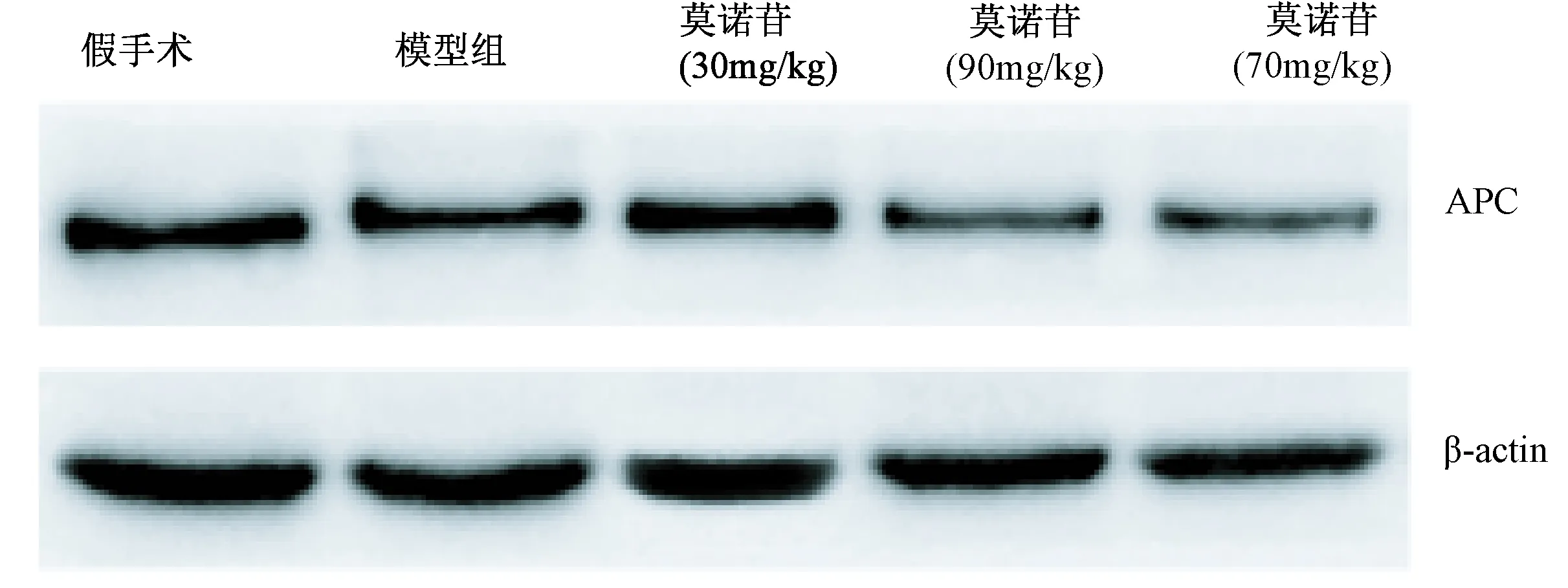
图2 免疫印迹检测缺血性脑损伤大鼠皮层APC表达
表2免疫印迹法检测APC表达变化统计结果
Tab.2The statistical results of APC expression changed by western blot
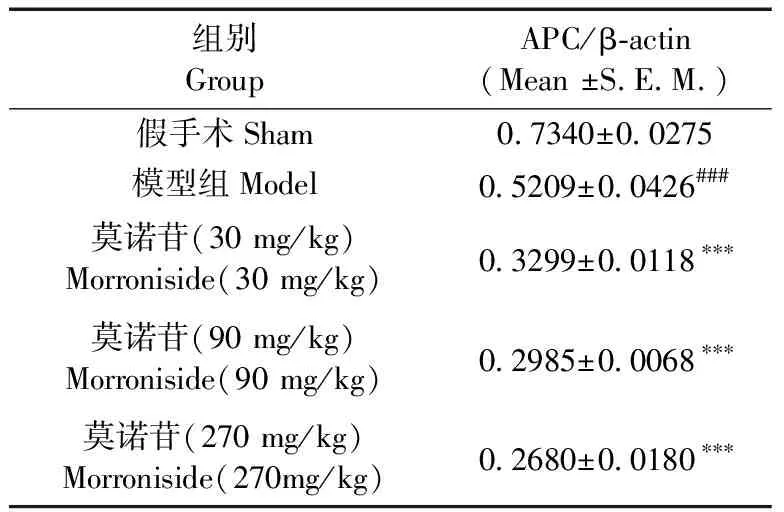
注:n=5,mean±S.E.M。*P < 0.05,*** P < 0.001与模型组相比;### P < 0.001,与假手术组相比。
Wnt信号通路是广泛存在于多细胞真核生物中的信号通路,是调控细胞生长增殖分化的关键途径并且调节成年神经发生[15],并与脑缺血后的神经修复有着密切的联系。很有可能作为药物促进脑缺血损伤后神经修复的靶点之一。
在Wnt信号通路中Wnt7a配体与细胞膜上的Fzd结合,联合低密度脂蛋白受体相关蛋白5/6(LRP5/6)可以激活Wnt信号通路[16]。Wnt7a 具有促进突触发生的作用,在体外对大脑颗粒细胞神经元培养的试验中发现,Wnt7a 的提高可以通过轴突微管的重构导致轴突的扩展和分支;并能促进小脑皮层中的小脑粒细胞和苔藓纤维之间突触联系成熟[17]。Wnt 7a促进皮质层神经细胞的分化和前体细胞的自我更新能力[18]。
在Wnt 信号通路中,APC蛋白与β-连环蛋白(β-catenin)的稳定性密切相关,APC调节β-catenin的含量,控制相关转录过程。APC会与β-catenin结合,促使细胞核内β-catenin运出,减少β-catenin/TCF结合,抑制转录过程。Wnt-7a可诱导APC蛋白从β-catenin细胞质络合物上解离[19]。另外,Sierra等[20]研究发现,APC会破坏Axin和Gsk-3β组成的降解复合体,从而促使β-catenin降解。因此作为Wnt信号通路的抑制剂[21],APC含量的增加会抑制Wnt通路激活而调节细胞的增殖分化。
本文采用免疫印迹法检测MCAO模型大鼠大脑皮层Wnt7a和APC的表达,发现造模7 d后,模型组大鼠大脑皮层Wnt7a的表达比假手术组显著升高,APC表达显著下降,表明MCAO造模后激活了Wnt信号通路。大量研究表明脑梗死可激发短暂和微弱的内源性代偿性修复机制[22],其中Wnt信号通路被激活很可能是所涉及的修复机制之一。李等[23]发现脑缺血7 d后海马区的Wnt7b和β-catenin表达量均明显增加,也提示在成年大鼠脑缺血损伤后可内源性激活Wnt信号通路。但脑缺血后短暂的应激修复机制不足以最终修复神经血管的损伤,需要外源性药物的干预治疗。我们发现给予莫诺苷治疗7 d后,Wnt7a表达量较模型组相比明显上升,APC的表达则显著降低,表明莫诺苷很可以通过促进Wnt7a的表达、抑制APC的表达来进一步激活Wnt信号通路,并进一步发挥保护神经,促进神经发生的作用。由于Wnt通路的调节机制比较复杂,莫诺苷如何通过调节Wnt信号通路来促进脑缺血后的神经恢复,需要进一步实验研究。
参考文献:
[1] 王文,孙芳玲,艾厚喜,等.神经血管稳态重构作用和机制[J].中国药理学与毒理学杂志,2012,26(3):423.
[2] Prajerova I,Honsa P,Chvatal A,etal.Distinct effects of sonic hedgehog and Wnt-7a on differentiation of neonatal neural stem/progenitor cells in vitro[J].Neuroscience.2010,171(3):693-711 .
[3] Toledo EM,Colombres M,Inestrosa NC.Inestrosa. Wnt signaling in neuroprotection and stem cell differentiation[J].Prog Neurobiol,2008,86(3):281-296.
[4] Wang W,Xu J,Li L,etal.Neuroprotective effect of morroniside on focal cerebral ischemia in rats[J].Brain Res Bull,2010,7(83):196-201.
[5] Wang W,Sun F,An Y,etal.Morroniside protects human neuroblastoma SH-SY5Y cells against hydrogen peroxide-induced cytotoxicity[J].Eur Journal Pharmacol.,2009,(613):19-23.
[6] 刘秀平,许栋明,王文,等.莫诺苷对大鼠局灶性脑缺血模型脑梗死体积的影响[J].中国康复理论与实践, 2009, 15(10):913-915.
[7] 艾厚喜,李蕾,许栋明,等.莫诺苷对局灶性脑缺血再灌注大鼠皮层总抗氧化能力影响[J].中国康复理论与实践, 2009, 15(9): 833-834.
[8] 艾厚喜,汪莹,许栋明,等.莫诺苷对局灶性脑缺血再灌注大鼠皮层IL-1β的影响[J].中国康复理论与实践, 2010, 16(10):928-930.
[9] 汪莹,高东明,许栋明,等.莫诺苷对局灶性脑缺血再灌注大鼠Caspase-3 活化程度的影响[J].中国康复理论与实践, 2010,16(9): 801-802.
[10] 左玮,王晓锋,艾厚喜,等.莫诺苷对二磷酸腺苷诱导兔血小板聚集后血栓素B2的影响[J].中国康复理论与实践, 2012, 18(4): 329-330.
[11] 孙盼莉,魏守蓉,王晓锋,等.莫诺苷对二磷酸腺苷诱导兔血小板聚集后环氧酶的影响[J].中国康复理论与实践, 2012, 18(4): 331-332.
[12] 艾厚喜,左玮,王晓锋,等.莫诺苷对二磷酸腺苷诱导兔血小板聚集钙离子的影响[J]. 中国康复理论与实践,2012, 18(2): 131-133.
[13] 程华,孙芳玲,王晓锋,等.莫诺苷对二磷酸腺苷诱导局灶性脑缺血再灌注大鼠血小板聚集的影响[J]. 中国康复理论与实践, 2013, 19(2): 101-103.
[14] Longa EZ, Weinstein PR, Carlson S,etal. Reversible middlecerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989, 20(1): 84-91.
[15] Wu MV,Hen R.The Young and the Restless: Regulation of Adult Neurogenesis by Wnt Signaling[J]. Cell Stem Cell,2013,12(2):139-140.
[16] MacDonald BT, Tamai K, He X.Wnt/beta-catenin signaling: components, mechanisms, and diseases[J].Dev Cell,2009,17(1):9-26.
[17] 左玮,王起忠,王文,等.Wnt 信号对神经发生和血管新生的调控[J] .中国康复理论与实践,2011,17( 3):243-246.
[18] Viti, J., Gulacsi, A., Lillien, L., 2003. Wnt regulation of progenitor maturation in the cortex depends on Shh or fibroblast growth factor 2[J]. J. Neurosci. 23, 5919-5927.
[19] Enrique M. Toledo, Marcela Colombres,etal. Inestrosa,Wnt signaling in neuroprotection and stem cell differentiation[J].Progress in Neurobiology, 2008, (86): 281-296.
[20] Sierra J, Yoshida T, Joazeiro CA,etal.The APC tumor suppressor counteracts beta-catenin activation and H3K4 methylation at Wnt target genes[J].Genes Dev., 2006,20(5):586-600.
[21] Rina Rosin-Arbesfeld,AdamCliffe,Thomas Brabletz,etal.Nucear export of the APC tumour suppressor controls β-catenin function in transcription[J]. EMBO J,2003,22(5):1101-1113.
[22] Jin K,Wang X,Xie L,etal. Transgenic ablation of double cortin-expressing cells suppresses adult neurogenesis and w orsens stroke outcome in mice[J]. Proc Natl Acad Sci U S A,2010,107( 17) : 7993-8001.
[23] 李慧,黄景阳,陈海丽,等. 脑缺血再灌注后大鼠海马Wnt7b的表达[J]. 山东大学学报(医学版),2013,52(2):7-11.
