岷江干旱河谷造林对土壤微生物群落结构的影响
2014-08-08王卫霞史作民李东胜唐敬超刘世荣刘千里何建社
王卫霞, 罗 达, 史作民,*, 李东胜, 唐敬超, 刘世荣, 刘千里, 何建社
(1. 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京 100091;2. 新疆农业大学林学与园艺学院,乌鲁木齐 830052; 3. 四川省阿坝州科学技术研究院林科所,汶川 623000)
岷江干旱河谷造林对土壤微生物群落结构的影响
王卫霞1,2, 罗 达1, 史作民1,*, 李东胜1, 唐敬超1, 刘世荣1, 刘千里3, 何建社3
(1. 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京 100091;2. 新疆农业大学林学与园艺学院,乌鲁木齐 830052; 3. 四川省阿坝州科学技术研究院林科所,汶川 623000)
为了探讨不同造林时间和立地条件对土壤微生物群落结构的影响,采用磷脂脂肪酸(PLFAs)法测定了岷江干旱河谷地区不同造林时间(2002、2006和2011年)及不同立地条件(退耕地和宜林荒山地)营建的岷江柏人工林土壤微生物生物量及群落结构的变化情况。结果表明:由于造林时间较短,不同造林时间的人工林间土壤化学性质没有差异,但土壤微生物生物量和各菌群生物量差异显著,且随着造林时间的增加而增加。不同立地条件下则表现为退耕还林地土壤微生物生物量和各菌群生物量较高。说明土壤微生物对外界因素变化的反映更灵敏。相关性分析结果显示土壤全氮含量与土壤微生物生物量及各菌群生物量显著相关,是影响土壤微生物群落结构的关键因素。
土壤微生物;磷脂脂肪酸;造林;立地条件;干旱河谷
岷江干旱河谷是我国西南地区典型的生态脆弱区,常年来由于受自然地理因素和人类活动的影响,造成该区水土流失严重[1- 2]。因此,以往对岷江干旱河谷的研究更多的是关注该区的植被恢复和生态重建问题[3- 4],对在植被恢复和重建中具有重要作用的土壤的研究则相对较少,特别是从土壤微生物群落结构的角度探讨该区域不同造林时间和立地条件对土壤生态系统影响的研究则更为鲜见。土壤是陆地生态系统中物质循环、能量转换和信息传递的核心区域,而土壤微生物是土壤生态系统的重要组成部分,在有机质的形成和分解、养分循环与转化、土壤肥力演替等方面起重要作用[5]。围绕造林与植被恢复重建对土壤微生物的影响国内外已开展了一些研究,Cao等[6]采用磷脂脂肪酸法研究了我国南亚热带地区不同造林时间的桉树人工林土壤微生物群落结构的差异,胡婵娟等[7]研究了黄土丘陵沟壑区不同植被类型对土壤微生物的影响。而Wardle 和Blouin等[8- 9]研究认为土壤微生物既受地上植被的影响,又通过其自身性质的改变反过来作用于植被,与植被形成相互作用的反馈体系。土壤中微生物生物量越高,微生物群落活跃程度越高,一定程度上代表着土壤具有越强的物质循环能力和支持植被生长发育的养分供应能力。研究植被恢复不同年限和不同土地利用方式下土壤微生物特征的差异性对于提高土壤肥力,合理和可持续地利用土壤资源具有重要意义[10- 11]。
本文通过对岷江干旱河谷区不同造林时间的岷江柏(Cupressuschengiana)人工林及不同立地条件下的岷江柏人工林土壤微生物生物量和微生物群落结构组成进行研究,旨在揭示不同立地条件及不同造林时间的人工林对土壤微生物的影响,进而探索植被与土壤系统的关系,为该区植被恢复状况的评价提供理论依据。
1 研究方法
1.1 研究区自然概况
研究地点位于四川省阿坝藏族羌族自治州理县熊耳山林区,该区是典型的岷江干旱河谷区,属于典型的高山峡谷区。该地区年均气温约12℃,全年日照时数在1200—2000h,年均降水量为584mm,年均蒸发量为1399mm,蒸发量约为降雨量的2.4倍[12]。该区土壤主要以山地燥褐土为主[13]。天然林保护工程和退耕还林还草工程实施以来,该区森林全面禁伐封育,部分退耕地也进行了人工造林,形成了次生林、不同造林时间的人工林、退耕还林地和由林地开垦而来的农地等多样的土地利用类型。
1.2 实验设计和野外样品采集
在较平缓的地段,选择坡向和土壤类型基本相同但造林时间差异的2002年岷江柏人工林(1)、2006年岷江柏人工林(2)和2011年岷江柏人工林(3),它们均是在宜林荒山上营造的人工林。另外,选取林龄相似或相同但立地条件不同的2003年岷江柏人工林(4)和2005年岷江柏人工林,其中2003年岷江柏人工林为退耕地上营造的人工林,2005年岷江柏人工林则是在宜林荒山上营造的人工林。由于立地条件及林分长势的差异,将2005年岷江柏人工林又进一步分为下坡长势较差(5)和上坡长势较好(6)两种类型。各造林地林下灌草植被差别并不大,2002年人工林下主要灌木以川甘亚菊(Ajaniapotaninii)、铁杆蒿(Artemisiasacrorum)为优势种,均高为0.47m,灌木总盖度约为59%;草本则主要以披针苔草为优势种,均高为0.20m,草本总盖度为22%;2006年人工林下灌木主要以铁杆蒿为优势种,均高为0.47m,灌木总盖度约为62%;草本则主要以细柄草(Capillipediumparviflorum)为优势种,均高为0.37m,草本总盖度为40%;2011年人工林下灌木主要以铁杆蒿为优势种,均高为0.40m,灌木总盖度约为64%;草本则主要以披针苔草为优势种,均高为0.17m,草本总盖度为20%; 2003年人工林下灌木主要以铁杆蒿、光果莸(Caryopteristangutica)为优势种,均高为0.53m,灌木总盖度约为30%;草本则主要以细柄草为优势种,均高为0.11m,草本总盖度为28%;2005年人工林下灌木主要以白刺花(Sorphoradavidi)为优势种,均高为0.47m,灌木总盖度约为57%;草本则主要以糙野青茅(Deyeuxiascabrescens)为优势种,均高为0.36m,草本总盖度为40%。各样地岷江柏生长情况和样地的基本情况见表1。
2012年9月,在每种人工林地中按坡位上、中、下分别随机设置4个20m × 20m的样地。每个样地内,按梅花布点采用5点混合取样法,取0—20cm土壤立即装入冷藏箱,于当日带回实验室。挑出土壤样品中大的石砾、植物根系等杂物后,过2mm筛,分两份装入袋内,一份置于4℃低温储存,用于土壤微生物生物量碳(MBC)和微生物生物量氮(MBN)的测定以及土壤pH、养分含量等的测定;另一份置于-20℃冷冻储存,用于PLFAs的测定。
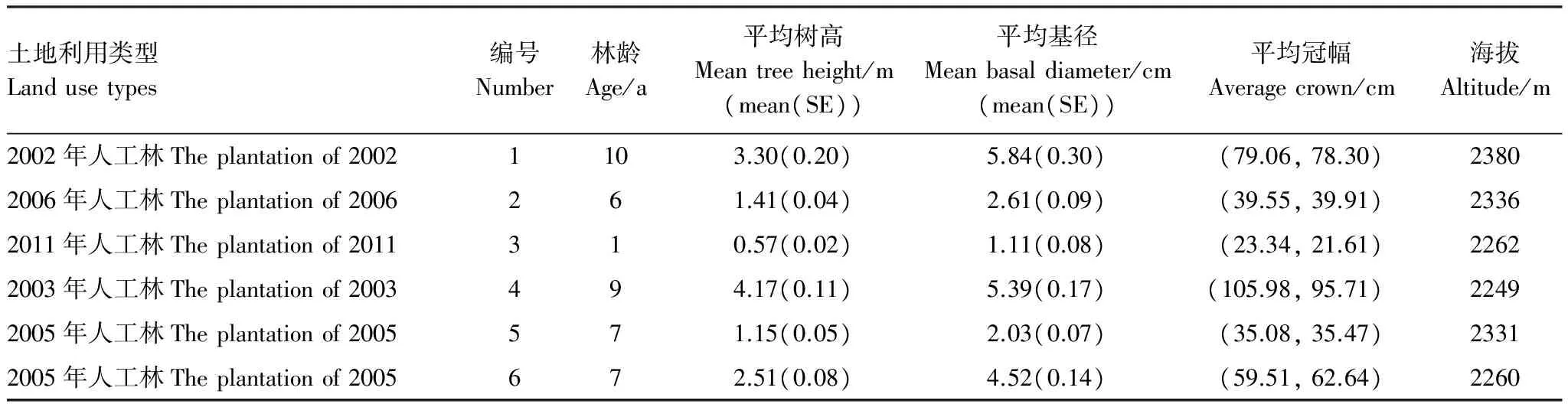
表1 林分基本情况
1.3 样品分析
1.3.1 土壤化学性质的测定
土壤pH值的测定采用玻璃电极进行测定;土壤有机碳(SOC)含量采用重铬酸钾外加热法测定;土壤全氮(TN)采用凯氏定氮法进行测定;全磷(TP)采用钼锑抗比色法测定;全钾(TK)含量采用原子吸收分光光度计法测定[14]。
1.3.2 微生物生物量碳、氮测定
土壤微生物生物量碳(MBC)和土壤微生物生物量氮(MBN)的测定采用氯仿熏蒸浸提法测定[15],其中熏蒸处理为25℃真空条件下培养48h,提取过程浸提液采用0.5mol L-1K2SO4。分别采用全有机碳自动分析仪(TOC-VCPH 全有机碳自动分析仪)测定上述浸提方法得到的滤液中的有机碳和全氮。MBC(mg/kg)和MBN(mg/kg)分别由下式求得[16- 17]:
MBC=EC×2.22
MBN=EN×2.22
式中,EC、EN分别为熏蒸与未熏蒸土样浸提液中有机碳、全氮的差值;2.22为校正系数。
1.3.3 微生物群落结构组成的测定
土壤微生物群落结构组成的测定采用磷脂脂肪酸法(PLFAs)。采用的方法是Bossio和Scow[18]在Bligh和Dyer[19]的方法基础上修正而来。具体步骤如下:称取相当于8g干土重的鲜土(土壤过2mm筛后,人工挑出残存的根、凋落物碎屑及小石粒),加入甲醇-氯仿-磷酸缓冲液(2∶1∶0.8),置于35mL Teflon瓶中振荡2h。然后在25℃下,离心10min(2500r/min)。加入12mL CHCl3和12mL磷酸缓冲液到分离漏斗。同时将离心上清液倒入分离漏斗。对于离心后的样品,加23mL提取液于离心管中的剩余土壤中,涡流搅拌并在振荡器上摇动0.5h,然后在25℃下,离心10min(2500r/min)。将离心上清液倒入对应的分离漏斗。摇动分离漏斗2min,静置过夜。第2天打开漏斗活塞,将分离漏斗中的下层溶液放入大口径的长玻璃试管,在30—32℃的水浴中用N2吹干氯仿浓缩磷脂,然后转入硅胶柱(BondElut; Varian, Palo. Alto, CA)。分别用氯仿,丙酮和甲醇冲洗硅胶柱,弃去氯仿和丙酮洗出液(分别是糖脂脂肪酸和中性脂肪酸)。甲醇洗出液即含有磷脂脂肪酸的液体。将甲醇洗出液吹干(N232℃),依次加入1mL甲醇-甲苯(1∶1 mol/L)和1mL 0.2mol/L KOH甲醇溶液,振荡混匀,37℃水浴15min,冷却后加入0.3mL醋酸,2mL正己烷和2mL去离子水,在低速下振荡10min,用移液枪将上层移至一次性螺口小管。再加2mL正己烷,摇动10min后再用移液枪将上层移至对应的螺口小管中。最后用N2吹干。然后用加有内标(C19:0)的正己烷溶解后,用安捷伦6890气相色谱仪(Hewlett-Packard 6890,安捷伦,美国)进行测定。
计算细菌和真菌等PLFAs的绝对(nmol/g干重)和相对(mol%)浓度。以每种磷脂脂肪酸的百分比反映各样品中细菌、真菌和放线菌等的相对含量。以磷脂脂肪酸的总浓度(nmol/g干重)表示微生物的生物量[20- 22]。
在本研究中,14:0, i14:0, i15:0, a15:0, 15:0, i16:0, 16:1ω7c, 10Me16:0, i17:0, a17:0, 17:0, cy17:0, 10Me17:0, 18:1ω7c, cy19:0用来指示细菌[23],i14:0, i15:0, a15:0, i16:0, a17:0 和 i17:0 用来指示革兰氏阳性菌(G+),14:0, 15:0, 16:1ω7c, 17:0, cy17:0 和 cy19:0 用来指示革兰氏阴性菌(G-)[24],18:2ω6,9c 和 18:1ω9c 用来指示真菌[18,23,25- 26],16:1ω5c用来指示丛枝菌根真菌(AMF)[27]。10Me18:0用来指示放线菌,真菌/细菌比(F/B)用18:2ω6,9c、18:1ω9c的量和各细菌指示物的总量比来计算[23,25,28]。其他种类如16:0, 16:1 2OH, 17:1ω8c 仍然用来计算微生物的总量和群落组成。以上所有提到的各菌群PLFA总和代表本研究区域微生物群落总的PLFAs量。
1.4 数据处理
进行单因素方差分析(ANOVA),检验不同造林时间和不同立地条件间土壤微生物生物量、各种脂肪酸含量等的差异显著性。显著性水平设置为p<0.05,所有统计用SPSS18.0完成。用主成分分析(PCA)来检验土壤微生物组成的差异性。图在Sigmaplot10.0软件下完成。
2 结果与分析
2.1 造林对土壤化学性质的影响
表2是几种不同造林时间和不同立地条件下0—20cm土层土壤化学性质的情况。从表2可以看出,不同造林时间的岷江柏人工林随造林时间的增加,其土壤有机碳(SOC)和全氮(TN)含量呈增加的趋势,但不同造林时间的人工林间无显著差异(P>0.05)。pH值随造林时间的增加呈降低的趋势,其中2002年岷江柏人工林土壤pH值显著低于2011年岷江柏人工林(P<0.05)。不同立地条件对土壤pH、SOC、TN和TK的影响则均不显著(P>0.05),但仍表现为退耕还林地上营建的人工林(样地4)土壤SOC和TN含量高于宜林荒山上营造的人工林(样地5和样地6)。
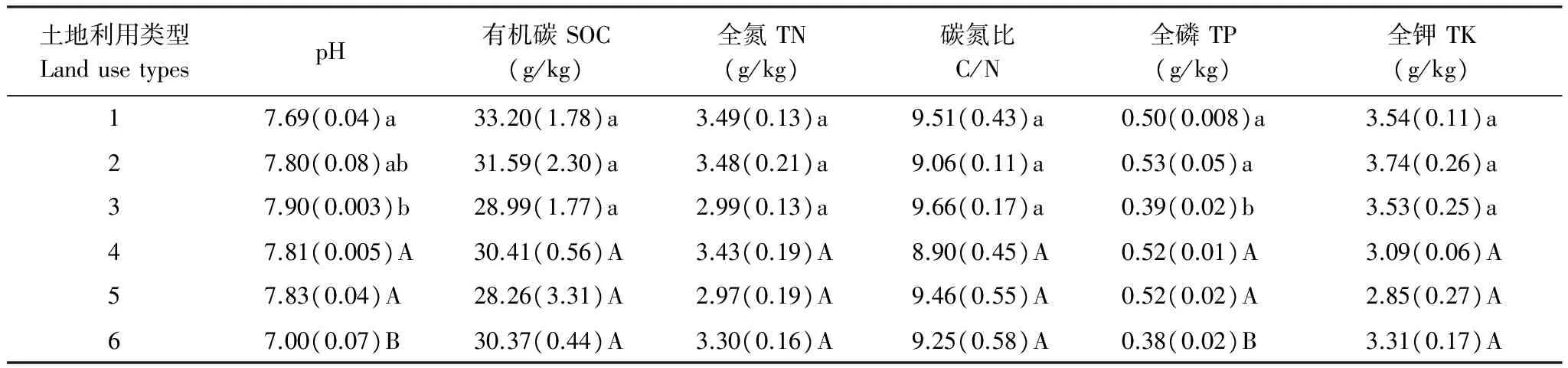
表2 不同造林时间及不同立地条件人工林土壤化学性质
同列不同小写字母代表不同造林时间的人工林间的差异显著(P< 0.05), 不同大写字母代表不同立地条件人工林间的差异显著(P<0.05)
2.2 造林对土壤微生物生物量和微生物群落结构的影响
2.2.1 造林对土壤微生物生物量的影响
不同造林时间和不同立地条件下土壤中微生物生物量碳和微生物生物量氮如表3所示,土壤中微生物生物量碳、氮含量均随着造林时间的增加而增加,其中2002年岷江柏人工林土壤中微生物生物量碳、氮含量显著高于2006年和2011年岷江柏人工林。而不同立地条件对土壤微生物生物量碳的影响均不显著,但土壤微生物生物量碳、氮含量均表现为退耕地上营造的人工林土壤中的含量较高(表3)。
2.2.2 造林对土壤微生物群落结构的影响
由表3可以看出,土壤中各类磷脂脂肪酸含量(总PLFAs、总G+PLFAs、总G-PLFAs、总细菌PLFAs、总真菌PLFAs、丛枝菌根真菌PLFAs和放线菌PLFAs)总体上随着造林时间的增加而增加,其中2002年岷江柏人工林土壤中各类磷脂脂肪酸含量要显著高于2011年岷江柏人工林下的土壤(P<0.05)。不同立地条件下则表现为退耕还林地土壤中的总PLFAs、总G+PLFAs、总细菌PLFAs和总真菌PLFAs显著高于宜林荒山上营造的岷江柏人工林土壤(P<0.05),而总G-PLFAs、丛枝菌根真菌PLFAs和放线菌PLFAs均无显著差异。无论是不同造林时间还是不同立地条件下,土壤中微生物总磷脂脂肪酸含量和微生物生物量碳分布均较一致。
不同造林时间及不同立地条件下,土壤中具体的各种磷脂脂肪酸含量也存在着差异(图1和图2),G+菌的单种PLFA(i15:0、i17:0和a17:0)含量,G-菌的单种PLFA(14:0、15:0、17:0和cy19:0)含量,真菌PLFA(18:1ω9c和18:2ω6,9c)含量以及丛枝菌根真菌PLFA(16:1ω5c)的含量在不同造林时间的人工林土壤中均存在显著的差异。在不同立地条件下,则表现为G+菌的单种PLFA(i14:0、a15:0)含量,G-菌的单种PLFA(15:0、16:1ω7c、cy17:0和cy19:0)含量,细菌PLFA(10Me16:0、10Me17:0、18:1ω7c),真菌PLFA(18:1ω9c)含量以及放线菌PLFA(10Me18:0)的含量存在显著的差异(P<0.05)。G+/G-无论在不同造林时间还是在不同立地条件的人工林土壤中均表现为差异不显著(表3)。真菌/细菌(F/B)比值在不同立地条件下的土壤中表现为差异显著(P<0.05)。
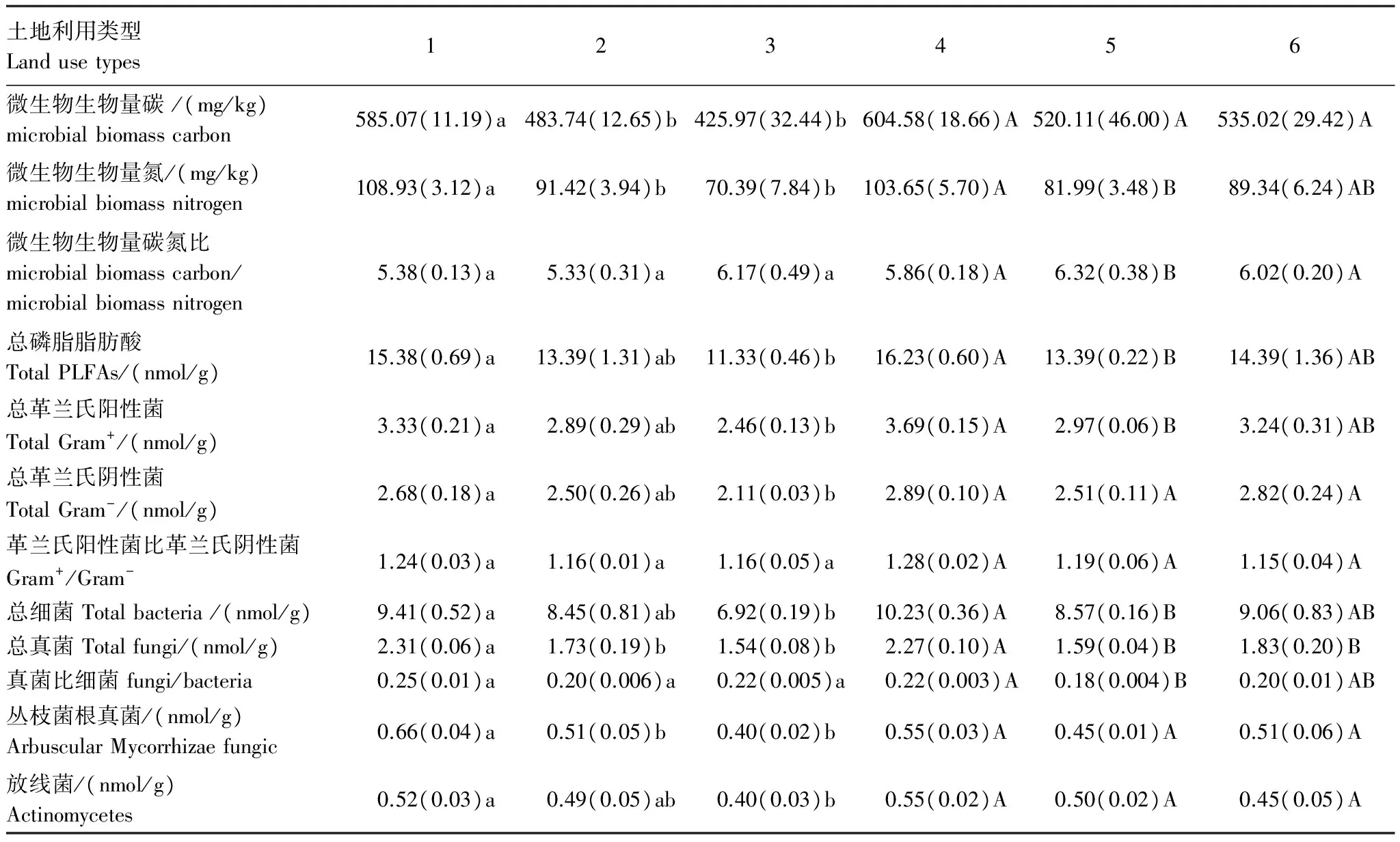
表3 各样地土壤微生物生物量及各类群磷脂脂肪酸含量
不同小写字母代表不同造林时间的人工林间的差异显著(P< 0.05), 不同大写字母代表不同立地条件人工林间的差异显著(P< 0.05)
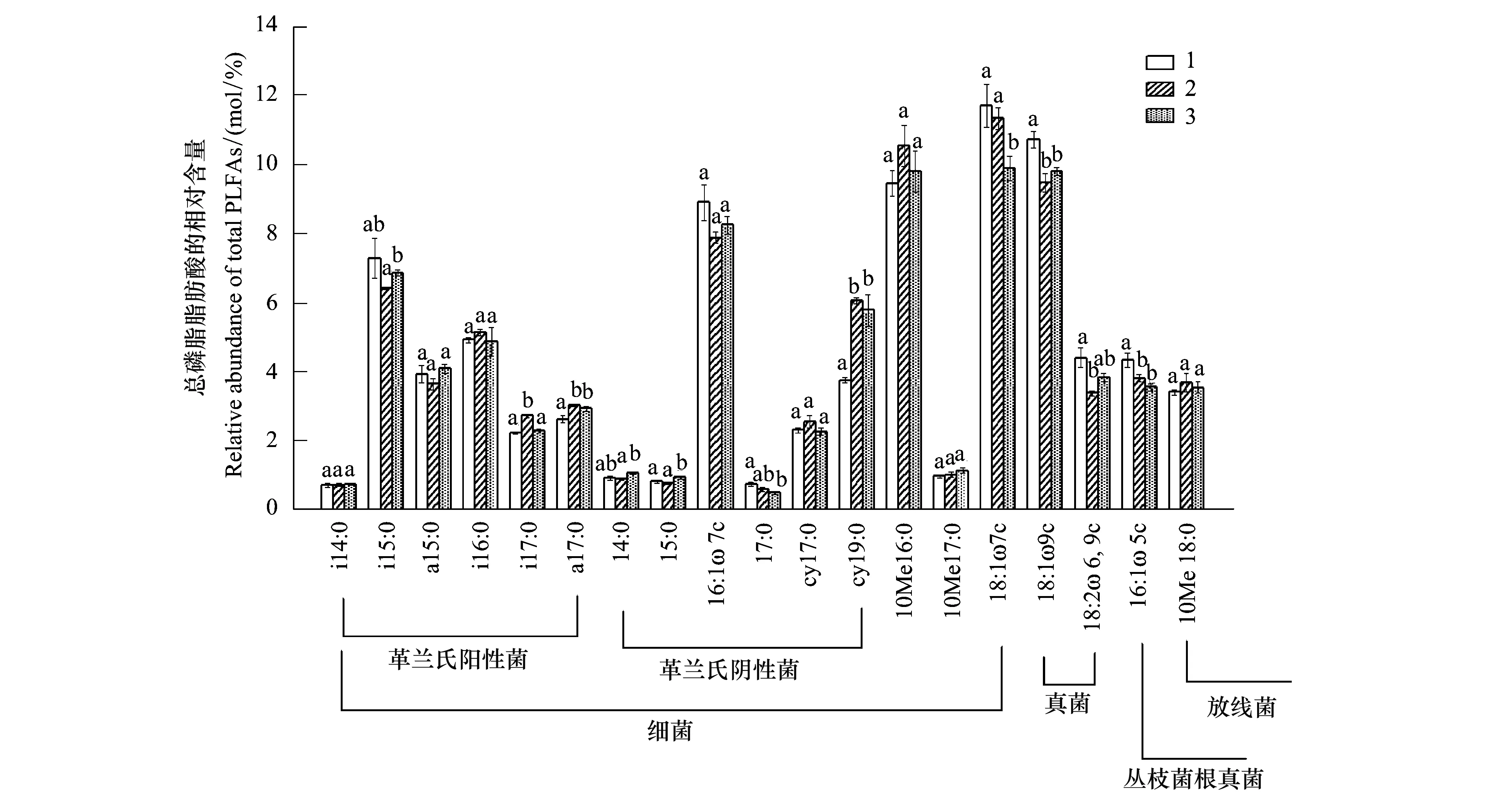
图1 不同造林时间的人工林土壤中各种磷脂脂肪酸的相对含量Fig.1 Relative abundances of individual PLFAs in soil of the plantations with different years
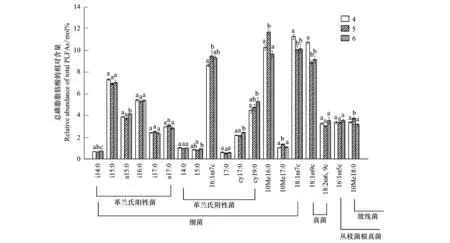
图2 不同立地条件下的人工林土壤中各种磷脂脂肪酸的相对含量Fig.2 Relative abundances of individual PLFAs in soil of the plantations with different site conditions
对不同造林时间和不同立地条件的几种人工林土壤中所提取的22种磷脂脂肪酸进行主成分分析,结果表明不同造林时间和不同立地条件对土壤微生物群落结构具有不同程度的影响(图3),第一主成分对微生物群落结构差异的贡献值是69.8%,第二主成分的贡献值是9.9%。不同造林时间的3种岷江柏人工林(1,2和3号样地)中1号样地(2002年人工林)和3号样地(2011年人工林)沿第一主成分轴明显的分离开,1号样地(2002年人工林)和2号样地(2006年人工林)则沿第二主成分轴明显的分离开,而不同立地条件下的3种岷江柏人工林(4,5和6号样地)中则是4号样地(退耕还林地)和5号样地(宜林荒山上营造的人工林)沿第一主成分轴明显的分离开,而5号样地(宜林荒山上营造的人工林,下坡长势较差)和6号样地(宜林荒山上营造的人工林,上坡长势较好)沿第一、第二主成分值轴的分离程度均不明显。因此,也可以看出在本研究区不同造林时间对土壤微生物群落结构的影响可能更大。
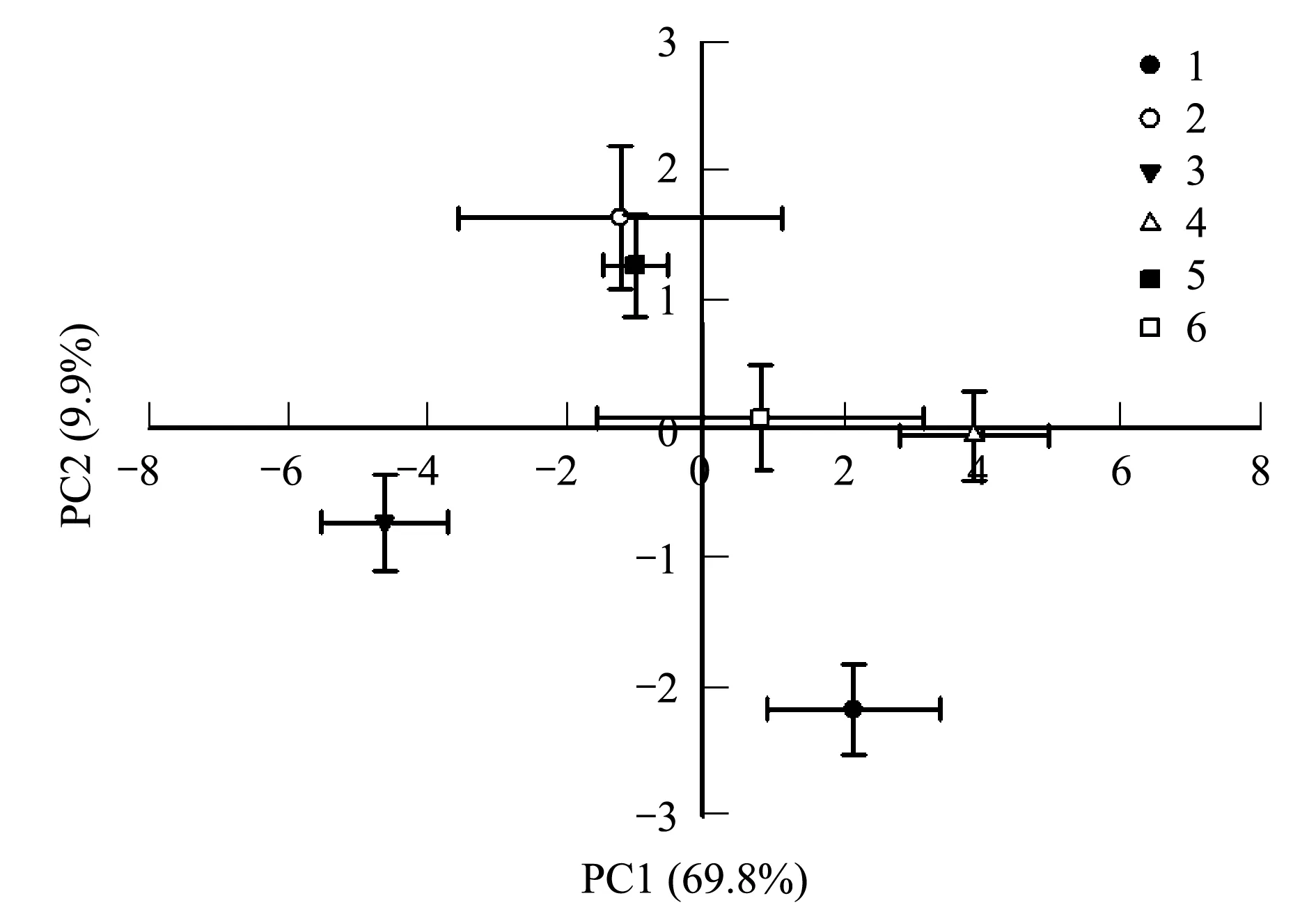
图3 不同造林时间和立地条件磷脂脂肪酸结构的主成分分析Fig.3 Principal Component Analysis of PLFAs structures in the plantations with different years or site conditions
2.3 土壤各菌群PLFAs与土壤化学性质的关系
由表4可以看出,PLFA标识的G+、总细菌、总真菌以及总PLFAs均与土壤MBC极显著相关,说明PLFA分析方法和氯仿熏蒸浸提法之间有很好的一致性。
各菌群PLFA与土壤化学性质相关性分析表明(表4),土壤G-与土壤pH值呈显著负相关。土壤总真菌及丛枝菌根真菌(AMF)与土壤有机碳达到了显著正相关的水平,而土壤全氮对土壤微生物群落结构的影响则更显著,土壤总PLFAs、G+、G-、总细菌、总真菌、AMF、放线菌、MBC和MBN均与土壤全氮呈显著正相关,尤其是土壤总PLFAs、总真菌和AMF与土壤全氮相关水平更是达到了极显著相关,说明在这一地区,土壤全氮含量是影响土壤微生物群落结构的关键因素。此外,土壤总PLFAs、总细菌和放线菌与土壤全磷也达到了显著正相关水平,说明在这一地区土壤全磷含量对土壤微生物生物量的影响也较大。
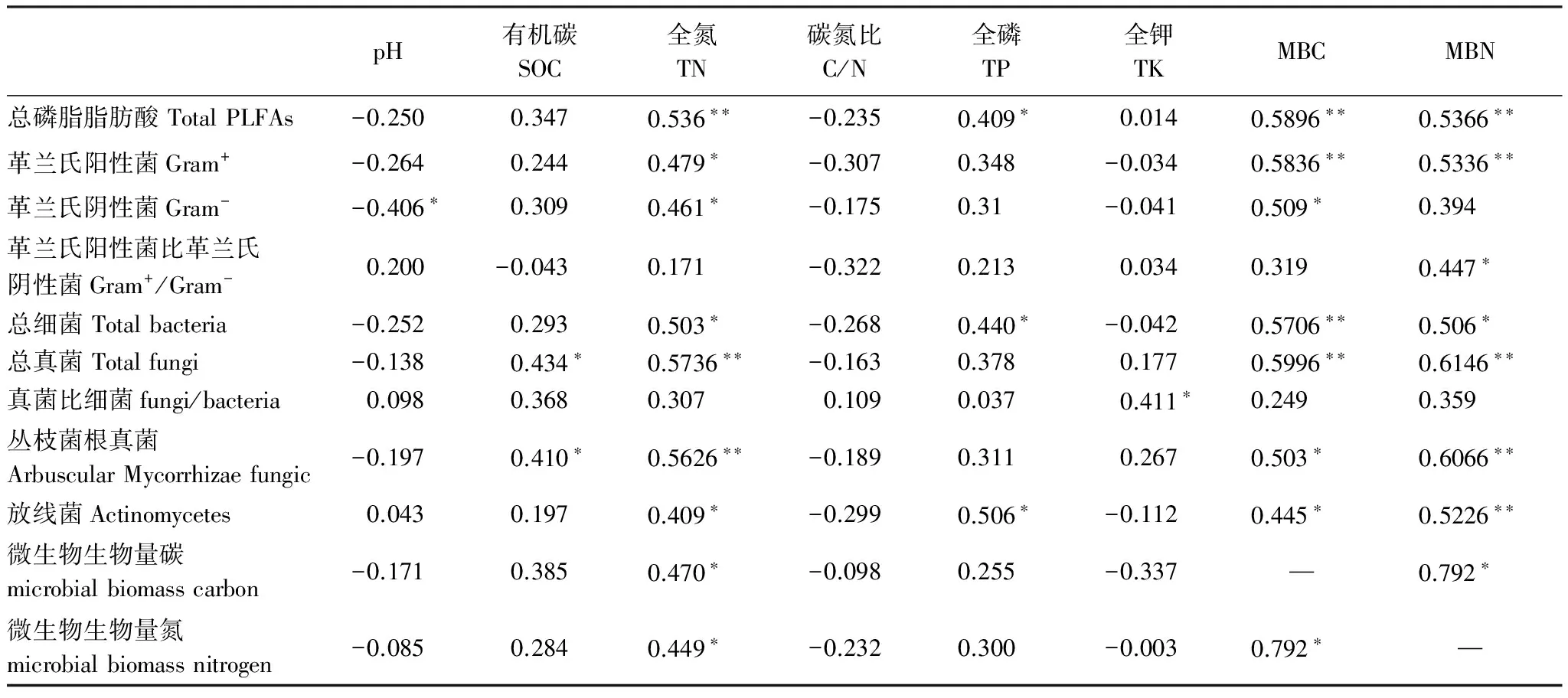
表4 土壤性质与各种微生物脂肪酸间的Pearson相关分析
3 讨论与结论
土地利用变化后,可以改变地表覆被状况并影响许多生态过程,例如土壤有机碳的输入、输出及土壤的化学性质和过程等。造林作为土地利用方式的一种,它可以影响土壤的物理、化学以及生物学性质,因此,了解不同土地利用方式导致土壤理化性质的差异,是合理利用土地资源改进土地利用方式发展持续林业的前提[29]。黄懿梅[30]对黄土丘陵区植被恢复过程中土壤化学性质的演变的研究发现,在植被恢复过程中,土壤有机碳和全氮含量呈逐渐增加的趋势。彭文英等[31]和Garcia等[32]也认为随着植被恢复时间的增加,土壤结构不断得到改善,土壤有机质、全碳、全氮以及主要离子含量呈明显增加趋势。本研究中随着造林时间的增加,土壤有机碳和全氮含量呈逐渐增加的趋势,但没有达到显著水平,这可能和造林时间较短有关。
土壤化学性质需要经历很长时间才能发生显著变化,因此土壤化学性质作为土壤质量指标有时并不能评价土壤管理和土地利用的短期影响[30]。Fitter等[33]认为,土壤中的生物是维持土壤质量的重要组成部分,土壤生物学性质能快速和准确地反映土壤系统微小的改变[34]。而且很多研究者研究表明,土壤微生物生物量周转周期短,能够快速地反映环境因子、土地利用方式和生态功能等的变化过程,而土壤微生物生物量碳是土壤有机质中最为活跃的部分,可以敏感地反映出土壤有机碳的变化[35- 36];微生物生物量氮是土壤活性氮素的重要储备库,是植物氮营养的重要来源[37]。因此,土壤微生物生物量是反映土壤系统健康和土壤质量的重要生物学指标,可以敏感地反映管理措施和人为干扰等对土壤生态系统的影响程度[38- 39]。本研究选择的岷江柏是研究区典型的人工造林植被恢复树种,由于造林时间较短,不同造林时间和不同立地条件的人工林土壤化学性质存在差异,但均未达到显著水平,而土壤微生物生物量则存在显著差异,这说明微生物对外界因素变化的反映更灵敏。这和前人的研究结果一致[40- 44]。
土壤微生物群落组成在不同造林时间和不同立地条件下的人工林中显著不同,随着造林时间的增加,G+、G-、总B、总F和放线菌均呈显著地增加;而不同立地条件下则表现为退耕还林地土壤具有较高的G+、总B、总F和F/B。造成这种差异的原因可能是:随着造林时间的增加(植被逐渐恢复的过程),养分流失逐渐降低和有机物质的大量输入为微生物生长提供了更多的营养物质,从而促进了微生物生物量及各菌群生物量的提高[40];而退耕还林地土壤具有较高的G+、总B、总F和F/B,原因可能是退耕还林地在退耕之前残留有大量的作物根系和施肥等人为活动,使之表层土壤较宜林荒山土壤具有丰富的养分含量,加之耕地营造岷江柏人工林后,由原来开放或半开放的农田生态系统物质循环结构转变为封闭或半封闭的人工林生态系统物质循环结构后,土壤的营养成分、水分和植物残体等物质重新返回到生态系统中,为退耕后的养分补给和改善提供了充足的物质来源,尤其是微生物生物量的增加,加速了土壤物质代谢能力和促进了养分的积累[43]。植被恢复过程中,土壤养分与土壤微生物生物量的关系密切[45],本研究中土壤微生物生物量及各菌群生物量与土壤TN含量达到显著相关水平,由此可以看出,氮是该区微生物生长的主要限制因子。
[1] Liu X L, Mu C L, Xiang C H, Su Y M. Natural features of Arid River Valleys in Western Sichuan and their vegetation restoring and reestablishing ways. Journal of Sichuan Forestry Science and Technology, 2001, 22(2): 10- 17.
[2] Zheng L. An analysis of causes of dry-hot valley in Sichuan. Journal of Sichuan Geography, 1982, 4(28): 10.
[3] Bao W K, Cheng Q H, Liu Z G. Degradation of mountain ecosystem in the upper reaches of minjiang river and coutermeasures for their rehabilitation and reconstruction. Rescources and Environment in the Yangtze Valley, 1995, 4(3): 277- 282.
[4] Bao W K, Chen Q H, Chen K M. Environment control techniques for vegetation restoration in dry valley of upper reaches of Minjiang River. Chinese Journal of Applied Ecology, 1999,10 (5): 542- 544.
[5] Harris J A, Birch P. Soil microbial activity in opencast coal mine restorations. Soil Use and Management, 1989, 5(4): 155- 160.
[6] Cao Y S, Fu S L, Zou X M, Cao H L, Shao Y H, Zhou L X. Soil microbial community composition under Eucalyptus plantations of different age in subtropical China. European Journal of Soil Biology, 2010, 46(2): 128- 135.
[7] Hu C J, Liu G H, Chen L D, Wu Y Q. Seasonal variations of soil microbial biomass carbon and nitrogen on the hill slope in hilly areas of Loess Plateau. Chinese Journal of Ecology, 2011, 30(10):2227- 2232.
[8] Wardle D A. The influence of biotic interactions on soil biodiversity. Ecology Letters, 2006, 9(7): 870- 886.
[9] Blouin M, Zuily-Fodil Y, Pham-Thi A T, Laffray D, Reversat G, Pando A, Tondoh J, Lavelle P. Belowground organism activities affect plant aboveground phenotype, inducing plant tolerance to parasites. Ecology Letters, 2005, 8(2): 202- 208.
[10] Dinesh R, Ghoshal Chaudhuri S, Ganeshamurthy A N, Dey C. Changes in soil microbial indices and their relationships following deforestation and cultivation in wet tropical forests. Applied Soil Ecology, 2003, 24(1): 17- 26.
[11] Powers J S. Changes in soil carbon and nitrogen after contrasting land-use transitions in northeastern Costa Rica. Ecosystems, 2004, 7(2): 134- 146.
[12] Shi G. Effects of different altitudes on growth condition ofCupressuschengianain the Arid River Valleys in the Upper Reaches of the Minjiang River. Journal of Sichuan Forestry Science and Technology, 2011, 32(6): 88- 92.
[13] Yang C X, Heng L, He F, Jia C, Long H Z. The present state on Lixian plantation resources and its management strategy. Journal of Sichuan Forestry Science and Technology, 2010, 31(4): 76- 80.
[14] Liu G S. Observation and standard analysis method of Chinese Ecosystem Research Network: Physiochemical analysis and profile description of soil. Beijing: China Standard Press, 1996.
[15] Lin Q M, Wu Y G, Liu H L. Modification of fumigation extraction method for measuring soil microbial biomass carbon. Chinese Journal of Ecology, 1999, 18(2): 63- 66.
[16] Wu J, Joergensen R G, Pommerening B, Chaussod R, Brookes P C. Measurement of soil microbial biomass C by fumigation-extraction-an automated procedure. Soil Biology and Biochemistry, 1990, 22(8): 1167- 1169.
[17] Joergensen R G, Brookes P C. Ninhydrin-reactive nitrogen measurements of microbial biomass in 0.5 m K2SO4soil extracts. Soil Biology and Biochemistry, 1990, 22(8): 1023- 1027.
[18] Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities: phospholipid fatty acid profiles and substrate utilization patterns. Microbial Ecology, 1998, 35(3): 265- 278.
[19] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification. Canadian journal of biochemistry and physiology, 1959, 37(8): 911- 917.
[20] Frostegård Å, Tunlid A, Bååth E. Microbial biomass measured as total lipid phosphate in soils of different organic content. Journal of Microbiological Methods,1991, 14(3): 151- 163.
[21] Moore-Kucera J, Dick R P. PLFA profiling of microbial community structure and seasonal shifts in soils of a Douglas-fir chronosequence. Microbial Ecology,2008, 55(3): 500- 511.
[22] Zak D R, Ringelberg D B, Pregitzer K S, Randlett D L, White D C, Curtis P S. Soil microbial communities beneath Populus grandidentata grown under elevated atmospheric CO2. Ecological Applications, 1996, 6(1): 257- 262.
[23] Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils, 1996, 22(1/2): 59- 65.
[24] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils, 1999, 29(2): 111- 129.
[25] Bååth E, Anderson T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques. Soil Biology and Biochemistry, 2003, 35(7): 955- 963.
[26] Högberg M N, Högberg P, Myrold D D. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three? Oecologia, 2007, 150(4): 590- 601.
[27] Olsson P A. Signature fatty acids provide tools for determination of the distribution and interactions of mycorrhizal fungi in soil. FEMS Microbiology Ecology, 1999, 29(4): 303- 310.
[28] Bardgett R D, Hobbs P J, Frostegård Å. Changes in soil fungal: bacterial biomass ratios following reductions in the intensity of management of an upland grassland. Biology and Fertility of Soils, 1996, 22(3): 261- 264.
[29] Fu B J, Ma K M, Zhou H F, Chen L D. The effects of different land use patterns on distribution of soil nutrients in the loess hilly-gully area. Chinese Science Bulletin, 1998, 43(22): 2444- 2448.
[30] Huang Y M. Soil microbial indices response to vegetation natural rehabilitation on the loess hilly-gully area. Northwest A & F University, PhD thesis.
[31] Peng W Y, Zhang K L, Chen Y, Yang Q K. Research on soil quality change after returning farmland to forest on the loess sloping croplands. Journal of natural resources, 2005, 20(2): 272- 278.
[32] Garcia C, Hernandez T, Roldan A, Martin A. Effect of plant cover decline on chemical and microbiological parameters under Mediterranean climate. Soil Biology and Biochemistry, 2002, 34(5): 635- 642.
[33] Fitter A H, Gilligan C A, Hollingworth K, Kleczkowski A, Twyman R M, Pitchford J W. Biodiversity and ecosystem function in soil. Functional Ecology, 2005, 19(3): 369- 377.
[34] Pascual J A, Garcia C, Hernandez T, Moreno J L, Ros M. Soil microbial activity as a biomarker of degradation and remediation processes. Soil Biology and Biochemistry, 2000, 32(13): 1877- 1883.
[35] Brookes P C. The use of microbial parameters in monitoring soil pollution by heavy metals. Biology and Fertility of Soils, 1995, 19(4): 269- 279.
[36] Song Q H, Li F M, Liu H S, Wang J, Li S Q. Effect of plastic film mulching on soil microbial biomass in spring wheat field in semi-arid loess area. Chinese Journal of Applied Ecology, 2003, 14(9): 1512- 1516.
[37] Schutter M E, Dick R P. Microbial community profiles and activities among aggregates of winter fallow and cover-cropped soil. Soil Science Society of American Journal, 2002, 66(1): 142- 153.
[38] Gil-Sotres F, Trasar-Cepeda C, Leirós M C, Seoane S. Different approaches to evaluating soil quality using biochemical properties. Soil Biology and Biochemistry, 2005, 37(5): 877- 887.
[39] Smith J L, Paul E A. The significance of soil microbial biomass estimations. Soil biochemistry, 1990, 6: 357- 396.
[40] Hu C J, Fu B J, Jin T T, Liu G H. Effects of vegetation restoration on soilm icrobial biomass carbon and nitrogen in hilly areas of Loess P lateau. Chinese Journal of Applied Ecology, 2009, 20(1): 45- 50.
[41] Liu Z F, Liu G H, Fu B J, Hu H F, Zhang X X, Wu Y Q. Dynamics of soil microbial C, N along restoration chronosequences in pine plantations. Acta Ecologica Sinica, 2007, 27(3): 1011- 1019.
[42] Santruckova H. Microbial biomass, activity and soil respiration in relation to secondary succession. Pedobiologia, 1992, 36(6): 341- 350.
[43] Xue S, Liu G B, Dai Q H, Wei W, Hou X L. Evolution of soil microbial biomass in the restoration process of artificialRobiniapseudoacaciaunder erosion environment. Acta Ecologica Sinica, 2007, 27(3): 909- 917.
[44] Min H, He W X, Li X M, Liu G B, Yang X. Evaluative feature of soil microbial population under plant restored process in Loess Regions. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(3): 588- 593.
[45] Arunachalam A, Pandey H N. Ecosystem restoration of Jhum fallows in Northeast India: microbial C and N along altitudinal and successional gradients. Restoration Ecology, 2003, 11(2): 168- 173.
参考文献:
[1] 刘兴良, 慕长龙, 向成华, 宿以明. 四川西部干旱河谷自然特征及植被恢复与重建途径. 四川林业科技, 2001, 22(2): 10- 17.
[2] 郑霖. 四川干旱河谷的成因分析. 四川地理, 1982, 4(28): 10.
[3] 包维楷, 陈庆恒, 刘照光. 岷江上游山地生态系统的退化及其恢复与重建对策. 长江流域资源与环境, 1995, 4(3): 277- 282.
[4] 包维楷, 陈庆恒, 陈克明. 岷江上游干早河谷植被恢复环境优化调控技术研究. 应用生态学报,1999,10(5): 542- 544.
[7] 胡婵娟, 刘国华, 陈利顶, 吴雅琼. 黄土丘陵沟壑区坡面上土壤微生物生物量碳、氮的季节变化. 生态学杂志, 2011, 30(10):2227- 2232.
[12] 施广. 岷江上游干旱河谷区岷江柏对不同海拔的响应. 四川林业科技, 2011, 32(6): 88- 92.
[13] 杨昌旭, 衡理, 何飞, 贾程, 尤海舟. 理县人工林资源现状及其经营对策. 四川林业科技, 2010, 31(4): 76- 80.
[14] 刘光崧主编. 中国生态系统研究网络观测与分析标准方法—土壤理化分析与剖面描述. 北京: 中国标准出版社, 1996.
[15] 林启美, 吴玉光, 刘焕龙. 熏蒸法测定土壤微生物量碳的改进. 生态学杂志, 1999, 18(2): 63- 66.
[29] 傅伯杰, 马克明, 周华峰, 陈利顶. 黄土丘陵区土地利用结构对土壤养分分布的影响. 科学通报, 1998, 43(22): 2444- 2448.
[30] 黄懿梅. 黄土丘陵区植被自然恢复过程中土壤微生物指标的演变. 西北农林科技大学, 2008,博士学位论文
[31] 彭文英, 张科利, 陈瑶, 杨勤科. 黄土坡耕地退耕还林后土壤性质变化研究. 自然资源学报, 2005, 20(2): 272- 278.
[36] 宋秋华, 李凤民, 刘洪升, 王俊, 李世清. 黄土区地膜覆盖对麦田土壤微生物体碳的影响. 应用生态学报, 2003, 14(9): 1512- 1516.
[40] 胡婵娟, 傅伯杰, 靳甜甜, 刘国华. 黄土丘陵沟壑区植被恢复对土壤微生物生物量碳和氮的影响. 应用生态学报, 2009, 20(1):45- 50.
[41] 刘占锋, 刘国华, 傅伯杰, 胡会峰, 郑晓翾, 吴雅琼. 人工油松林(Pinustabulaeformis)恢复过程中土壤微生物生物量C、N的变化特征. 生态学报, 2007, 27(3):1011- 1019.
[43] 薛萐, 刘国彬, 戴全厚, 卫伟, 侯喜禄. 侵蚀环境生态恢复过程中人工刺槐林(Robiniapseudoacacia)土壤微生物量演变特征. 生态学报, 2007, 27(3):909- 917.
[44] 闵红, 和文祥, 李晓明, 刘国斌, 杨祥. 黄土丘陵区植被恢复过程中土壤微生物数量演变特征. 西北植物学报, 2007, 27(3): 588- 593.
Effects of afforestation on soil microbial community structure in the arid valley of Minjiang River
WANG Weixia1,2, LUO Da1, SHI Zuomin1,*, LI Dongsheng1, TANG Jingchao1, LIU Shirong1, LIU Qianli3, HE Jianshe3
1KeyLaboratoryonForestEcologyandEnvironmentalSciencesofStateForestryAdministration,InstituteofForestEcology,EnvironmentandProtection,ChineseAcademyofForestry,Beijing100091,China2CollageofForestryandHorticulture,XinjiangAgriculturalUniversity,Urumqi830052,China3SichuanAbaAutonomousPrefectureScienceandTechnologyInstitute,Wenchuan623000,China
In order to explore the effects of afforestation on soil microbial community structures in the arid valley of Minjiang River, we selected different plantations with different cultivation years and site conditions to investigate soil microbial biomass and community structures by phospholipid fatty acids (PLFAs) method. The results showed that soil chemical properties were different among the types but not significant due to their short plantation time, while the soil microbial biomass increased significantly with the plantation time. For plantations with different site conditions, soil microbial biomass was higher in the plantation returned from farmland. The findings of above indicate that the response of microbial to environmental changes is more sensitive than that of soil chemical properties. Soil microbial biomass had significant correlation with soil total nitrogen content. It suggests that soil total nitrogen content is the key factor affects the soil microbial community structures in these plantations.
soil microorganism; phospholipid fatty acids (PLFAs); afforestation; site conditions; arid valley
国家“十二五”科技支撑计划课题资助项目(2012BAD22B0102); 中国科学院碳专项课题资助项目(XDA05060100)
2013- 06- 09;
2013- 09- 22
10.5846/stxb201306091499
*通讯作者Corresponding author.E-mail: shizm@caf.ac.cn
王卫霞, 罗达, 史作民, 李东胜, 唐敬超, 刘世荣, 刘千里, 何建社.岷江干旱河谷造林对土壤微生物群落结构的影响.生态学报,2014,34(4):890- 898.
Wang W X, Luo D, Shi Z M, Li D S, Tang J C, Liu S R, Liu Q L, He J S.Effects of afforestation on soil microbial community structure in the arid valley of Minjiang River.Acta Ecologica Sinica,2014,34(4):890- 898.
