喜盐鸢尾和黄菖蒲种间杂交障碍1)
2014-08-02杨占辉史言妍高亦珂张启翔
杨占辉 史言妍 高亦珂 张启翔
(北京林业大学,北京,100083)
喜盐鸢尾和黄菖蒲种间杂交障碍1)
杨占辉 史言妍 高亦珂 张启翔
(北京林业大学,北京,100083)
以喜盐鸢尾(IrishalophilaPall)和黄菖蒲(I.pseudocorusL.)2种观赏鸢尾植物为材料进行种间杂交,并对二者花粉活力、花粉管行为、胚胎发育及杂交障碍等进行研究。结果表明:受精后障碍是导致喜盐鸢尾和黄菖蒲杂种败育的主要原因,表现为杂种胚在合子早期败育。正反交组合常规授粉后均未得到果实,且均存在一定程度的受精前障碍,喜盐鸢尾×黄菖蒲授粉后48 h花粉管内有大量栓塞,黄菖蒲×喜盐鸢尾授粉后2 h柱头上出现少量胼胝质,但最终均有少量花粉管成功伸入胚珠;对胚胎发育的观察发现,喜盐鸢尾×黄菖蒲和黄菖蒲×喜盐鸢尾杂种胚和胚乳的降解分别发生在授粉后9~15 d和15~21 d;授粉后6 d是黄菖蒲×喜盐鸢尾幼胚拯救较适宜的时期,此时,通过子房培养法于MS+2.0 mg·L-16-BA培养基上获得了膨大的胚珠并发育为种子。
鸢尾属;种间杂交;杂交障碍;胚拯救
鸢尾属(IrisL.)植物普遍具有较高的观赏价值,特别是在北美和欧洲已被广泛应用于园林配植中,远缘杂交是培育鸢尾新品种的有效手段[1-2]。目前国外已经获得了一些无髯鸢尾种间杂种[3-6]。Yabuya et al.[7]在对溪荪(I.sanguinea)和燕子花(I.laevigata)正反交胚胎学研究后,发现胚乳退化导致了杂种胚的败育,并通过幼胚拯救成功获得了燕子花×玉蝉花(I.ensata)的杂种后代[4],之后又用燕子花与玉蝉花做亲本获得了具有高花粉活性和种子活力的双二倍体[8]。2006年,Inoue et al.[6]通过幼胚拯救获得暗黄鸢尾(4x)(I.fulva)×燕子花杂交种。我国鸢尾属植物种质资源丰富,但育种起步较晚[9]。周永红等[10]将鸡冠状亚属的扁竹兰(I.confuse)和蝴蝶花(I.japonica)杂交,获得杂种后代。黄苏珍等[11]进行了鸢尾亚属内6个组合的种间杂交试验,结实率仅为2.1%,最终杂种苗全部死亡。毕晓颖等[12]分别用0.1% 6-BA处理柱头后授粉以及提前授粉的方式仅获得了马蔺(I.lactea)和溪荪正反交的有胚种子。目前,除野鸢尾(I.dichotoma)和射干(I.domestica)[13]外,国内仍未有获得其他无髯鸢尾种间杂种的报道。
喜盐鸢尾(I.halophilaPall.)和黄菖蒲(I.pseudacorusL.)分属鸢尾属琴瓣鸢尾亚属和无附属物亚属,前者耐旱、抗寒、耐盐碱,但花朵较小;后者耐水湿,花大色艳但花色单一。进行二者杂交育种,有望培育耐旱同时耐水湿的园林植物。本研究通过对花粉活力的测定以及花粉管行为的观察,并进一步深入,对杂种进行胚胎学观察及幼胚拯救,为改良喜盐鸢尾的观赏性状、获得观赏性与抗性俱佳的杂种后代奠定理论基础。
1 材料与方法
杂交试验:2012年5月份,分别以喜盐鸢尾和黄菖蒲为父母本,开花前1 d去垂瓣和花药,并对父本花朵进行套袋,次日上午进行常规杂交。分别配置喜盐鸢尾和黄菖蒲的自交和正反交组合,试验在露地苗圃进行。
亲本花粉活力测定:采用TTC法及萌发法测定花粉活力。萌发法采用25 ℃条件下光照培养12 h,每处理3次重复,每重复观察3个视野,以花粉管长度超过花粉粒直径作为萌发标准。采用的培养基:蔗糖15%+硼酸150 mg·L-1+氯化钙10 mg·L-1。
发芽率=(已萌发的花粉粒数目/花粉粒总数)×100%。
花粉管行为荧光观察:授粉后2、6、12、24、48 h采集3朵花的花柱和子房,卡诺固定液(V(乙醇)∶V(冰醋酸)=3∶1)固定3 h,后转移至70%酒精中,4 ℃冰箱储存备用。水溶性苯胺蓝(苯胺蓝以0.1%的比例溶于0.1N K3PO4)染色后,于Nikon荧光显微镜下观察。
杂种胚胎发育过程观察:采集授粉后3、6、9、15、21、27、33 d的3个子房,FAA固定液(V(50%酒精)∶V(冰醋酸)∶V(福尔马林)=89∶6∶5)固定。采用常规石蜡切片方法观察杂种胚胎发育过程。
杂种幼胚拯救:采集授粉后6、9、12 d的子房,常规方法进行消毒处理,无菌条件下取胚珠,接种到MS培养基以及MS+2.0 mg·L-16-BA培养基上进行胚珠培养,每处理12瓶,每瓶20个胚珠。授粉后6 d的子房同时采用胚珠培养和子房培养的方法来进行幼胚拯救,子房培养时切除子房外壁后再接种到培养基上。
2 结果与分析
2.1 亲本花粉活力测定
喜盐鸢尾新鲜花粉的TTC染色率为84.63%,萌发率为59.90%,测定结果一致性较好,表明两种方法均适宜测定喜盐鸢尾的花粉活力。黄菖蒲花粉的萌发率为8.56%,远低于TTC染色率96.55%;黄菖蒲自交结实率为90%(表1),表明其新鲜花粉活力良好,因此,TTC染色结果相对较准确地反映了其花粉生活力状况。
2.2 喜盐鸢尾和黄菖蒲种间杂交及自交结实性的比较
由表1可知,喜盐鸢尾和黄菖蒲自交结实率分别为50%和90%,而正反交组合均未结实。观察发现,无论正交还是反交组合,均有20%左右的子房在授粉后3 d内即干枯脱落,表现为迅速败育;虽有少数子房授粉后发育膨大,平均果长有所增加,但果实宽度却明显小于同时期亲本自交正常发育的果实,这些子房甚至在授粉后40 d内均可保持绿色,此时将其切开,发现内部胚珠干瘪无光泽。授粉后60 d左右,外壁维持绿色的子房也相继脱落败育。
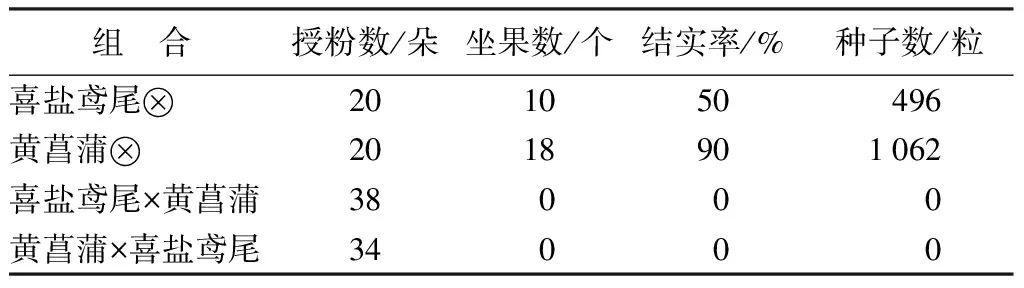
表1 喜盐鸢尾和黄菖蒲正反交及自交结实性比较
2.3 喜盐鸢尾和黄菖蒲正反交及自交花粉管行为观察
对照组喜盐鸢尾自交2 h后花粉大量萌发,花粉管伸至花柱的1/4~1/3处,6 h花粉管伸至4/5处,12 h花粉管伸至花柱底部,24 h花粉管伸入子房,48 h花粉管进入胚珠(图1A)。黄菖蒲自交2 h后花粉在柱头上开始萌发,24 h花粉管伸到花柱底部,进入子房,48 h花粉管伸入胚珠(图1E);在正反交组合中均观察到一定程度的受精前障碍。喜盐鸢尾×黄菖蒲授粉后6 h才有少量花粉开始萌发,并发现柱头上有胼胝质沉积,12 h花粉管伸长,但未伸入花柱,48 h花粉管伸入子房,花粉管内有大量栓塞(图1B),有少量花粉管伸入胚珠(图1C)。总体上,花粉萌发速度和花粉管伸长行为都滞后于对照组。
黄菖蒲×喜盐鸢尾授粉后2 h花粉开始萌发,柱头上出现少量胼胝质,6 h花粉管伸到花柱的1/2处,12 h已有少量花粉管伸至花柱底部,24 h花粉管进入子房,48 h少量花粉管伸入胚珠(图1D),但花粉管内有大量栓塞。花粉管行为与喜盐鸢尾自交较相似。

A.喜盐鸢尾⊗,48 h,花粉管伸入胚珠;B.喜盐鸢尾×黄菖蒲,48 h,花粉管内有大量栓塞;C.喜盐鸢尾×黄菖蒲,48 h,花粉管伸入胚珠;D.黄菖蒲×喜盐鸢尾,48 h,花粉管伸入胚珠;E.黄菖蒲⊗,48 h,花粉管伸入胚珠;箭头指示关键点。
图1 喜盐鸢尾和黄菖蒲正反交及自交授粉后花粉管生长情况
2.4 杂种胚胎发育过程观察
喜盐鸢尾×黄菖蒲在授粉3~9 d发育正常,授粉后15 d胚乳和胚退化完全,珠心细胞退化成带状痕迹,授粉27 d珠心细胞完全退化,内珠被退化成带状痕迹,外珠被大部分也已退化。授粉33 d后内外珠被都退化成带状痕迹(图2,A-E)。
黄菖蒲×喜盐鸢尾在授粉3~15 d发育正常,原胚周围游离一些胚乳核,21 d胚和胚乳已退化,珠心大部分解体,27 d珠心全部解体,内珠被退化成带状痕迹,授粉33 d后外珠被也退化成带状痕迹(图2,F-I)。
因此,上述结果与杂交情况和授粉后蒴果实际发育表现一致,表明不亲和障碍主要发生在受精后。
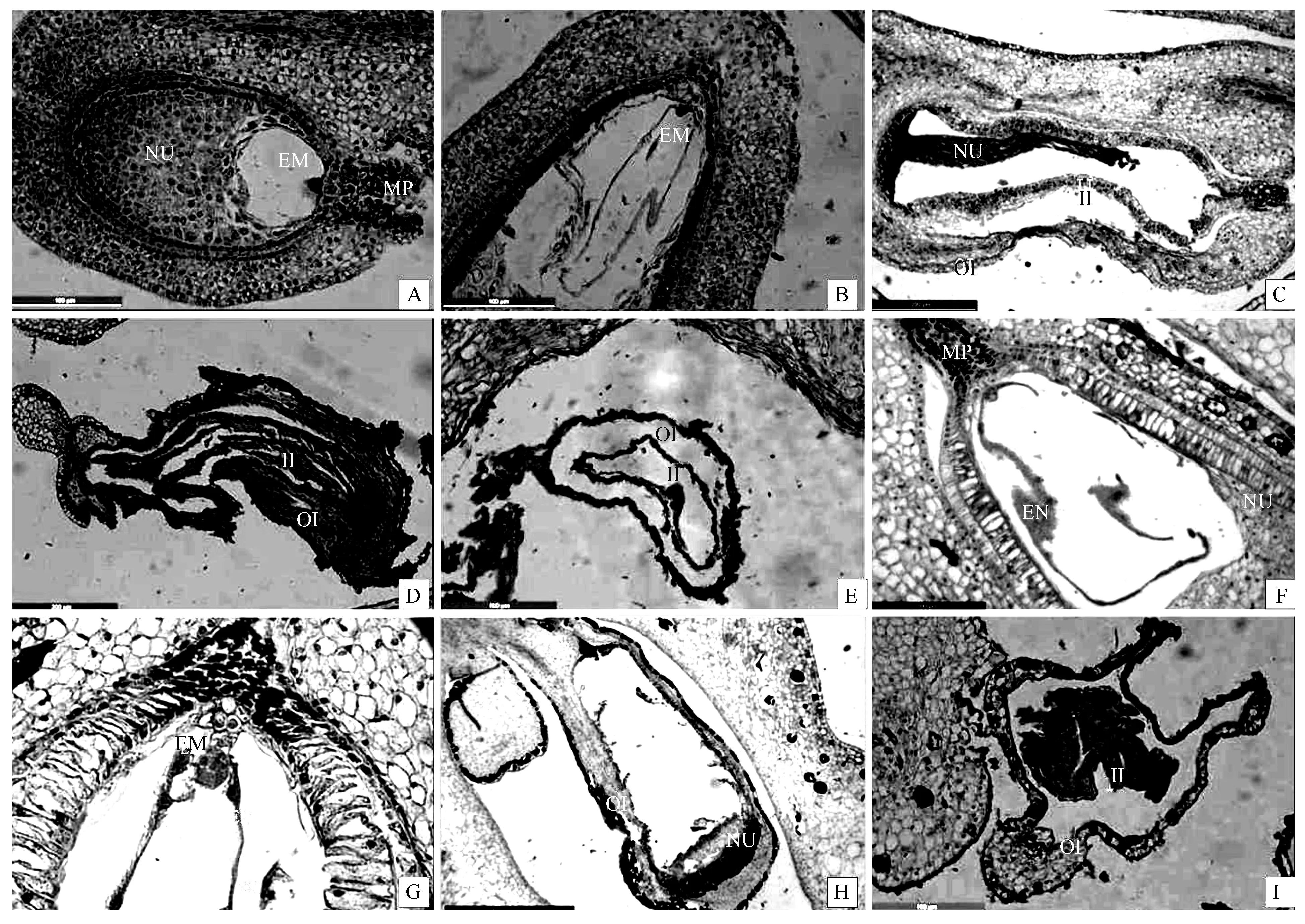
A-E.喜盐鸢尾×黄菖蒲,A.3 d,B.9 d,C.15 d,D.21 d,E,33 d;F-I.黄菖蒲×喜盐鸢尾,F.9 d,G.15 d,H,21 d,I.33 d;MP.珠孔端;EM.原胚;EN.游离胚乳核;NU.珠心;II.内珠被;OI.外珠被。
图2 喜盐鸢尾和黄菖蒲正反交胚胎发育过程
2.5 杂种幼胚拯救
黄菖蒲×喜盐鸢尾授粉后9 d的杂种胚胎石蜡切片观察结果表明发育正常,但此时观察到杂种果实的平均宽度已明显小于黄菖蒲自交组合,预示部分杂种胚胎败育已经开始,综合考虑后,对黄菖蒲×喜盐鸢尾幼胚拯救设定了3个时间点:授粉后6、9、12 d(图3A)。
授粉后6 d幼胚拯救采用了胚珠培养和子房培养2种方式(表2)。去除子房外壁的子房切片内部分胚珠膨大发育(图3B),最后得到3粒种皮黑色且有光泽的种子(图3C),但培养3个月之后逐渐干瘪,并未萌发。
授粉后9 d和12 d的胚珠分别接种在2种培养基上(图3D),1个月之后,2种培养基上的胚珠均未膨大,但接种在MS+2.0 mg·L-16-BA培养基上外观保持绿色的胚珠要明显多于同时期接种在MS培养基上的数目,表明MS+2.0 mg·L-16-BA培养基要优于MS培养基。
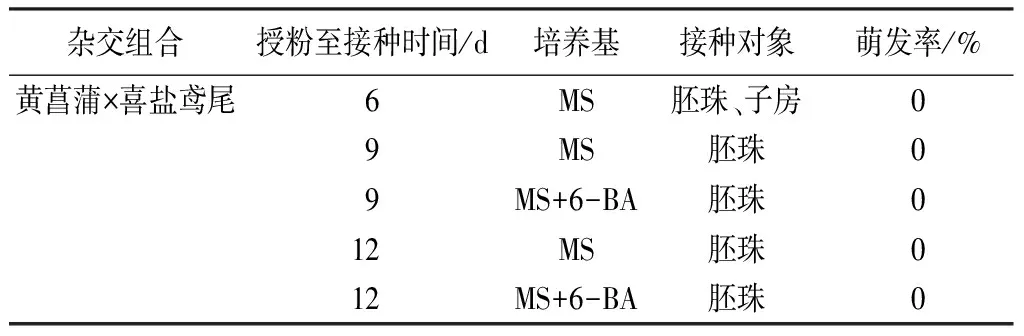
表2 黄菖蒲×喜盐鸢尾杂种胚拯救
所有时期接种的胚珠均未萌发,接种后3个月内逐渐褐化并最终全部死亡。
3 结论与讨论
花粉是否具有生命力是确保杂交成功的一个重要条件,因此,杂交之前有必要对亲本的花粉生命力进行测定。萌发法是测定花粉活力的常规方法,TTC法则可以迅速且较精确地反映花粉活性[14]。本试验采取2种方法测定亲本活力,喜盐鸢尾的测定结果较一致;黄菖蒲新鲜花粉的萌发率很低,但其自交又具有良好结实率,表明花粉是具有良好活力的,之所以仅少数花粉萌发,可能是由于培养液成分不能很好满足其萌发所需条件。花粉活力与遗传和环境有关[14],因此,适宜的培养液成分需进一步筛选。

A.黄菖蒲×喜盐鸢尾授粉后9 d的子房;B.子房切片培养授粉后6 d的子房得到膨大胚珠;C.膨大胚珠发育为黑亮的种子;D.胚珠接种。
鸢尾远缘杂交不亲性主要表现为受精前障碍和受精后杂种胚败育[3,12-13]。毕晓颖等[12]发现马蔺和溪荪正反交不亲和原因主要发生在受精前。野鸢尾和射干正反交杂交障碍存在差异,野鸢尾×射干不亲和障碍主要发生在受精前,而反交组合不亲和主要由受精后胚败育导致[13]。而在本研究中,花粉管行为及杂种胚胎发育观察结果表明,喜盐鸢尾×黄菖蒲和黄菖蒲×喜盐鸢尾虽然存在一定的受精前障碍,降低了杂交亲和性,但最终成功受精,而杂种胚和胚乳的退化则直接导致杂种的彻底败育。因此,喜盐鸢尾和黄菖蒲正反交杂种败育的主要障碍存在于受精后。
幼胚拯救的方法是克服远缘杂交受精后障碍的有效途径[15],根据培养对象的不同,又分为子房培养、胚珠培养、幼胚培养[16]。通过幼胚拯救获得远缘杂种已经在某些植物中得以实现[17],而在鸢尾属植物种间杂交育种中也有成功案例,如:Yabuya et al.[3]通过幼胚拯救获得了属内种间杂交组合燕子花×玉蝉花的杂种后代。本试验采用胚珠培养接种的所有时期的胚珠均未萌发,接种后3个月内全部褐化并死亡,其原因可能与娄琦[18]推测一致,即胚珠从子房中摘除后不能丛胎座上吸取营养,因而不能正常生长分化,进而死亡。因此,建议采取去除子房外壁的子房切片的培养方式。虽然未能通过胚珠培养获得黄菖蒲×喜盐鸢尾的杂种,对其授粉后6 d的杂种子房进行幼胚拯救后,得到发育膨大的胚珠,并发育为具有正常外观的种子。将种子离体培养3个月后逐渐萎缩干瘪,可能是种子内部自身发育不完善造成其不能正常萌发而最终死亡,这也从侧面反映了导致黄菖蒲×喜盐鸢尾败育的主要障碍发生在受精后。因此,认为授粉后6 d是黄菖蒲×喜盐鸢尾幼胚拯救较适宜的时期,进一步深化研究有可能克服喜盐鸢尾和黄菖蒲种间杂交障碍,获得杂种苗。
[1] Yabuya T. Chromosome associations and crossability withIrisensataThunb. in induced amphidiploids ofI.laevigataFisch.×I.ensata[J]. Euphytica,1991,55:85-90.
[2] Yabuya T, Noda T. The characterization of autoallotetraploid hybrids betweenIrisensataThunb. andI.laevigataFisch[J]. Euphytica,1998,103(3):325-328.
[3] Yabuya T, Yamagata H. Elucidation of seed failure and breeding of F1 Hybrid in reciprocal crosses betweenIrisensataThunb. andI.leavigataFisch[J]. Japan J Breed,1980,30(2):139-150.
[4] Tomino K, Sakurai O. Cross betweenIrispesudacorusL. andI.ensataThunb. var.ensta[J]. Bull Fac Edu Mie Univ,1972(23):17-26.
[5] Graeme G. Iris flower of the rainbow[M]. Australia: Kangaroo Press,1997:9-202.
[6] Inoue K, Kato K, Nobukuni A, et al. Characterization of tetraploid plants regenerated via protoplast culture of Iris fulva and their crossability with Japanese irises[J]. Scientia Horticulturae,2006,110(4):334-339.
[7] Yabuya T, Yamagata H. Embryological and cytological studies on seed development after reciprocal crosses betweenIrissanguineaHornem. andI.leavigataFisch[J]. Japan J Breed,1978,28(3):211-224.
[8] Yabuya T. Amphidiploids betweenIrislaevigataFisch. andI.ensataThunb. induced through in vitro culture of embryos treated with colchicine[J]. Japan J Breed,1985,35:136-144.
[9] 郭晋燕,张金政,孙国峰,等.根茎类鸢尾园艺学研究进展[J].园艺学报,2006,33(5):1149-1156.
[10] 周永红,伍碧华,颜济,等.Irisjaponica×Irisconfuse种间杂种的细胞遗传学研究[J].云南植物研究,2003,25(4):497-502.
[11] 黄苏珍,顾姻,贺善安.鸢尾属植物的杂交育种及其同功酶分析[J].植物资源与环境,1996,5(4):38-41.
[12] 毕晓颖,娄琦,郑洋.马蔺与溪荪种间杂交亲和性研究[J].园艺学报,2011,38(5):977-984.
[13] 毕晓颖,李卉,娄琦,等.野鸢尾和射干属间杂交亲和性及杂种鉴定[J].园艺学报,2012,39(5):931-938.
[14] 胡适宜.植物胚胎学试验方法(一)花粉生活力的测定[J].植物学通报,1993,10(2):60-62.
[15] 李辛雷,陈发棣,赵宏波.菊属植物远缘杂交亲和性研究[J].园艺学报,2008,35(2):257-262.
[16] 邓衍明,叶晓青,佘建明,等.植物远缘杂交育种研究进展[J].华北农学报,2011,26(增刊):52-55.
[17] 刘春,穆鼎,明军,等.百合种间杂交受精前障碍的研究[J].园艺学报,2006,33(3):653-656.
[18] 娄琦.鸢尾种间杂交亲和性及胚胎研究[D].沈阳:沈阳农业大学,2011.
Crossbreeding Barriers of Interspecific Hybridization betweenIrishalophilaPall andI.pseudocorusL./
Yang Zhanhui, Shi Yanyan, Gao Yike, Zhan Qixiang(Beijing Forestry University, Beijing 100083, P. R. China)//Journal of Northeast Forestry University.-2014,42(1).-94~97
IrisL.; Interspecific hybridization; Crossbreeding barriers; Embryo rescue
1) 国家林业局“948”引进项目( 2013-4-46)。
杨占辉,1987年8月生,北京林业大学园林学院,硕士研究生。
高亦珂,北京林业大学园林学院,教授。E-mail:gaoyk@bjfu.edu.cn。
2013年4月16日。
S682.21+9; S722.3+4
责任编辑:任 俐。
The experiment was conducted to study the crossbreeding barriers between twoIrisspecies,I.halophilaPall andI.pseudocorusL., and determine the pollen viability, pollen tube behaviors after common pollination, embryology observation and embryo rescue. Post-zygotic barrier is the main reason for the cross incompatibility betweenI.halophilaandI.pseudacorus, and it expresses embryo abortion in early zygophase. No capsules are obtained from reciprocal crosses, and there are pro-zygotic barriers in the two combinations. The stylar canal after 48 hours pollination inI.halophila×I.pseudacorusis blocked by a large number of embolism, while after two hours pollination inI.pseudacorus×I.halophilasome corpus callosum appeares on stigma. However, there is still a small amount of pollen tube at ovules of both combinations ultimately. The failures of embryo and endosperm inI.halophila×I.pseudacorusandI.pseudacorus×I.halophila, respectively, occur at 9-15 days and 15-21 days after pollination. Six days after pollination is the appropriate time for embryo rescue ofI.pseudocorus×I.halophila, and there are inflated ovules in medium of MS+2.0 mg·L-16-BA.
