一株Agrocybe属真菌的分离鉴定及生物学特性1)
2014-07-27吴萍民赵春巧
谢 放 吴萍民 赵春巧
(兰州交通大学,兰州,730070)
一株Agrocybe属真菌的分离鉴定及生物学特性1)
谢 放 吴萍民 赵春巧
(兰州交通大学,兰州,730070)
对一株采自祁连山的疑似Agrocybe属真菌进行了分离鉴定及生物学特性研究。通过组织分离获得该菌纯培养物,提取其基因组 DNA,以此为模板进行了ITS片段的扩增、测序,及基于ITS序列的菌株系统发育分析,同时对该菌进行了生物学特性研究。结果显示:从菌丝体中扩增获得了700 bp左右的ITS片段,系统发育树分析表明该真菌属于Agrocybe属,GenBank登录号为KF702393。该菌菌丝生长的最适温度为24 ℃,最适pH为7.0,较适碳氮源为葡萄糖和酵母粉,添加一定量的无机盐和维生素有助于菌丝的生长。
田头菇属;ITS;生物学特性
Journal of Northeast Forestry University.-2014,42(7).-137~142
We isolated and identified fungus from wild environment to study its biological characteristics. The mycelium was isolated from the fruiting body. Genomic DNA was extracted from mycelium, then used as template for the ITS gene PCR amplification, sequencing and phylogenetic analysis. We also studied the biological characteristics of mycelium. About 700 bp fragment was amplified and sequenced. Phylogenetic analysis indicated that the fungi belonged to the genusAgrocybe. GenBank accession number was KF702393. The optimum temperature and pH were 24 ℃ and 7.0, respectively. The optimum carbon sources and nitrogen sources were glucose and dry yeast, respectively. The fungi can advance the growth of mycelium by adding some inorganic salt and vitamins.
KeywordsAgrocybe; ITS; Biological characteristics
田头菇属(Agrocybe)是Singer于1986年以Agrocybepraecox(Fr.) Fayod为模式种建立的一类真菌[1]。目前,常见分类是隶属于担子菌门(Basidiomycota)、伞菌纲(Agaricomycetes)、伞菌目(Agaricales)、球盖菇科(Strophariaceae)[2]。该属是担子菌中著名的食用兼药用真菌,具有极大的应用价值。从该属的茶树菇发酵液中提取的多糖对链脲菌素(STZ)引起的β-胰岛细胞破坏具有很好的修复作用,能显著地降低STZ引起的葡萄糖浓度和RINm5F细胞中iNOS表达水平,而达到治疗糖尿病的作用,用其干燥粉制造的加工食品也具有很好的降血糖作用[3-4]。且从该属部分菌种中分离的环化酶不仅具有催化芳香族物质的环氧化和羟基化反应,参与物质的代谢、苯酚和羟基化产品的生产,还可填补细胞色素P450和常见的血红素过氧化物酶之间的差距[5-7],而且作为新型生物传感器的组成成分,具有高灵敏度和高稳定性,可用来测量4-硝基苯酚及其环化作用产生的酶,以及确定苯胺和对氨基苯酚等,将是一种非常有用的分析试剂[8-9]。同时,诸多的研究员从田头菇属中分离出很多新型的倍半萜类、类胆固醇等化学成分,并对它们的结构进行了研究和确定,同时指出它们作为新型的天然化合物,将在新药物的开发利用方面具有潜在的药用价值[10-13]。另外,Liang等[14]和Feng等[15]从杨树菇中分离到具有抗肿瘤作用的蛋白质片段,分别为AAL和AAL-2,随后Chen等[16]也分离纯化到一种新的具有脱氧核糖核酸酶活性的抗癌蛋白质AAD。Imamura等[17]研究表明,从柱状田头菇中分离到的半乳糖凝集素是为数不多的对3’-唾液酸乳糖具有较高亲和力的凝集素,利用Asp取代其中的Glu86与3’-唾液酸乳糖的葡萄糖单元相互作用得到的E86D突变,基本上失去了LacNAc和T-抗原的结合能力,同时保留了对3’-唾液酸乳糖的高亲和力,将在细胞工程和糖工程中发挥重要作用。Wang等[18]研究表明,茶树菇甲醇提取物(MFAC)介导食用油诱发活性氧的产生和人肺腺癌CL-3细胞DNA的损伤,能够通过NF-kB途径调控CL-3细胞中环氧合酶-2的抗食用油基因表达。鉴于田头菇属真菌的诸多应用价值,本研究对从祁连山区采集的一株疑似田头菇属的野生大型真菌进行组织分离,并通过ITS序列进行鉴定及对其系统发育分析和生物学特性进行研究,从而对该野生菌株的遗传地位和生长条件进行解析,为其人工驯化利用及产业发展提供一定的理论依据。
1 材料与方法
1.1 材料
菌株ql-7(登录号:KF702393),采集并分离于甘肃省张掖市肃南县与酒泉市肃州区交界的祁连山中,现保存于兰州交通大学生物工程种苗研究所。PPDA培养基:马铃薯200 g,葡萄糖20 g,蛋白胨10 g,琼脂20 g,蒸馏水1 L,pH自然。基础培养基:葡萄糖20 g,尿素2 g,磷酸二氢钾1.0 g,硫酸镁0.5 g,琼脂18 g,去离子水1 L。灭菌条件:121 ℃,30 min。
1.2 方法
形态学观察及鉴定:观察记载菌落特征、菌丝形态和孢子形态,并用数码相机拍照,用MOTIC B显微镜观察、测定和拍照微观产孢结构。
DNA提取:在PPDA培养基上26 ℃培养10 d,取新鲜培养物,用CTAB法提取总DNA。
PCR扩增:引物ITS1,5’-TCCGTAGGTGAACCTGCGG-3’;ITS4,5’-TCCTCCGCTTATTG ATATGC-3’。反应体系(50 μL),MgCl24.0 μL,10×PCR buffer 5.0 μL,dNTP 1.0 μL,Taq酶0.5 μL,引物ITS1和引物ITS4均为2.0 μL,模板2.0 μL,ddH2O 33.5 μL。
PCR条件:94 ℃ 5 min,1个循环;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min 45 s,35个循环,72 ℃10 min。扩增产物在加有EB的1%琼脂糖凝胶中电泳45 min检测。
PCR产物的纯化和DNA测序由北京三博远志生物技术有限责任公司完成。
序列分析:相关种的序列在GenBank数据库下载;用Clustal X1.83软件进行DNA序列比对,而后用Seaview软件对序列作适当手工处理;系统树构建用邻接法(Mega 4.1软件),1 000次bootstrap重复验证。
温度和pH值试验:采用单因子试验设计,将活化好的菌丝体块分别接种于18、20、22、24、26、28 ℃恒温避光培养;另接种于pH值为4.0、5.0、6.0、7.0、8.0、9.0的培养基后置24 ℃培养。每个处理均设置3个重复,观察记录。
碳氮源试验:以基础培养基中20 g葡萄糖的含碳量为标准,分别以相等含碳量的蔗糖、麦芽糖、可溶性淀粉、甘露醇、甘油、葡萄糖代替基础培养基中的葡萄糖,并以不添加碳源的基础培养基做对照;以基础培养基中2 g尿素的含氮量为标准,分别以相等含氮量的硝酸钾、蛋白胨、硫酸铵、硝酸铵、酵母粉、尿素代替基础培养基中的尿素,并以不添加氮源的基础培养基做对照。
无机盐和维生素的试验:分别用硫酸铁、硫酸钙、硫酸镁、硫酸锌、硫酸铜和硫酸锰代替基础培养基中的硫酸镁,并以不加硫酸镁的基础培养基做对照,其中常量元素为0.50 g/L,微量元素为0.06 g/L;以基础培养基为对照,分别添加VB1、VB2、VB3、VB6、VB12、VB合进行试验,其中维生素的量为0.01 g/L。
菌株菌丝将近长满平皿而未满平皿时作为测量终点进行菌丝日均长速的测定。菌丝日均长速=[(菌落直径-6)/2]/培养天数,最后取3个重复的平均值。采用重量法进行测定[19]菌落干质量。
2 结果与分析
2.1 形态描述
该菌子实体较大,菌盖直径4~5 cm,厚约2 cm,顶部较平,边缘展开下弯,浅褐色。菌褶近直生,方向垂直向下,呈深褐色。菌柄长6.5 cm,浅白色至灰褐色,近圆柱形,下端稍弯曲,具菌环(单环),菌环生柄中上部,膜质,薄,淡褐色(图1a)。在PPDA培养基中菌落不平展,白色,边缘整齐,质地紧密,后期时菌丝略带黄色,背面白色,长时间放置菌落上会出现黄色油状液滴(图1b)。菌丝半透明,表面光滑,粗细较均匀,宽2.5~3.0 μm,有隔,无明显的锁状联合(图1c),具有特殊产孢器,能产生大量的孢子(图1d、图1e);孢子椭圆形,大小(1.5~1.7)μm×(2.3~2.5)μm(图1f)。
2.2 PCR的扩增结果
以CTAB法所获得的菌株基因组DNA为模板,选取2个通用引物ITS1和ITS4进行PCR扩增该菌株的部分序列,结果如图2所示,所得的产物片段大小为700 bp左右,条带明亮清晰,无拖尾现象,表明该方法提取获得的野生菌基因组DNA质量较好,并能够满足基于PCR反应的后续分子生物学试验研究。
2.3 系统发育
将序列测定的结果提交至GenBank,登录号为KF702393。在NCBI网站上用BLAST程序进行比对,选取相似性较高的菌株,用Clustal X1.83软件对菌株ql-7和这些已知种进行了多序列比对,用邻接法构建系统发育树(图3)。结果表明,菌株ql-7与Agrocybepraecox(EU520254)菌株的遗传关系最近,遗传距离达到96%,且以100%的支持率处于一个独特的分支中,因此鉴定该菌属于Agrocybe属。

a.子实体;b.菌落形态;c.菌丝形态;d、e.产孢结构;f.孢子。

M.分子量标准;1、2.菌丝体基因组DNA中PCR扩增的ITS片段(2次重复)。
图2 ql-7菌株ITS-PCR电泳结果
2.4 温度对菌丝生长的影响
试验菌在不同温度下的生长情况见表1。供试菌在18~28 ℃都能生长,但长速和干质量存在差异。在18~24 ℃,随着温度上升,菌丝长势越来越好,长速越来越快,积累的干质量越来越多;温度超过24 ℃时,菌丝生长速度减慢,长势也变弱,积累的干质量量随之减少,因此,该菌菌丝生长的最适温度为24 ℃,这与张微思等[20]对茶树菇的研究结果相似,而与舒丽等[21]的研究结果(最适范围25~30 ℃)略有偏差,分析原因可能与菌株生长的环境以及菌种不同有关,笔者所选菌株应为中温型。

表1 温度对ql-7菌丝生长的影响
注:表中数据为平均值±标准误,同列数据后不同大小写字母分别表示差异达0.01和0.05显著水平。
2.5 pH值对菌丝生长的影响
pH试验结果表明(表2):供试菌在pH值4.0~9.0的范围内均能生长,但不同pH值下菌丝的生长状况有较大差异,pH值低于5.0时,培养基凝固性不好,菌丝生长缓慢;pH值大于7.0时,菌丝稀疏且老化,推测是不适的pH影响了酶活性基团的构象,并改变了底物的特性,对菌丝造成胁迫所致。因此,适宜的pH值为5.0~7.0,其中pH值为7.0时菌丝的生长速率和干质量均达最大,并与其他梯度相比具有显著性差异,所以pH=7.0是菌丝最适生长的酸碱度。这与张松[22]对柱状田头菇的研究结果一样,而与吕明亮等[23]的研究结果存在差异,原因可能是该菌在长期的进化过程中为适应当地生态环境而进化出对酸碱度范围的耐受性。

图3 依据ITS基因序列采用邻接法构建的系统发育树(自展值为1 000次)

pH值日均长速/mm·d-1菌落干质量/mg4.0(0.70±0.03)dC (53.12±1.08)cCD5.0(0.98±0.04)bcB(79.46±2.34)bBC6.0(1.07±0.06)abAB(86.06±3.01)bAB7.0(1.15±0.03)aA(97.00±4.19)aA8.0(1.04±0.03)bcAB(53.44±2.20)cCD9.0(0.96±0.04)cB(42.24±3.09)cDE
注:表中数据为平均值±标准误,同列数据后不同大小写字母分别表示差异达0.01和0.05显著水平。
2.6 碳源对菌丝生长的影响
试验菌在不同碳源下的生长情况见表3。该菌能利用多种碳源,但长速和干质量存在较大差异。其中以淀粉做碳源时菌丝长速最快,葡萄糖和蔗糖次之,甘露醇最差。但就干质量而言,以淀粉做碳源时菌落单薄,积累的干质量少,而在以葡萄糖为碳源时菌落质地紧密,长势好,积累的干质量最多,并达到极显著水平。因此,供试菌的最适碳源为葡萄糖,但对甘露醇的利用最差,说明该菌能较好的利用醛糖和酮糖而不容易利用醇糖,对蔗糖和麦芽糖的较好利用也说明了这一点。除了葡萄糖作为单糖能较好的吸收利用外,也与该菌本身的酶系和酶调节相关,如Kakde等[24]研究表明葡萄糖、蔗糖等能促进菌丝中脂肪酶的活性提高,促进菌丝生长。另外,试验中发现不同的碳源对菌株干质量积累的影响与对菌丝长速的影响不同,分析原因主要与丰富的营养物质促使菌落密度的加厚和分枝的增多有关。如Suzuki等[25]研究表明,合适的碳氮营养素能够增加真菌菌丝生长所需的部分生长因子,更有利于菌丝的健壮生长。
2.7 氮源对菌丝生长的影响

表3 碳源对ql-7菌丝生长的影响
注:表中数据为平均值±标准误,同列数据后不同大小写字母分别表示差异达0.01和0.05显著水平。
2.8 无机盐对菌丝生长的影响
试验菌在不同无机盐下的生长情况见表5。不同种类的无机盐对供试菌株菌丝生长的作用效果不同,在培养基中添加硫酸镁和硫酸锰对菌丝的生长具有一定的促进作用,这与资料中报道的镁和锰是糖代谢中许多酶类发挥活性所必需的结论相一致;而硫酸钙和硫酸铜无明显的促进或者抑制作用,可能与添加的浓度大小相关,添加的量不足以起到作用;硫酸铁和硫酸锌对菌丝的生长具有一定的抑制作用,可能与添加的量相关或者与该菌中这2种矿物质的代谢有关。
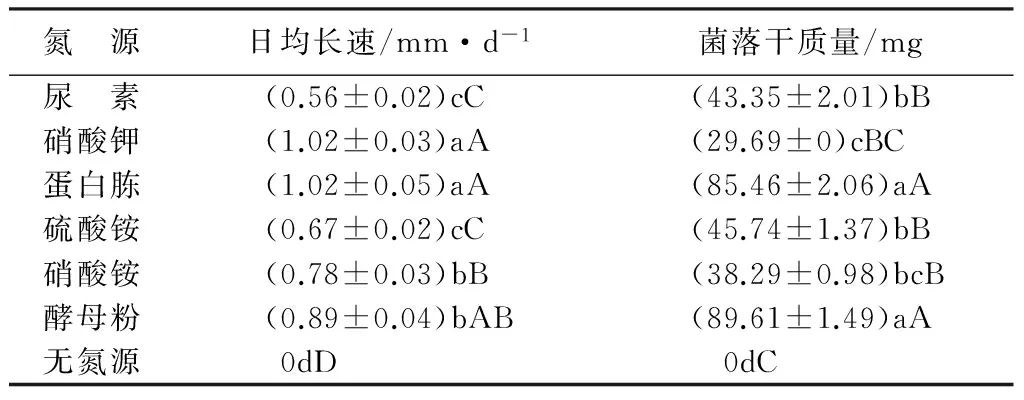
表4 氮源对ql-7菌丝生长的影响
注:表中数据为平均值±标准误,同列数据后不同大小写字母分别表示差异达0.01和0.05显著水平。

表5 无机盐对ql-7菌丝生长的影响
注:表中数据为平均值±标准误,同列数据后不同大小写字母分别表示差异达0.01和0.05显著水平。
2.9 维生素对菌丝生长的影响
试验菌在不同维生素下的生长情况见表6。

表6 维生素对ql-7菌丝生长的影响
注:表中数据为平均值±标准误,同列数据后不同大小写字母分别表示差异达0.01和0.05显著水平。
除VB2对菌丝的生长具有一定的抑制作用外,其余的维生素类都有一定的促进作用,尤其是VB1和VB合对干质量的积累具有显著的促进作用,主要因为VB1的活化形式TPP是中间代谢中一些关键酶的辅酶,VB合中不仅具有VB1的成分,还有真菌类常需要的生物素和叶酸等成分。而该真菌可能不需要VB2或者本身能合成所需的量,再次的添加造成量的增多而导致抑制作用。其他供试维生素类,也具有一定的促进作用,但与对照组相比无明显差异,说明供试菌可能能合成自身生长所需的这些维生素类,但还需要加大浓度梯度做进一步研究,以明确其机理。
3 结论与讨论
生物学特性研究表明:ql-7菌株不能在无额外添加碳源或氮源的培养基中生长,这在其他大型真菌中极少见报道,以往对灰树花、茶树菇、杏鲍菇等多数大型真菌研究表明在无额外添加碳源或氮源的培养基中真菌都能生长[28-30],而笔者在2 a的时间里对羊肚菌、鸡腿菇、侧耳和荷叶离褶伞等真菌的研究也表明在无额外添加碳源或氮源的培养基中都可见菌丝生长。其原因可能有以下3点。①可能其他真菌类能或多或少的利用琼脂,而琼脂作为一种高分子多糖物质可能会提供一定的碳氮营养素,而试验菌无法利用琼脂而不生长。②接种块本身就带有少量的碳氮营养成分,也可能是大部分真菌能耐极贫瘠营养而生长,而供试菌耐贫瘠营养的条件很差,属于富营养真菌。③王镭等[31]曾报道柱状田头菇在无氮的培养基中不能生长,认为与柱状田头菇具有较高的蛋白酶活性有关,供试菌会不会存在相类似的现象,还有待进一步对其酶活性进行研究。
通过对供试菌的形态学描述可知,该种与褐色田头菇(Agrocybebrunneola(Fr.) Bon,Docums.)在子实体大小、颜色、菌柄颜色、菌环位置等形态特征上相似,但后者孢子较大,达(12.7~15.7)μm×(5.4~7.8)μm,且形状呈现长纺锤形、近纺锤形至长椭圆形[32],而供试菌孢子大小为(1.5~1.7)μm×(2.3~2.5)μm,并且多数椭圆形。培养特性则表明,供试菌与报道的田头菇属的一些菌具有相似的生长温度和酸碱度以及营养特性[20,22-23]。系统发育分析表明,该供试菌与田头菇(Agrocybepraecox)菌株的遗传关系最近,遗传距离达到96%,且以100%的支持率处于一个独特的分支中,因此鉴定该菌属于Agrocybe属。但遗憾的是未能查阅到与之亲缘关系最近的Agrocybepraecox的菌丝及产孢结构的描述,不能将二者做以比较,但与其他田头菇的子实体形态和孢子的大小等特征做比较,并结合培养特性和分子鉴定结果,确定供事菌为Agrocybe属中的一个新种。
综合形态分析和分子鉴定结果以及生物学特性研究可以得到如下结论:供试菌属于Agrocybe属,其最适菌丝生长温度为24 ℃,最适pH值为7.0,最适碳、氮源分别为葡萄糖和酵母粉,添加一定量的硫酸镁和硫酸锰对菌丝生长具有促进作用,在基础培养基中添加一定量的维生素也有助于菌丝更好地生长。
[1] Singer R. The Agaricales in modern taxonomy[M]. 4th ed. Koengstein: Koeltz Scientific Books,1986.
[2] Kirk P M, Cannon P F, Minter D W, et al. Dictionary of the fungi[M]. 10th ed. Wallingford: CAB International,2008.
[3] Lee B R, Lee Y P, Kim D W, et al. Amelioration of streptozotocin-induced diabetes byAgrocybechaxingupolysaccharide[J]. Molecules and Cells,2010,29(4):349-354.
[4] Brennan M A, Drebyshire E, Tiwari B K, et al. Enrichment of extruded snack products with coproducts from chestnut mushroom (Agrocybeaegerita) production: interactions between dietary fiber, physicochemical characteristics and glycemic load[J]. Journal of Agricultural and Food Chemistry,2012,60(17):4396-4401.
[5] Karich A, Kluge M, Ullrich R, et al. Benzene oxygenation and oxidation by the peroxygenase ofAgrocybeaegerita[J]. AMB Express,2013,3(1):5.
[6] Kluge M, Ullrich R, Scheibner K, et al. Stereoselective benzylic hydroxylation of alkylbenzenes and epoxidatio n of styrene derivatives catalyzed by the peroxygenase ofAgrocybeaegerita[J]. ChemInform,2012,43(26):1522-2667.
[7] Lei Peng, Ulla W, Martin H, et al. Bioelectrocatalytic properties ofAgrocybeaegeritaperoxygenase[J]. Electrochimica Acta,2010,55(27):7809-7813.
[8] Vdovenko M M, Ullrich R, Hofrichter M, et al. Luminol oxidation by hydrogen peroxide with chemiluminescent signal formation catalyzed by peroxygenase from the fungusAgrocybeaegeritaV. Brig.[J]. Applied Biochemistry and Microbiology,2010,46(1):65-68.
[9] Wu Yunhua, Ulla W, Martin H, et al. Direct electron transfer ofAgrocybeaegeritaperoxygenase at electrodes modified with chitosan-capped Au nanoparticles and its bio-electrocatalysis to aniline[J]. Sensors and Actuators B:Chemical,2011,160(1):1419-1426.
[10] Zheng Yongbiao, Lu Chunhua, Xu Li, et al. Three new sesquiterpenoids fromAgrocybesp.[J]. Chemical Research in Chinese Universities,2012,28(6):976-979.
[11] Choi J H, Abe N, Kodani S, et al. Osteoclast-forming suppressing compounds from the medicinal mushroomAgrocybechaxinguHuang[J]. International Journal of Medicinal Mushrooms,2010,12(2):151-155.
[12] Liu Liangyang, Li Zhenghui, Dong Zejun, et al. Two novel fomannosane-type sesquiterpenoids from the culture of the basidiomyceteAgrocybesalicacola[J]. Natural Products and Bioprospecting,2012,2(3):130-132.
[13] Wang Gang, Liu Lianyan, Zhu Yingcheng, et al. Illudin T, a new sesquiterp-enoid from basidiomyceteAgrocybesalicacola[J]. Journal of Asian Natural Products Research,2011,113(5):430-433.
[14] Liang Y, Feng L, Tong X, et al. Importance of nuclear localization for the apoptosis-induced activity of a fungal galectin AAL (Agrocybeaegeritalectin)[J]. Biochemical and Biophysical Research Communications,2009,386(3):437-442.
[15] Feng Lei, Sun Hui, Zhang Ying, et al. Structural insights into the recognition mechanism between an antitumor galectin AAL and the Thomsen-Friedenreich antigen[J]. The FASEB Journal,2010,24(10):3861-3868.
[16] Chen Yijie, Jiang Shuai, Jin Yanxia, et al. Purification and characterization of an antitumor protein with deoxyribonuclease activity from edible mushroomAgrocybeaegerita[J]. Molecular Nutrition and Food Research,2012,56(11):1729-1738.
[17] Imamura K, Takeuchi H, Yabe R, et al. Engineering of the glycan-binding specificity ofAgrocybecylindraceagalectin towards α(2,3)-linked sialic acid by saturation mutagenesis[J]. The Journal of Biochemistry,2011,150(5):545-552.
[18] Wang L H, Lee H, Chiang T A, et al. Preventive effect of methanol extract fromAgrocybecylindracea(MEAC) mushroom on the cooking oil fumes-induced expressions of cyclooxygenase-2 via suppression of nuclear factor-kappaB (NF-kB) in CL-3 Cells[J]. Journal of Food and Druganalysis,2011,19(3):340-348.
[19] 刘晓鹏,姜宁,向东山,等.金针菇深层发酵条件及水浴提取菌丝体多糖的研究[J].食品科学,2008,29(9):437-440.
[20] 张微思,郭永红,何容,等.高原特色茶树菇生物学特性及栽培技术[J].中国食用菌,2012(6):28-29.
[21] 舒丽,陈强,陈翠萍,等.野生茶树菇YW-2生物学特性及驯化栽培[J].北方园艺,2007(8):208-210.
[22] 张松.柱状田头菇生物学与栽培特性的研究[J].华南师范大学学报:自然科学版,1996(1):64-69.
[23] 吕明亮,应国华,胡美芳,等.柱状田头菇菌丝营养特性研究[J].浙江林学院学报,2002,19(4):437-440.
[24] Kakde R B, Chavan A M. Effect of carbon, nitrogen, sulphur, phosphorus, antibiotic and vitamin sources on hydrolytic enzyme production by storage fungi[J]. Recent Research in Science and Technology,2011,3(5):20-28.
[25] Suzuki G T, Fleuri L, Macedo G A. Influence of nitrogen and carbon sources on riboflavin production by wild strain ofCandidasp.[J]. Food and Bioprocess Technology,2012,5(2):466-473.
[26] 宫志远,于淑芳,曲玲.阿魏侧耳菌丝生长对碳、氮营养需求的研究[J].山东农业大学学报:自然科学版,2002,33(4):418-421.
[27] 程显好,郭顺星.猪苓菌丝固体培养特性的研究[J].中药材,2009,32(1):11-14.
[28] 孟翔鹏,马琳,吕斯琦,等.灰树花母种培养基的筛选及不同碳、氮源对菌丝生长的影响[J].天津中医药大学学报,2011,30(3):175-177.
[29] 武模戈.不同杏鲍菇菌株营养特性的研究[J].濮阳职业技术学院学报,2010,23(5):149-152.
[30] 王丽英,王文治.茶树菇对不同碳氮营养源的利用[J].天津农业科学,2006,12(1):50-51.
[31] 王镭,张婤.柱状田头菇(Agrocybecylindracea)营养菌丝的生物学特性[J].上海农业学报,1993,9(4):23-28.
[32] 金鑫,图力古尔.中国田头菇属三新记录种[J].菌物学报,2012,31(5):795-799.
Isolation, Identification and Biological Characteristics of a Wild Fungus of GenusAgrocybe/
Xie Fang, Wu Pingmin, Zhao Chunqiao(Lanzhou Jiaotong University, Lanzhou 730070, P. R. China)//
谢放,男,1962年5月生,兰州交通大学化学与生物工程学院,副教授。E-mail:xfrankf@163.com。
2013年11月2日。
S646.9
1) 甘肃省科技支撑项目(212256)。
责任编辑:程 红。
