甲基化特异性多重连接探针扩增及甲基化特异性PCR诊断Prader-Willi综合征方法比较
2014-07-19宋红梅邱正庆施惠萍赵时敏
王 薇,魏 珉,宋红梅,邱正庆,施惠萍,赵时敏
中国医学科学院 北京协和医学院 北京协和医院儿科, 北京 100730
·论 著·
甲基化特异性多重连接探针扩增及甲基化特异性PCR诊断Prader-Willi综合征方法比较
王 薇,魏 珉,宋红梅,邱正庆,施惠萍,赵时敏
中国医学科学院 北京协和医学院 北京协和医院儿科, 北京 100730
目的 应用甲基化特异性PCR(methylation-specific PCR,MS-PCR)和甲基化特异性多重连接探针扩增(methylation-specific multiplex ligation-dependent probe amplification,MS-MLPA)方法对Prader-Willi综合征(Prader-Willi syndrome,PWS)进行诊断并比较两种方法的差异。方法 回顾性研究2005年10月至2014年2月到北京协和医院就诊的患儿及正常对照共102例,男57例,女45例。其中正常对照16例;荧光原位杂交或高分辨染色体确诊PWS阳性对照2例;临床疑似PWS患儿84例。提取受试者外周血基因组DNA分别应用MS-PCR及MS-MLPA方法进行基因分析,对疑似患儿进行确诊和遗传类型分型,并计算两种方法的特异性、敏感性及准确度,应用卡方检验对两种方法进行比较。结果 MS-PCR结果示正常对照及阳性对照与其表型全部相符,84例疑似患儿中有39例提示为PWS,45例提示正常。MS-MLPA结果示除正常对照外的86例受试者中,29例提示为父源缺失型PWS;9例提示为母源二体型PWS;47例提示为正常;1例因DNA过于陈旧未检出有效结果。对比两种方法检测结果,有2例MS-PCR结果显示为PWS,但MS-MLPA结果显示为正常,通过增加DNA用量重新进行MS-PCR检测后,除外PWS。结合临床表现,受试者中明确诊断PWS的患儿39例,非PWS者63例。MS-PCR方法共出现2例假阳性,假阳性率为3.17%(2/63)。MS-PCR方法敏感性100%,特异性96.83%,准确度98.03%;MS-MLPA方法敏感性97.43%,特异性100%,准确度99.02%。两种方法的敏感性、特异性及准确度差异无统计学意义(P均>0.05)。结论 MS-PCR及MS-MLPA敏感性、特异性及准确度皆佳,均可用于PWS诊断,MS-MLPA可区分父源缺失型及母源二体型。MS-PCR应保证DNA用量充足以避免假阳性出现。MS-MLPA应使用新鲜提取的DNA,且实验条件要求更为严格。建议同时使用两种方法检测以获得准确结果。
Prader-Will综合征;甲基化特异性PCR;甲基化特异性多重连接探针扩增
MedJPUMCH,2014,5(4):369-375
Prader-Willi综合征(Prader-Willi syndrome,PWS)是多系统异常的复杂临床综合征,新生儿发病率为1∶12 000~15 000[1]。该病为15q11-13区域的父源印记基因缺陷所致,由于基因印记不同,正常人非甲基化的父源等位基因具备功能活性,而甲基化的母源等位基因没有活性[2]。主要临床特征包括:新生儿肌张力低下、发育迟缓、身材矮小、行为异常、童年期开始肥胖、下丘脑性性腺发育不良及长颅、窄脸、杏仁眼、小嘴、薄上唇、嘴角向下的特征性外貌,脊柱侧凸也很常见(37.5%), 且随年龄增长而发病率增高[1,3- 4]。目前已有PWS的临床诊断标准[1],但对于很多疑似患者,仅根据临床症状很难确诊,需要使用分子生物学方法进行遗传基因的分析。PWS患者的主要遗传类型有:15q11- 13区域约 6 Mb的父源染色体缺失(约70%)、母源同源二体(maternal uniparental disomy,mUPD,20%~25%)、印记中心微缺失及突变(1%~5%),以及少量的染色体平衡易位[3]。目前的基因分析诊断方法包括:高分辨染色体分析、荧光原位杂交(fluorescenceinsituhybridization,FISH)、甲基化特异性PCR(methylation-specific PCR, MS-PCR)及甲基化特异性多重连接探针扩增(methylation-specific multiplex ligation-dependent probe amplification, MS-MLPA)等。本实验室已经成功建立MS-PCR诊断PWS的方法[5],该方法便捷、耗时短、特异性高。MS-MLPA是近十年开始兴起的,用于检测拷贝数变异的一种快速、高通量、多位点检测新方法。Nygren等[6]最早应用,目前商品化的试剂盒主要由MRC-Holland公司开发。本研究目的即为分别应用MS-PCR及MS-MLPA方法进行基因分析,对PWS疑似患者进行确诊以及遗传类型分型,并比较两种诊断方法的差异。
对象和方法
研究对象
2005年10月至2014年2月到北京协和医院就诊的患儿及正常对照共102例,男57例,女45例。其中正常对照16例;明确阳性PWS对照2例(作为MS-PCR的阳性对照),这2例患儿据1993年PWS国际临床诊断标准[1],主要诊断标准评分均>8分,1例经过FISH确诊,1例经过高分辨染色体分析证实;临床疑似PWS患儿84例。
外周血DNA提取
在取得受试者知情同意后,取其抗凝静脉外周血,常规提取基因组DNA,置于-20 ℃冰箱保存。2005年10月至2008年9月DNA提取方法为酚-氯仿法抽提DNA,溶于TE保存。2008年9月至2010年7月DNA提取方法为威格拉斯生物技术北京有限公司溶液型试剂提取,溶于TE保存。2010年7月以后应用北京博迈德生物技术有限公司柱型全血DNA提取试剂盒提取,溶于试剂盒中自带的洗脱缓冲液保存。
MS-PCR方法检测
MS-PCR在患者就诊半年内检测,将基因组DNA用CpGenomeTMFast Modification 试剂盒进行亚硫酸盐修饰;以正常人为阴性对照,临床诊断患者为阳性对照,未修饰的基因组DNA为系统对照,应用M(母源)、P(父源)两对引物同时对修饰后产物进行PCR扩增;扩增产物以4%琼脂糖凝胶电泳分离。具体修饰方法、引物序列及PCR条件见文献[5]。
MS-MLPA方法检测
MS-MLPA在2010年开始开展,多数样本在2011年之后检测,之前的患者取冻存DNA进行检测。应用SALSA MLPA ME028试剂盒,按照说明书及参考文献[7]进行操作。MS-MLPA (P028 PWS/AS)探针混合物共有50对探针。100 bp、105 bp分别为X染色体、Y染色体特异性探针,属于性别判断探针。另外29个是PWS/AS判别区(15q11-q12)特异性探针,有9对(含3对消化对照探针,位于184、348、 463 bp)具有HhaⅠ限制性内切酶酶切位点的探针为甲基化敏感性探针,用于判断酶切是否完全。位于348 bp含有HhaⅠ酶切位点的探针,由于其目的基因通常保持完全的非甲基化,不能用作基因分型,所以另外含有HhaⅠ酶切位点的5对探针(位于142、178、190、250、418 bp)是用来判别基因分型的探针[8]。
MS-MLPA每批次所使用的样本尽量应用同一种方法提取的DNA。将100 ng基因组DNA与多重探针杂交16 h过夜后,平均分成两管(C管、M管),分别进行连接及消化反应。其中C管用于拷贝数检测,M管用于进行甲基化检测。连接及消化反应完成后,分别于C管或M管取出5 μl反应液进行PCR反应,反应体系如下:5 μl反应液(C或M),2 μl SALSA PCR缓冲液、13 μl去离子水及5 μl聚合酶混合液。PCR条件:72 ℃预热PCR仪后放入样品,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共35个循环后再72 ℃延伸20 min。将PCR产物于北京擎科生物技术有限公司应用短串联重复序列分离检测方法将同批次的C产物及M产物进行片段检测。应用GeneMarker V1.5软件,以正常人为对照,对结果进行分析。
统计学处理
应用SPSS 19.0统计软件进行统计学处理。计算MS-PCR和MS-MLPA两种方法的敏感性、特异性及准确度。使用卡方检验对两种方法进行比较,P<0.05为差异有统计学意义。同时对两种检测方法的耗时、条件需求等方面进行对比分析。
结 果
MS-PCR检测结果
未经修饰的系统对照不显示任何条带,正常对照同时显示M(174 bp)、P(100 bp)两条带,2例阳性对照均仅显示M带。84例疑似患儿中有39例仅显示M带,提示为PWS,其余45例同时显示M、P两条带,提示为非PWS(图1)。
MS-MLPA检测结果
以正常人拷贝数检测图作为对照,设定内参后进行标准化,正常人拷贝数检测中所有29个PWS/AS判别区探针标准化值(C值)为1;甲基化检测中,3个消化对照探针标准化值(D值)为0,证明HhaⅠ酶切消化完全;5个基因分型特异性探针的标准化值(M值)为0.5(图2A)。在2例临床诊断PWS患儿以及84例临床疑似PWS患儿中,47例疑似患儿C值为1,D值为0,M值为0.5,提示为非PWS(图2B);有29例C值为0.5,D值为0,M值为0.5(图2C、D),提示为父源缺失型PWS;9例C值为1,M值为1,提示为mUPD型PWS(图2E)。1例无有效结果,检测失败。
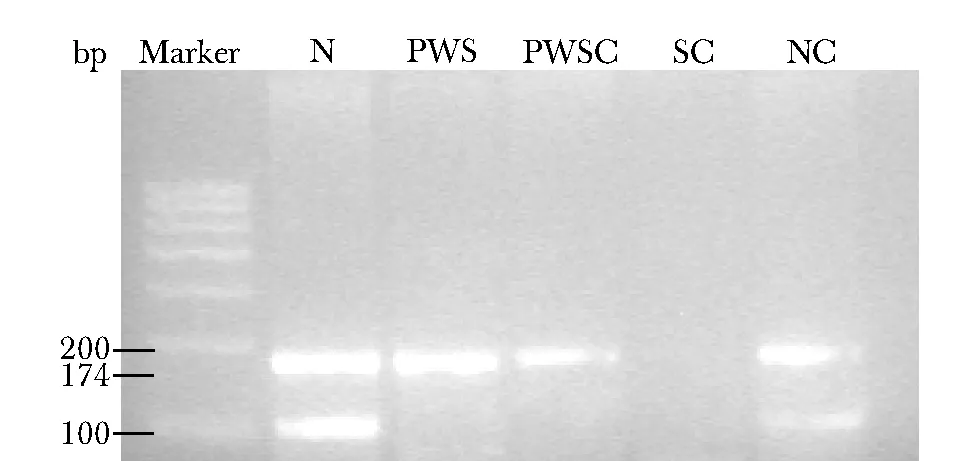
图 1 MS-PCR检测结果N:疑似患儿中提示为非PWS;PWS:疑似患儿中提示为PWS;PWSC:临床确诊的PWS阳性对照;SC:系统对照;NC:正常对照;MS-PCR:甲基化特异性PCR;PWS:Prader-Willi综合征
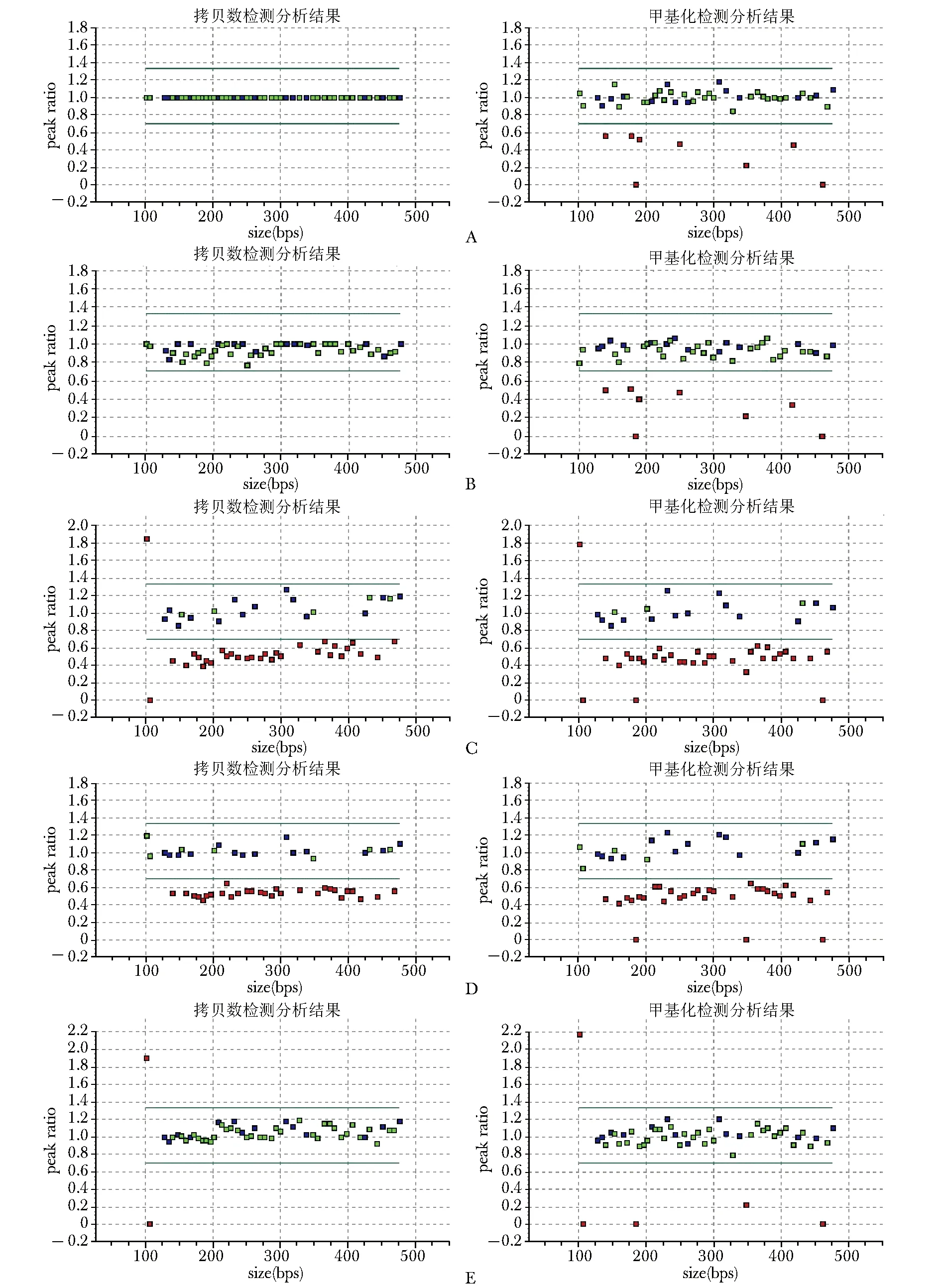
图 2 受试者MS-MLPA分析结果 A.男性正常对照;B.疑似患儿中提示为非PWS的男性患儿;C.疑似患儿中提示为父源缺失型PWS的女性患儿;D.疑似患儿中提示为父源缺失型PWS的男性患儿;E. 疑似患儿中被诊断为母源同源二体型PWS的女性患儿 MS-MLPA:甲基化特异性多重连接探针扩增;PWS:同图1
两种方法特异性、敏感性及准确度比较
102例受试者经两种方法检测,以方法提示为PWS作为阳性结果(+),提示为非PWS作为阴性结果(-),结果两种方法均为阳性38例,均为阴性61例。有2例受试者MS-PCR结果为阳性而MS-MLPA为阴性,重新取冻存的DNA,增加DNA的量至原来的2倍,再次进行MS-PCR后结果提示为阴性,对原结果进行了纠正。有1例MS-MLPA(2011年10月检测)无结果,MS-PCR(2010年8月检测)提示阳性,后取其冻存DNA反复进行了3次MS-MLPA仍无有效结果,因剩余DNA量过少,无法再次进行MS-PCR。本例结合临床资料,其临床评分为8分,达到了临床诊断标准,被诊断为PWS。本研究受试者中最终明确诊断为PWS的患儿39例,非PWS者63例。据此分别计算两种方法的敏感性、特异性及准确度并进行比较,发现两种方法的敏感性、特异性及准确度差异无统计学意义(P均>0.05)(表1)。
在明确分型的38例患者中,mUPD型PWS有9例(23.68%),父源缺失型PWS有29例(76.32%)。
两种方法检测条件及适用范围对比
在方法建立及检测的过程中,MS-MLPA有以下要求:(1)DNA的提取方式及DNA的溶剂应一致,否则容易得到无效结果。(2)每批次不能进行过多样本检测,本实验室能得到有效结果的单次最大样本量为15个,最佳样本量在8个以下。而MS-PCR无这些限制,最多一次检测过30个样本,结果良好,未进行更多样本量尝试。两种方法在其他方面的对比见表2。
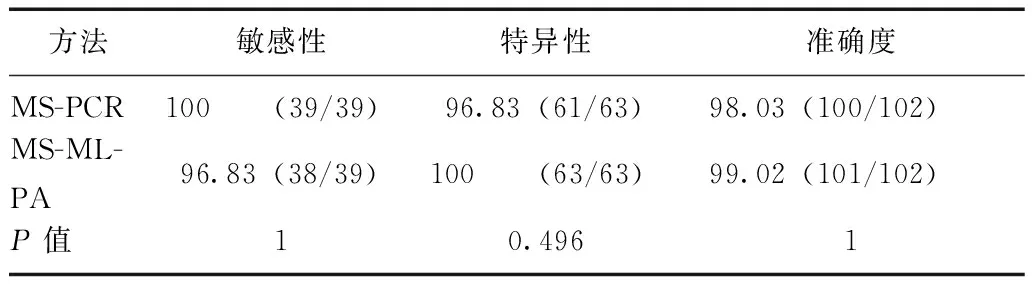
表 1 MS-PCR及MS-MLPA两种方法诊断PWS的敏感性、特异性、准确度比较(%)
MS-PCR、PWS:同图1;MS-MLPA:同图2
讨 论
PWS患者有4种主要遗传类型,其中父源缺失型和mUPD型占90%以上。在目前常用的分子生物学诊断方法中,高分辨染色体分析仅适用于较大的缺失或染色体异常,FISH虽可作为染色体分析的补充,检出存在微缺失的PWS患者,但mUPD型或印记中心突变的患者却由于不存在基因缺失而被漏诊。MS-PCR方法耗时短、需标本量少,是一种快速、高效、特异性、敏感性均佳的分子诊断方法。MLPA是近几年发展起来的一种探测拷贝数量改变的新方法,可以在单一反应中检测多个染色体上不同的位点。MLPA可以用于基因组DNA的检测,也可以用于mRNA的检测。现在已经有超过500个实验室使用MLPA来探测各种基因的重复和缺失,将其应用于多种基因缺失性疾病的诊断。MS-MLPA是检测目的DNA序列是否甲基化的一种MLPA,基于母源与父源甲基化程度的不同,从而对PWS进行诊断。MS-PCR及MS-MLPA可以诊断占PWS绝大多数的父源缺失型和mUPD型,但对于染色体平衡易位和印记中心突变无法检测。
MS-MLPA的甲基化检测原理为[6]:MS-MLPA试剂中含有几对甲基化特异性探针,分别对应不同的检测位点,且最终产物的片段长度不同。每一对特异性探针都由A、B两条探针组成,其中A探针由一段通用引物X及一段序列特异性探针a组成,B探针由一段序列特异性探针b、一段荧光序列及一段通用探针Y组成。基因组DNA经探针杂交后,进行连接反应及特异性限制内切酶的消化反应。由于其甲基化程度不同,甲基化的基因组DNA序列经连接酶将A、B探针连接起来,并且不被内切酶消化;而未被甲基化的基因组DNA序列A、B探针被连接后,由于存在酶切位点而被消化掉。应用通用引物X及Y进行PCR扩增,则连接上的探针可以进行PCR扩增,而被消化掉的探针不能扩增。进行片段分析后即可看出差异。
正常人该区域为CpG岛富含区,且母源染色体甲基化,父源染色体未被甲基化。因此以正常人拷贝数检测图作为对照,设定内参后进行标准化,则非PWS者的拷贝数检测中所有29个PWS/AS判别区探针标准化值(C值)为1;甲基化检测中,由于仅来源于母源的染色体被甲基化,所以在5个基因分型特异性探针的标准化值(M值)为0.5。父源缺失型PWS患者由于父源染色体缺失,C值降为0.5;母源染色体保持甲基化,所以M值仍为0.5。mUPD型PWS患者虽然父源染色体缺失,但由于母源染色体为二体,所以C值为1,M值为1[7]。

表 2 MS-PCR与MS-MLPA检测条件及适用范围对比
MS-PCR、PWS:同图1;MS-MLPA:同图2
PWS及天使综合征(Angleman syndrome,AS)的致病区域均在PWS/AS判别区,这两种方法对该区域检测均可用于诊断这两种疾病,但MS-PCR根据甲基化的不同仅能判断母源染色体或父源染色体是否存在,不能对拷贝数进行定量,所以能诊断但不能判断患者是mUPD型或是父源缺失型。MS-MLPA在进行拷贝数检测上具有独特的优势,可以明确判断患者相应染色体是单体还是双体。再结合甲基化检测,如果检测到的是单体且甲基化的则为PWS;单体未甲基化则为AS;二体均为甲基化则为mUPD型PWS;二体均未甲基化则为父源二体AS;如果一为甲基化,一未甲基化则除外此两种疾病。
本研究中两种方法的特异性、敏感性及准确度都在95%以上,且两种方法比较差异均无统计学意义,说明两种方法特异性、敏感性及准确度皆佳,适用于临床。MS-PCR中2例受试者出现了假阳性(仅出现了M带),假阳性率为3.17%(2/63),经过上调DNA可纠正结果。MS-PCR同时在一管反应液中放入两对引物,在同一种PCR条件下进行扩增,两对引物的最适扩增条件并不完全一致,所以可能会出现某对引物的优势扩增,而导致这种现象。MS-MLPA有1例受试者未检测出有效结果,该受试者进行MS-MLPA时间距DNA提取超过1年,且应用试剂为威格拉斯溶液型试剂盒,该方法所得到的DNA杂质多,会有大块无法溶解絮状物存在,可能DNA被大量降解。MS-MLPA在最初要进行DNA定量,且加入的DNA量很少(100 ng左右),被加入的有效DNA可能远低于测定值,导致结果失败。
两种方法耗时均为2 d,但MS-MLPA所需DNA量远低于MS-PCR,对于新生儿及儿童无法获得更多血样时可以优先选择MS-MLPA。MS-PCR仅能根据两个位点进行判断(M带和P带),而MS-MLPA在单次反应中可以判断数十个拷贝数位点,再结合甲基化的5个位点,其结果可信度高。MS-MLPA实验条件要求更为严格,因为其要进行定量比较,并需要正常对照进行标准化,所以最初加入的DNA质量要好,DNA溶剂、提取方法要一致,才能保证加入的DNA浓度与检测浓度一致,进而保证最后的结果。如果同一批次检测过多样本,每个样本要同时检测两管(C管和M管),会导致各步骤总体操作时间过长,使操作的第一个样本和最后一个样本之间的实际反应时间相差过大,而导致最后的定量失败。所以MS-MLPA单次不能检测过多样本,本实验室经验是8例左右最佳。MS-PCR因为不涉及定量,仅要求定性(判断条带的有或无),所以只需保证DNA质量好、量足够即可,对于提取方法、单批次检测样本量没有限制。
综上所述,本研究通过MS-PCR及MS-MLPA两种方法共同诊断了38例明确分型的PWS,9例为mUPD型,29例为父源缺失型,其比例基本符合国际上的报道。两种方法的特异性、敏感性及准确度皆佳且无明显差异。MS-MLPA及MS-PCR最好使用新鲜DNA,并应用能获得高质量的DNA提取方法。MS-MLPA用血量少,适用于儿童,但其检测要求严格,样本量大且DNA来源广泛不一致时可以选择MS-PCR。为了对患者负责,最好两种方法同时进行,以降低误诊率。对于临床高度怀疑PWS,但两种方法均提示正常的患者可以进行高分辨染色体分析,探讨是否存在染色体平衡易位,或者测序寻找是否存在印记中心基因突变。
[1]Gunay-Aygun M, Schwartz S, Heeger S, et al. The changing purpose of Prader-Willi syndrome clinical diagnostic criteria and proposed revised criteria[J]. Pediatrics, 2001,108: E92.
[2]Nicholls RD, Saitoh S, Horsthemke B. Imprinting in Prader-Willi and Angelman syndrome[J]. Trends Genet, 1998, 14: 194- 200.
[3]Jiang YH, Wauki K, Liu Q, et al. Genomic analysis of the chromosome 15q11-q13 Prader-Willi syndrome region and characterization of transcripts for GOLGA8E and WHCD1L1 from the proximal breakpoint region[J]. BMC Genomics, 2008, 9:50.
[4]de Lind van Wijngaarden RF, de Klerk LW, Festen DA, et al.Scoliosis in Prader-Willi syndrome: prevalence,effects of age, gender, body mass index, lean body mass and genotype[J]. Arch Dis Child, 2008,93: 1012- 1016.
[5]王薇,吴晓燕,宋红梅,等.甲基化特异性PCR方法诊断Prader-Willi综合征[J].中国当代儿科杂志,2008,10:486- 488.
[6]Nygren AO, Ameziane N, Duarte HM, et al.Methylation-specific MLPA (MS-MLPA): simultaneous detection of CpG methylation and copy number changes of up to 40 sequences[J].Nucleic Acids Res, 2005, 33:e128.
[7]Bittel DC, Kibiryeva N, Butler MG.Methylation-specific multiplex ligation-dependent probe amplification analysis of subjects with chromosome 15 abnormalities[J].Genet Test, 2007,11:467- 475.
[8]Procter M, Chou LS, Tang W, et al.Molecular diagnosis of Prader-Willi and Angelman syndromes by methylation-specific melting analysis and methylation-specific multiplex ligation-dependent probe amplification[J].Clin Chem, 2006,52:1276- 1283.
Comparison between Methylation-specific Multiplex Ligation-dependent Probe Amplification and Methylation-specific PCR in Diagnosis of Prader-Willi Syndrome
WANG Wei,WEI Min,SONG Hong-mei,QIU Zheng-qing, SHI Hui-ping, ZHAO Shi-min
Department of Pediatrics, Peking Union Medical College Hospital,Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730,China
SONG Hong-mei Tel: 010-69156271, E-mail:songhm1021@hotmail.com
Objective To compare the diagnostic effectiveness of methylation-specific PCR (MS-PCR) and methylation-specific multiplex ligation-dependent probe amplification (MS-MLPA) in clinical suspected Prader-Willi syndrome (PWS). Methods One hundred and two participants (57 males and 45 females) who visited Peking Union Medical College Hospital in the period from October 2005 to February 2014 were included in
this retrospective study. Among the 102 participants, 16 were normal controls, 2 PWS cases confirmed by fluorescenceinsituhybridization or high resolutin banding were positive controls, and 84 were suspected PWS cases. Genomic DNA was extracted for MS-PCR and MS-MLPA, based on which diagnoses were made and genetic types distinguished. Chi-squared test was used to compare the sensitivity, specificity, and accuracy of the two methods. Results MS-PCR results showed that all normal controls and positive controls were conform to their phenotypes. Thirty-nine in the 84 suspected patients were shown to be PWS, and the other 45 to be normal. MS-MLPA showed that in the 86 non-normal participants (positive control and suspected cases), 29 had paternal deletions, 9 had maternal uniparental disomy (mUPD), 47 were normal; and the assay failed to produce effective result in 1 case due to the overlong DNA storage time. Two participants were diagnosed as PWS cases by MS-PCR but normal by MS-MLPA. The diagnosis of PWS was ruled out by repeat MS-PCR after doubling DNA dosage. Combined with clinical manifestations, 39 participants were definitively diagnosed as PWS, the other 63 were not PWS. The false-positive rate of MS-PCR was 3.17%(2/63).The sensitivity, specificity, and accuracy of MS-PCR were 100%, 96.83%, and 98.03%, respectively; while those indicators of MS-MLPA were 97.43%, 100%, and 99.02%, respectively, showing no significant difference (allP>0.05). Conclusions Both MS-PCR and MS-MLPA have high sensitivity, specificity, and accuracy, thus are effective for PWS diagnosis. MS-MLPA can distinguish paternal deletion and mUPD. Enough dose of DNA is requisite in MS-PCR to avoid false-positive results. Freshness of DNA samples is essential in MS-MLPA, which also needs more strict performance standards. We suggest a combination of MS-PCR and MS-MLPA in diagnosing PWS to ensure the accuracy of the result.
Prader-Will syndrome; methylation-specific PCR; methylation-specific multiplex ligation-dependent probe amplification
杨森科学研究委员会中国分会研究基金(2011—2012年)和北京协和医院中青年基金(2012年)
宋红梅 电话:010-69156271, E-mail:songhm1021@hotmail.com
R394-33
A
1674-9081(2014)04-0369-07
10.3969/j.issn.1674-9081.2014.04.003
2014- 08- 04)
