格氏栲林土壤微生物结构的多样性特征研究
2014-07-18马瑞丰刘金福吴则焰张广帅陈志芳何中声
马瑞丰 刘金福 吴则焰 张广帅 陈志芳,2 洪 伟 何中声
(1. 福建农林大学林学院,福建 福州 350002;2.福建农林大学海峡自然保护区研究中心,福建 福州 350002;3. 福建省高校生态与资源统计重点实验室,福建 福州 350002;4.福建农林大学生命科学学院,福建 福州 350002)
格氏栲林土壤微生物结构的多样性特征研究
马瑞丰1,2,3刘金福1,2,3吴则焰4张广帅1陈志芳1,2洪 伟1,2,3何中声1,2,3
(1. 福建农林大学林学院,福建 福州 350002;2.福建农林大学海峡自然保护区研究中心,福建 福州 350002;3. 福建省高校生态与资源统计重点实验室,福建 福州 350002;4.福建农林大学生命科学学院,福建 福州 350002)
采用磷脂脂肪酸(PLFA)方法,探讨格氏栲林土壤微生物的多样性特征。结果表明,共检测出33种PLFA标记物,总量为211.053 μg/g;天然林与林场交界处(NPF)的PLFA种类最多,为26种;格氏栲马尾松天然混交林(NF2)次之,为23种;格氏栲人工林(CK)为19种,格氏栲木荷天然混交林(NF1)的PLFA为18种,种类最少。各林型的PLFA含量大小排序为NF2((72.71±14.76)μg/g)>CK((49.50±4.87)μg/g)>NF1((46.43±5.77)μg/g)>NPF((42.41±8.07)μg/g)。运用优势PLFA(含量大于1.9%)计算各林型的环境适应性指数,细菌/真菌(B/F)为4.942,革兰氏阳性细菌/革兰氏阴性细菌(G+/G-)为1.865,土壤微生物压力指数(cy17∶0/16∶1ω7c)为0.287,表明格氏栲林对抗外界干扰能力强。主成分分析(PCA)解释了PLFA变异的87.43%。可见,格氏栲林土壤微生物群落结构有较强的区域分异特征。
格氏栲林;土壤微生物;结构多样性;PLFA
4.College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou Fujian 350002, China )
在森林生态系统中,土壤微生物的空间分布受多种因素影响,而土壤表层是其分布最为丰富的区域[1-2],该区域物种交互作用强,食物供应充足,最能反映其生态系统特性。土壤微生物多样性及其变化是生态系统功能的敏感指标,能很好地指示森林生态环境和系统功能的变化。目前,有关土壤微生物的研究主要集中在农作物连作[3]、森林生态[4]、环境监测[5]等多方面,研究方法也在逐步完善[6]。
格氏栲(CastanopsiskawakamiiHayata)是中亚热带南缘特有的壳斗科常绿阔叶大乔木,属珍稀濒危植物,自然分布窄,在福建三明小湖地区有近700 hm2以格氏栲占优势的林分,是目前全世界独一无二的面积大、纯度高的格氏栲林。自建立保护区以来,引起广大学者高度关注:刘金福等[7-9]探讨了格氏栲种群保护生态学特征、林窗更新、土壤养分;杨玉盛等[10-11]探讨了不同起源格氏栲林凋落物、土壤养分循环规律,认为格氏栲天然林枯枝落叶层中养分贮量、分解速率与养分释放均高于人工林,而林内土壤微生物群落结构多样性及其土壤生态功能评价至今尚未见报道。为此,采用PLFA技术研究格氏栲林内土壤微生物结构的多样性,很有必要,能为格氏栲林生态系统可持续管理及其红壤区生态功能合理评价提供科学依据。
1 自然概况
格氏栲自然保护区位于福建省三明市西南部,面积约700 hm2,地处北纬26°07′~26°10′,东经117°24′~117°27′,属武夷山东伸支脉,海拔200~ 500 m。年均气温19.4 ℃,最低温度 -5.5 ℃,最高温度40.0 ℃,年积温 6 215 ℃;平均降雨量 1 500 mm,属典型的亚热带湿润季风气候。土壤类型为暗红壤,其次为紫色土,土层较厚,且腐殖质丰富,水肥条件较好,植物种类丰富。保护区以格氏栲为优势种,其平均胸径50.2 cm,平均树高25 m,以木荷(Schimasuprba)、马尾松(Pinusmassoniana)、米槠(Castanopsiscarlesii)、栲树(Castanopsisfargesii)、虎皮楠(Dajphnipyllumoldhamii)、杜英(Elaeocarpuschinensis)等为伴生种。格氏栲人工林,其乔木层结构单一,平均胸径24 cm,平均树高20 m,为1966年火烧采伐后经人工营造[12]。
2 研究方法
2.1 样地设置与样品采集
2013年12月,在保护区内选择具有代表性的4个林型,即格氏栲-木荷(NF1)、格氏栲-马尾松(NF2)、景区(天然林为主)与莘口林场(人工林为主)交界处选取样地(NPF)、与天然林相邻的格氏栲人工林(CK),立地情况见表1。每个林型分别取1块面积40 m×40 m的样地,在每块样地设置4个10 m×10 m的小样方,每木检尺。采用三点法环刀在每个样方内表层土(0~10 cm)取土样,并均匀混合装袋密封,记录采样点的经纬度、海拔、土壤温度及光照强度。4个林型地共取16个土壤样品,将土壤装进随身携带的冰盒后带回实验室,充分混匀,分为2份。1份过2 mm筛后放在4 ℃冰箱,用于土壤微生物磷脂脂肪酸测定;另1份自然风干后过筛,用于土壤理化性质测定。
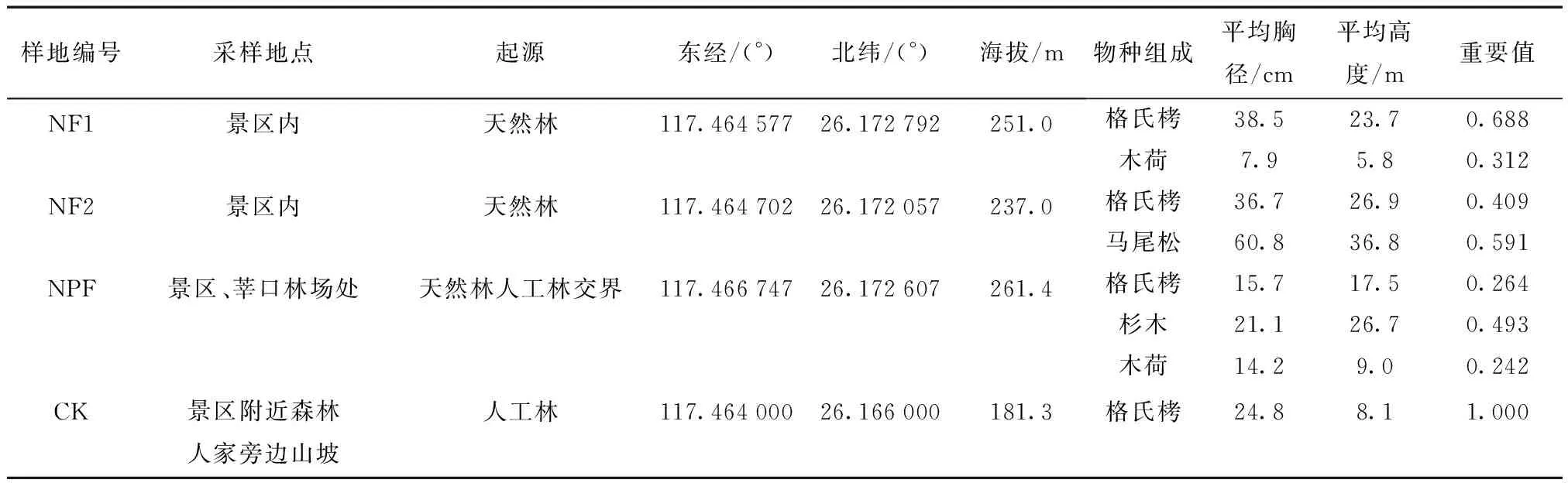
表1 格氏栲林4种林型地的立地条件
2.2 土壤理化性质测定
土壤理化性质采用常规方法《森林土壤分析方法》[13]测定。主要测定土壤含水率、全氮(TN)、全磷(TP)、全钾(TK)、有机质(OM)、水解氮(AN)、速效磷(AP)、速效钾(AK)、土壤pH等。每个土壤样品3次重复,取平均值。
2.3 磷脂脂肪酸的分离与气相色谱检测
土壤微生物群落结构分析采用PLFA生物标记法[14]。具体步骤:将采回的新鲜土壤4 g加入含有 20 mL 0.2 moL/L KOH-CH3OH溶液的50 mL离心管中,振荡5 min,并于37 ℃水浴温浴1 h,每10 min振荡1次;加入 3 mL 1.0 mol/L 的醋酸溶液中和pH,充分摇匀,再加入10 mL正己烷,充分摇匀,使 PLFA 转到有机相;再将其在 1 000 r/min下离心 15 min,打开管盖,取5 mL上层正己烷于干净玻璃试管中,吹氮气使溶剂挥发;在玻璃试管中加入 1 mL 体积比为1∶1的正己烷甲基丁基醚溶液,充分溶解3~ 5 min,转入GC小瓶中,-20 ℃保存,做GC-MS分析(所用有机溶剂均为色谱纯试剂)。采用Varian 240 GC-MS检测磷脂脂肪酸,方法如下:进样口温度为280 ℃,分流比为20∶1,柱温箱程序升温为70 ℃起始,保持1 min,以20/min升温至170 ℃,保持2 min,再以5/min升温至280 ℃,保持5 min,最后以40/min升温至300 ℃,保持1.5 min。
2.4 磷脂脂肪酸的命名与含量测定
参考Frostagard[15]命名法,PLFA的通式为 X∶YωZ。其中,X表示脂肪酸主链碳原子总数,从羧基开始;Y代表不饱和双键数目;Z代表双键的位置(距甲基末端);ω代表含有双键。
磷脂脂肪酸具有结构多样性和生物特异性,作为微生物群落中不同种群的标记物。通过对其定量测定,可识别微生物量和土壤微生物群落结构。PLFA∶a16∶0,i16∶0,a17∶0,i17∶0,i18∶0等表示革兰氏阳性菌;cy17∶0、cy19∶0等表示革兰氏阴性菌;10Me17∶0,10Me18∶0等表示放线菌;18∶3ω6c(6,9,12),18∶1ω9c等表示真菌[16]。其中,c和t分别表示顺势和反势双键,i和a分别表示有异构和反异构甲基支链,br表示位置未知的甲基支链,Me表示甲基侧链位置,cy代表环丙基,OH前的数字表示羟基位置。脂肪酸定量用峰面积和内标曲线法,所用标样为内标为甲酯化的19∶0,含量用(μg/g)表示。
2.5 数据处理
罗扎诺夫在《陀思妥耶夫斯基的一个卓越想法》(Одна из замичательных идей Достоевского)一文中评论了《地下室手记》中提出的思想,提出了“瘙痒”的观念或想法:
数据统计整理采用Excel 2010、SPSS 19.0软件、主成分分析(PCA)采用CANOCO 5.0。
3 结果分析
3.1 土壤微生物特征
调查样地土壤环境特征见表2。整体上物理性质差异不显著,其中,容重表现为人工林>天然林>人工林-天然林交界处,含水量和孔隙度均表现为天然林>人工林>人工林-天然林交界处;土壤养分含量差异性明显,NF2与NPF土壤肥力高,CK各项土壤养分指标均为最小值,pH为3.87±0.02~4.07±0.02,属典型的南方酸性土壤。
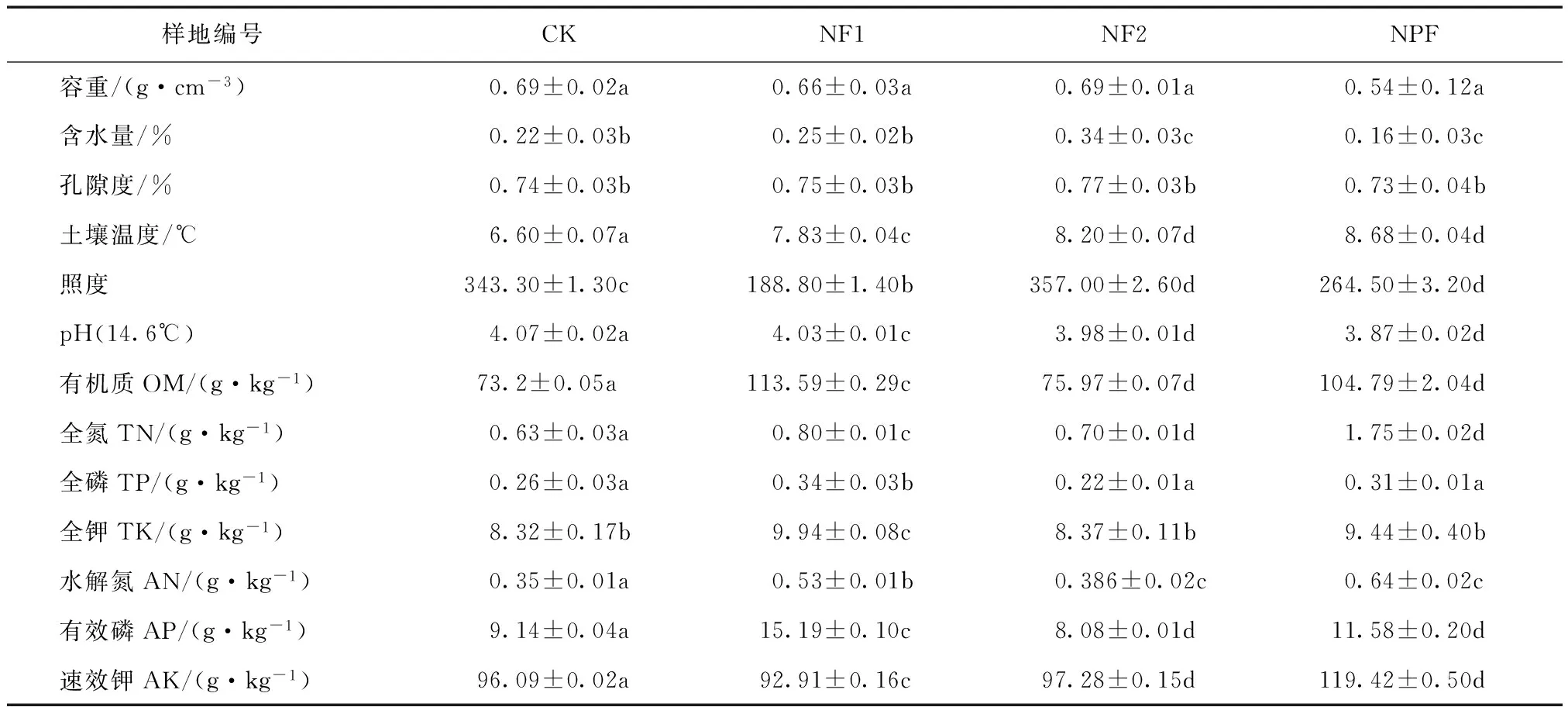
表2 研究样地土壤环境特征
3.1.1 土壤微生物的PLFAs含量及组成 共检测到33种PLFA标记物,总量为:211.053 μg/g。其中CK检测到19种PLFA标记物,总量为(49.50±4.87)μg/g;NF1检测到18种,总量为(46.43±5.77)μg/g;NF2检测到23种,总量为(72.71±14.76)μg/g;NPF检测到26种,总量为(42.41±8.07)μg/g。
筛选其中含量大于1.9%的优势PLFA(196.256 μg/g)进行结构多样性分析,共有15种(见表3):i16:0、cy19:0、a17:0、18:2ω6、18:1ω9c、18:0、16:1ω7c、15:0、i14:0、9Me18:0、10Me18:0、a15:0、i19:0、9Me15:0、cy17:0。
3.1.2 土壤微生物环境适应性指数测定 选取细菌/真菌、革兰氏阳性细菌/革兰氏阴性细菌、土壤微生物压力指数(cy17:0/16:1ω7c)作为评价土壤微生物群落对环境适应程度的具体指标,其差异性特征见表4。
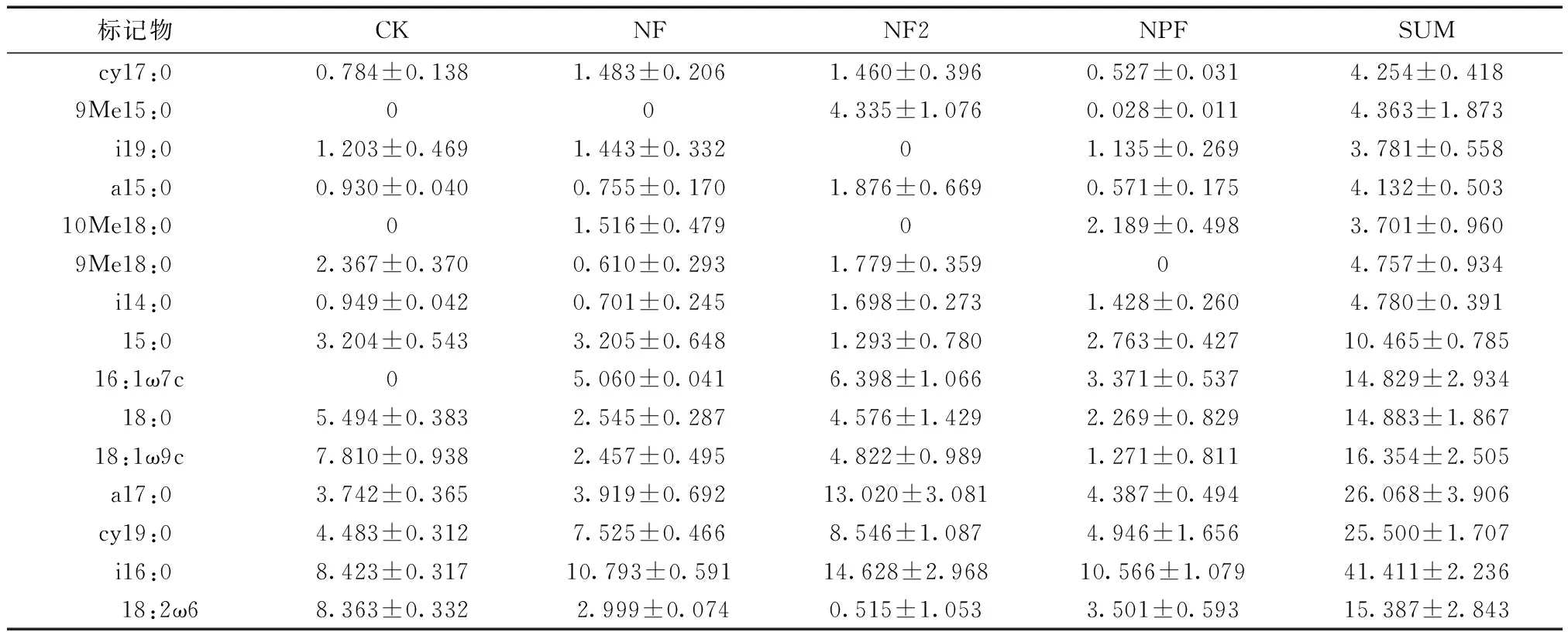
表3 样地优势PLFAs
注:SUM=CK+NF1+NF2+NPF

表4 环境适应性指数
注:B/F:细菌/真菌、G+/G-:革兰氏阳性细菌/革兰氏阴性细菌;cy17∶0/16∶1ω7c:土壤微生物压力指数,下同。
B/F的计算结果为,NF2>NPF>NF1>CK。G+/G- 值最大为CK(3.116),NF1、NF2及NPF比值较一致,分别为NF1(1.923)、NF2(2.012)、NPF (1.917)及SUM(1.865)。土壤微生物压力大小顺序为:NF1>NF2>NPF,SUM为0.287。表4中CK数值未估算,因检测出16:1ω7c含量极其微小(≈0),因CK外界环境压力较大,自身系统受人工干扰稳定性较其他差。
对各林型土壤微生物结构多样性进行主成分分析,结果见图1、表5。根据各样地土壤微生物PLFA数据,应用CANOCO5.0作PCA二维排序图,4个轴对PLFA变异的总解释高达97.47%,第1排序轴贡献率为57.57%,第2排序轴贡献率为35.86%。前两个轴累积贡献率为87.43%,对PLFAs分布差异解释能力强。
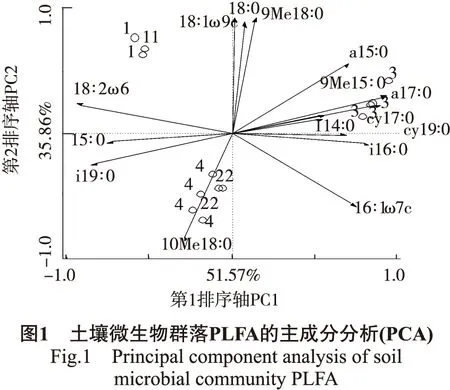
表5 PCA参数
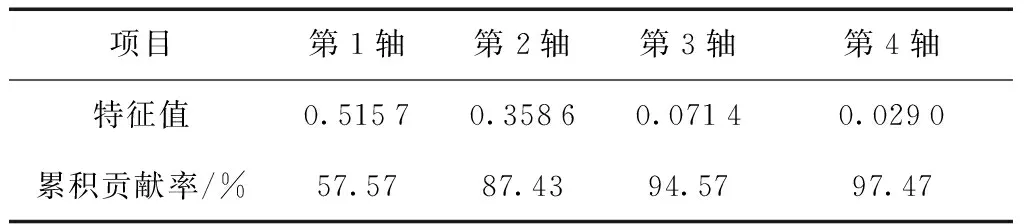
项目第1轴第2轴第3轴第4轴特征值0.51570.35860.07140.0290累积贡献率/%57.5787.4394.5797.47
从图1可知,与排序轴第1轴相关性较强的标记物为cy19:0、cy17:0及15:0等,其中与cy19:0、cy17:0及i14:0等呈正相关,与15:0、i19:0及 18:2ω6 呈负相关;第1主成分载荷量相对较高的标记物有9Me15:0、18:2ω6等。与排序轴第2轴相关性较强的标记物为18:1ω9c、18:0、10Me18:0及9Me18:0等,其中与18:1ω9c、18:0及9Mω18:0呈正相关,与10Me18:0呈负相关,且4种标记物载荷量均高。样方距离大小表示样方间微生物群落结构的相似程度,距离越近相似程度越高,4类样地总体微生物群落结构异质性较强,NF1和NPF土壤微生物群落结构相似性高。
4 结论与讨论
已检测到4种典型林型土壤微生物特征脂肪酸(PLFA)共计33种,总量高达211.053 μg/g。PLFA种类数量大小排序为,NPF(26)>NF2(23)>CK(19)>NF1(18),含量大小排序为,NF2((72.71±14.76)μg/g)>CK((49.50±4.87)μg/g)>NF1((46.43±5.77)μg/g)>NPF((42.41±8.07)μg/g)。NPF林型呈现出PLFA种类丰富而含量最小,可能与其多样性的植被、种类丰富“食物”来源汇集了功能类群多样的微生物、相对低的土壤质量限制了微生物大量繁殖等有关。NF2的PLFA种类含量均处于较高水平,作为格氏栲林常见的混交林型,其土壤质量及生态系统均处于最优水平。CK位于第3位,格氏栲人工纯林的生态稳定性与天然林具有较大差异。NF1的PLFA种类最少且数量低,可能原因是其阔叶混交林位于格氏栲景区、人为干扰对其产生影响,导致其生态系统稳定性比格氏栲-马尾松林差。可见,格氏栲林土壤微生物多样性呈现出明显的异质性。
由于B/F的计算从分子浓度到生物量之间换算存在着困难,仅B/F质量比的直接计算结果来表征两种群落相对丰富程度及土壤养分代谢方式的差异性特征。从图1可知,NF2的B/F值最大,表明其细菌种类与含量高于真菌,养分代谢以细菌分解占主导地位,土壤肥力具有有机质降解快速、氮矿化率高等特点;CK林型B/F值最小,即其土壤中细菌处于竞争劣势,养分代谢以真菌占据主导位置,土壤代谢特点为氮与能量转化缓慢,有利于有机质贮存和氮的固持;NF1、NPF土壤微生物B/F值介于前两者之间,即该区B/F水平适中,土壤能量循环、物质代谢丰富,周转速率较快,与毕明丽等[17]研究结果一致。样地均选自森林土壤,相比于城市土壤和农田土壤本身即具有较强的生态稳定性。故仅针对其比值相对大小对土壤养分代谢类型进行合理解释。
革兰氏阳性细菌拥有较厚的细胞壁且能产生孢子,其种群抗压性较强,不易发生变化[18],而革兰氏阴性细菌对碳源较敏感,极易改变[19]。G+/G-用以表征环境的差异性,CK与其他林型差距大,主要与其革兰氏阴性菌较其他3块样地少有关。CK土壤肥力特征与其他林型具显著性差异,CK为人工林,其他均为天然林。可见,不同起源的森林类型使得微生物结构多样性产生变异进而影响土壤肥力。
土壤微生物压力指数可表征土壤微生物受到外源胁迫的大小。其中CK的16:1ω7c含量稀少,土壤微生物压力指数缺失,主要原因是人工林外源干扰严重且自身稳定性较差,生态系统已难以自我修复。微生物是表征环境变化的最敏感指标,此结果与实际观测相符。其他林型较少受到人类干预且自身拥有较强的生态稳定性。可见,各林型生态系统环境压力较小,尤其是天然林。
PCA分析(见图1)将林型分为3组,第1组为CK,其与18:1ω9c及18:2ω6相关性较大,二者为真菌的PLFA标记物,人工林中真菌比天然林中数量大,即人类活动是林地地上部分微生物区系的重要影响因子。第2组为NF1+NPF,10Me18:0(放线菌)与该地相关性较强,放线菌对土壤养分趋向明显,对于土壤有机质的分解和养分释放起着重要作用。第3组为NF2,与大多数PLFA标记物相关性较大,马尾松、格氏栲的天然混交模式,更利于其土壤微生物的结构多样性,进而加强土壤自肥作用。
一般而言,天然林向人工林过渡的区域,土壤理化性质、微生物多样性可能低于天然林而高于人工林。但试验结果与实际情况相反,可能是莘口林场长期荒废,人为干扰逐渐减少,而交界处植物物种丰富。该林型土壤pH最小,可能受杉木针叶凋落物影响导致土壤酸化,但为土壤表层微生物提供了丰富的碳源、氮源等物质基础,促成微生物含量低,结构更为多样性。针对天然林内部土壤微生物多样性异质性大的现象,应加强补救措施保护受损区域。
PLFA技术是目前研究微生物代谢结构多样性的重要方法,已被应用于各类环境下微生物群落的研究[18]。能解译林地土壤微生物结构的差异性,从而揭示格氏栲林土壤生态系统特性。也可试采用T-RFLP、DGGE等先进技术,对格氏栲天然林的高度异质性环境、幼苗更新、土壤养分循环等科学问题做进一步探讨。
[1] Fierer N, Schimel J P , Holden P A. Variations in microbial community composition through two soil depth profiles[J].Soil Biology & Biochemistry,2003,35:167-176.
[2] Steenwerth K L,Drenovsky R E ,Lambert J J,et al.Soil morphology, depth and rapevine root frequency influence microbial communities in a Pinot noir vineyard[J].Soil Biology & Biochemistry,2008,40:1330-1340.
[3] Wu Linkun, Li Zhenfang, Li Ji,et al. Assessment of shifts in microbial community structure and catabolic diversity in response toRehmanniaglutinosamonoculture[J].Applied Soil Ecology,2013,67:1-9.
[4] 鲁顺保,张艳杰,陈成榕.基于BIOLOG指纹解析三种不同森林类型土壤细菌群落功能差异[J].土壤学报,2013,50(3):618-623.
[5] 唐丽娜,张秋芳,刘波,等.有机肥与化肥配施对烤烟土壤微生物群落PLFAs动态的影响[J].土壤肥料科学,2008,24(12):260-265.
[6] Zaady E, Ben-David E A, Sher Y, et al. Inferring biological soil crust successional stage using combined PLFA,DGGE, physical and biophysiological analyses[J]. Soil Biology & Biochemistry,2010,42:842-849.
[7] Liu J F,Hong W,Pan D M, et al. A study on multidimensional time series model of individual age’s measurement inCastanopsiskawakamiipopulation[J].Acta Ecological Sinica.2009,29(4):232-236.
[8] 刘金福,苏松锦,何中声,等.格氏栲天然林土壤有机碳空间分布及其影响因素[J].山地学报,2011,29(6):641-648.
[9] He Z S,Liu J F,Wu C T,et al. Effects of forest gaps on some microclimate variables inCastanopsiskawakamiinatural forest[J].Journal of Mountain Science,2012,9(5):706-714.
[10] Yang Y S,Lin P,Guo J F,et al.Litter production, nutrient return and leaf-litter decomposition in natural and monoculture plantation forests ofCastanopsiskawakamiisubtropical China[J]. Acta Ecologica Sinica,2003,23(7):1278-1289.
[11] 杨玉盛,刘艳丽,陈光水,等.格氏栲天然林与人工林土壤非保护性有机C含量及分配[J].生态学报2004,24(1):1-8.
[12] 林大仪.土壤学实验指导[M].北京:中国林业出版社,2004.
[13] 张秋芳,刘波,林营志,等.土壤微生物群落磷脂脂肪酸PLFA生物标记多样性[J].生态学报,2009,29(8):4127-4137.
[14] Frostegard A, Tunlid A,Baath E.Phospholipid fatty acid composition,biomass and activity of microbial communities from two soil types experimentally exposed to different heavy metals[J].Applied and Environmental Microbiology,1993,59:3605-3617.
[15] 时鹏,王淑平,贾书刚,等.三种种植方式对土壤微生物群落组成的影响[J].植物生态学报,2011,35(9):965-972.
[16] 毕明丽,宇万太,姜子绍,等.利用PLFA方法研究不同土地利用方式对潮棕壤微生物群落结构的影响[J].中国农业科学,2010,4(9):1834-1842.
[17] Huang H L,Zhang S Z,Wu N Y,et al.Influence ofGlomusetunicatum/Zeamaysmycorrhiza on atrazine degradation,soil phosphatase and dehydrogenase activities,and soil microbial community structure[J].Soil Biology and Biochemistry,2009,41:726-734.
[18] Zhang C,Liu G B,Xue S,et al. Effect of different vegetation types on the rhizosphere soil microbial community structure in the loess plateau of China[J].Journal of Integrative Agriculture,2013,12(11):2103-2113.[19] Byss M,Dana E,Jan T,etal.Fungal bioremediation of the creosote-contaminated soil:influence ofPleurotusostreatusandIrpexon polycyclic aromatic hydrocarbons removal and soil microbial community composition in the laboratory-scale study[J].Chemosphere,2008,73:1518-1523.
(责任编辑 赵粉侠)
Soil Microbial Community Structure Diversity inCastanopsiskawakamiiForest
MA Rui-feng1,2,3, LIU Jin-fu1,2,3,WU Ze-yan4, ZHANG Guang-shuai1,CHEN Zhi-fang1,2, HONG Wei1,2,3,HE Zhong-sheng1,2,3
(1.College of Forestry, Fujian Agriculture and Forestry University, Fuzhou Fujian 350002,China;2.Cross-Strait Nature Reserve Research Center, Fujian Agriculture and Forestry University, Fuzhou Fujian 350002,China;3. Key laboratory of Fujian Universities for Ecology and Resource Statics,Fujian Agriculture and Forestry University, Fuzhou Fujian 350002, China;
Phospholipid fatty acid (PLFA) method is used to study the soil microbial diversity inCastanopsiskawakamiiforest. The results showed that 33 PLFA markers were detected with a total of 211.053 μg/g. There had the biggest PLFA markers(26) party at the junction of natural and plantation forest(NPF), the next was natural mixed forest ofC.kawakamiiandPinusmassoniana(NF2)(23), monoculture plantations ofCastanopsiskawakamii(CK)(19) and natural mixed forest ofC.kawakamiiandSchimasuperba(NF1)(18). The sort of total PLFA in these four sites was: NF2((72.71±14.76)μg/g)>CK((49.50±4.87)μg/g)>NF1((46.43±5.77)μg/g)>NPF((42.41±8.07)μg/g). Using dominant PLFAs to calculate the environmental adaptability indexes and getting the following results: Bacteria/fungi (B/F) was 4.942, gram positive bacteria/gram-negative (G+/G-) bacteria was 1.865, soil microbial pressure index (cy17∶0/16∶1ω7c) was 0.287. These indexes revealed that the soil circulation system had strong pressure feedback ability. Principal component analysis (PCA) explains why the variation PLFA of was 87.43%. The results showed that the soil microbial community structure had strong regional distribution characteristics.
Castanopsiskawakamiiforest; soil microbial; community structure; PLFA
2014-04-10
福建省自然科学基金重点项目(2008J0008)资助
刘金福(1966—),博士,教授。研究方向:森林生态学、野生动植物保护与利用、生态旅游。Email:fjljf@126.com。
10.3969/j.issn.2095-1914.2014.04.003
S718.5;Q938
A
2095-1914(2014)04-0014-06
第1作者:马瑞丰(1988—),女,硕士生。研究方向:植物地理学、土壤生态学。Email: maruifeng14@hotmail.com。
