含2-氨甲基苯并咪唑铜(Ⅱ)配合物的合成、表征、抑菌活性及与DNA作用的研究
2014-07-12段冉冉周晓华
王 璐,段冉冉,赵 盼,周晓华,2
(1 华南农业大学 理学院,广东 广州510642;2 华南农业大学 生物材料研究所,广东 广州510642)
设计配合物分子的形状、对称性以及官能团结构,使其与DNA 分子匹配,从而对DNA 进行特异性识别,这一系列的研究工作是寻找新型DNA 结构探针、DNA 断裂剂、化学核酸酶和杀菌剂的研究基础,已引起科学界的广泛重视[1-3].研究表明,DNA 特异性结合剂Lexitropsin 分子中都含有咪唑、吡咯和噻唑氨羰基基团[4].2-取代苯并咪唑是苯并咪唑的重要衍生物,其化学和生物活性往往高于其他位置取代的衍生物.其中,2-氨甲基苯并咪唑(AMB)在结构上非常类似咪唑、嘌呤碱和嘧啶碱等生物配体,能与生物酶和受体等形成氢键、发生疏水作用和π-π相互作用,且具有良好的抗寄生物、抗癌和抗菌等活性[5-8].目前含AMB 配体的配合物虽已有一些报道[7-11],但大多只研究了晶体结构、热稳定性和光学性质,AMB 与DNA 的特异性识别研究报道很少[8-9].因此研究AMB-过渡金属(Ⅱ)配合物不仅有助于了解其结构与生物活性的关系,而且为设计DNA 的特异性识别剂和断裂剂奠定理论依据.本文以AMB作主配体,以邻菲咯啉(phen)为辅配体,合成了2 个配合物:[Cu(AMB)2Cl]Cl·4H2O(配合物1)和[Cu(AMB)(phen)Cl]Cl·2H2O(配合物2).通过元素分析、IR、UV 和摩尔电导率等方法对配合物进行了组成和结构表征.用二倍稀释法测试了2 个配合物的最小抑菌浓度(MIC),用紫外光谱(UV-Vis)、荧光光谱、相对黏度及琼脂糖凝胶电泳法初步研究了配合物与小牛胸腺DNA(ct-DNA)的相互作用.
1 材料与方法
1.1 仪器与试剂
上海宇隆仪器有限公司DDS-12A 型电导率仪;美国Nicolet 360 FT-IR 型红外光谱仪(KBr 压片);德国Elementar Vario EL Cube 元素分析仪;日本岛津UV-2550 型紫外/可见分光光度计;日本岛津RF-5301PC 荧光光谱仪;上海晶菱玻璃有限公司乌氏黏度剂;大连捷迈科贸有限公司凝胶电泳池;意大利米兰BIO-RAD Laboratories-Segrate 公司BIO-RAD 凝胶成像系统.
AMB·2HCl 参照文献[12]合成.ct-DNA、Tris、溴化乙啶(EB)、琼脂糖凝胶和pBR322 DNA 为生化试剂,其他试剂为分析纯.
1.2 配合物的合成
配合物1:称取1 mmol AMB·2HCl 溶于10 mL蒸馏水中,并用NaOH 调pH7~8,加入0.5 mol·L-1CuCl2溶液1.0 mL,反应10 min,并调pH 4.8,50 ℃条件下加热搅拌15 min,冷却至室温,过滤,室温静置1 d 后析出蓝色固体1,过滤并依次用少量水和乙醇洗涤后干燥.
配合物2:合成方法与配合物1 相似.按照n(Cu)∶n(AMB)∶n(phen)=1∶1∶1 投料,在合成配合物1 的反应液中加入5 mL phen 乙醇溶液.反应液在室温放置1周后析出蓝色晶体2,过滤,洗涤,干燥.
1.3 配合物的抑菌活性
通过二倍溶液稀释法测定了配合物1 和配合物2 的最小抑菌浓度(MIC).受试菌种为2 种革兰阴性菌(大肠埃希菌Escherichia coil 和沙门杆菌Salmonella typhi)和2 种革兰阳性菌(金黄色葡萄球菌Staphylococcus aureus 和枯草芽孢杆菌Bacillus subtilis).
1.4 配合物与ct-DNA 的相互作用
配合物与ct-DNA 相互作用研究均在pH 7.2 的Tris-HCl/NaCl 缓冲液中进行.缓冲液含5 mmol·L-1Tris 和50 mmol·L-1NaCl.琼脂糖凝胶电泳试验中,每升TBE 电泳缓冲液(pH 8.3)含0.045 mol Tris、0.45 mol H3BO3和1 mol EDTA.ct-DNA 的浓度参照文献[13]确定.
1.4.1 紫外光谱 将0.062 5 mmol·L-1配合物溶液3 mL 和Tris-HCl / NaCl 缓冲溶液3 mL 分别加入样品比色皿和空白比色皿中,再分别加入等体积的ct-DNA 溶液,每次充分摇匀静置15 min 后,在200~400 nm 扫描配合物的紫外光谱.
1.4.2 荧光光谱 当含5.5 μmol·L-1ct-DNA 和4.8 μmol·L-1EB 混合溶液的荧光强度达到稳定后,逐步增加配合物的浓度,在λex=525 nm 和υscan=240 nm·s-1下,在550~650 nm 测定混合溶液的荧光强度.
1.4.3 黏度 在c(ct-DNA)=0.2 mmol·L-1下,依次增大配合物浓度,在(29.0 ±0.1)℃下,测定DNA-配合物缓冲溶液流过毛细管所需时间(t),计算比黏度(η):

其中,t0为缓冲溶液流过毛细管所需时间.
ct-DNA 溶液的比黏度以η0表示.以c(配合物)/c(ct-DNA)为横坐标,以(η/η0)1/3为纵坐标作图,分析配合物与DNA 的结合方式.
1.4.4 配合物对pBR322 DNA 的切割作用 将配合物、VC(浓度是配合物的30~70 倍)与pBR322 DNA(200 ng)混合,用Tris-HCl / NaCl 缓冲液定容至20 μL,在37 ℃恒温条件下静置1 h 后,加入3 μL Loading buffer,在8 g·L-1琼脂糖凝胶和TBE 电泳液中,用100 V 电压电泳40 min.用Gold View(4~5 μL)作着色剂,以溴酚蓝为指示剂,在紫外检测仪下观察并拍照.在上述混合体系中分别加入活性氧抑制剂{·OH抑制剂[二甲基亚砜(DMSO),4μL]、1O2抑制剂[2,2,6,6-四甲基-4-哌啶酮(TMP)、NaN3,100 μmol·L-1]},通过电泳带的变化探索配合物对质粒DNA 的切割机理.
2 结果与分析
2.1 配合物的组成和结构
配合物1 和配合物2 的化学式、化学元素分析数据和摩尔电导率(Λm)列于表1.

表1 配合物的元素组成分析Tab.1 The elemental analysis of the complex
在室温条件下的甲醇溶液中,配合物1 和配合物2 的摩尔电导率数据表明2 个配合物在甲醇中是1∶1 型电解质[14].即Cu2+与配体形成的配阳离子与抗衡离子Cl-在甲醇中按1∶1 解离.
配体和配合物的IR 和UV-Vis 光谱数据及其分析指认归纳于表2 中.从表2 可以看出,配体AMB的νN-H在配合物1 和配合物2 中都向低波数方向发生了移动,结合苯并咪唑的νC=C,νC=N和γC-H的峰位变化,说明AMB 的—NH2氮和苯并咪唑环的氮都参与了配位,这与文献[7-9]的报道一致.在配合物2中,虽然νN-H和νO-H重叠在一起,但在1 600 cm-1左右的2 个νC=C,νC=N的峰位相对于配合物1 发生了位移,而且在指纹区出现了3 个中强度的吸收峰,其峰位均低于配体,但又不同于配合物1.由此说明:在配合物2 中phen 和AMB 都与Cu2+发生了配位作用[15].

表2 配合物与配体的IR 和UV-Vis 吸收峰归属Tab.2 The attribution of the IR & UV-Vis absorption peaks of the complex and the ligand
在UV-Vis 光谱中,配合物1 和配合物2 的甲醇溶液在紫外光区和可见光区出现的吸收峰与文献[8]相近,说明配合物1 和配合物2 也为四方锥构型[7-8].
综合上述IR、摩尔电导率、UV-Vis 和元素分析结果,配合物1 和配合物2 的分子式分别为:[Cu(AMB)2Cl]Cl·4H2O 和[Cu(AMB)(phen)Cl]Cl·2H2O,推测2 个配合物的配位构型如图1 所示.
2.2 配合物的抑菌活性

图1 推测的配合物1 和配合物2 的分子配位构型Fig.1 Speculated molecular structures of the complex 1 and 2

表3 配合物的抑菌活性Tab.3 The bacteriostatic activity of the complex for the assayed bacteria
配合物1、配合物2 和对照物的最小抑菌浓度见表3.从表3 可以看出:对4 种受试菌种,配合物1 和配合物2 的抑菌活性明显高于CuCl2和AMB,说明AMB配位后与Cu(II)产生协同作用,提高了抑菌活性;配合物2 的抑菌活性虽然比配合物1 高,但是与phen 相近.这可能是phen 配体取代了配合物1 的AMB 后,配合物2 的脂溶性提高且接近于phen 的缘故.这一推测从配合物2 在无水乙醇中的溶解性高于甲醇可以佐证.
2.3 配合物与DNA 的相互作用
2.3.1 紫外光谱 UV 光谱的变化可以反映出配合物与DNA 结合后配体的电子结构受DNA 扰动的情况.当配合物插入DNA 碱基对或与DNA 双螺旋沟槽中的碱基发生非共价结合时,可使π电子跃迁几率减小,会产生减色效应;另外,如果配离子带正电,其易靠近DNA 槽内带负电的磷酸基,使得磷酸生色团内陷,也会降低小分子-DNA 复合体系的紫外吸收.一般地,紫外吸收减色、吸收带红移和等色点的出现是小分子与DNA 发生嵌插作用的光谱标志[16].配合物1 和配合物2 与ct-DNA 作用的紫外光谱如图2 所示.从图2 可见,随着c(ct-DNA)的增加,配合物1 的紫外光谱只发生了轻微的减色效应,而配合物2 发生了明显的减色并在300 nm 附近出现了等色点.当c(ct-DNA)/c(配合物)=2.1 时,在270 nm 处配合物1 的减色率仅为1.48%,而配合物2 的减色率为18.0%.与DNA 插入剂[Ru(bpy)2L]2+(其中,L=phen、IP 或PIP)的减色率12%~22%[17]比较,推测配合物1 以非插入方式与DNA 结合,而配合物2 以插入方式结合DNA.
2.3.2 荧光光谱 EB 分子中含有三环刚性平面,是弱荧光物质[1],它可以嵌入DNA 碱基对之间而使荧光显著增强.因此以EB 作为DNA 结构探针,可以研究金属配合物与DNA 的作用方式.当其他分子与DNA 作用,将EB 从DNA 的碱基对中挤出来时,DNA/EB 体系的荧光发生猝灭.配合物1 和配合物2与ct-DNA 作用的荧光光谱见图3.从图3 可以看出,随着c(配合物)的增加,EB-DNA 体系的荧光强度明显下降,说明配合物与EB-DNA 结合后使EB 从复合体系中逸出.

图3 配合物对EB-DNA 体系荧光光谱的影响Fig.3 Effects of the complex on the fluorescence spectra of EB-DNA system
[17]所述方法,按照Stern-Volmer 方程I0/I=1 +Ksqr(I 和I0分别为滴加和未滴加配合物时EB-DNA 体系的荧光强度;r 为配合物与DNA 的浓度比;Ksq为猝灭常数),以I0/I 对r 作图,获得的直线(图3 中小图)斜率就是Ksq.Ksq越大,说明配合物对EB-DNA 体系的猝灭程度越大,与DNA 的作用越强.试验测得配合物1 和配合物2 对EB-DNA 荧光体系的猝灭常数Ksq分别为0.059 2 和0.135 0,表明2 个配合物均能与ct-DNA 结合,结合强弱顺序为配合物1<配合物2.这可能是由于配合物2 中配体phen 的刚性环面积大于AMB,疏水作用较强,容易嵌入DNA 碱基对间的缘故.
2.3.3 黏度 黏度法是检测在溶液中配合物与DNA 结合模式的一种有效方法.一般地,如果配合物与DNA 以静电、沟槽结合等非插入方式结合,DNA双链受到的影响很小,则DNA 溶液黏度变化不明显;如果配合物部分插入DNA 碱基对之间,DNA 的双链会发生扭结缩短,则溶液的黏度减小;而如果配合物完全嵌入DNA 碱基对间,DNA 的双链会被拉伸变长,则DNA 溶液的黏度增加[18-19].随着配合物的加入,ct-DNA 溶液的比黏度变化见图4.从图4 可以看出,随着配合物浓度的增大,配合物1-DNA 复合体系的相对比黏度变化不大,而配合物2-DNA 复合体系的相对比黏度增幅明显.这表明2 个配合物与ct-DNA的结合方式不同:配合物1 以静电或沟槽方式结合,而配合物2 是以插入方式结合.这与前面UV 和荧光光谱的结果吻合.
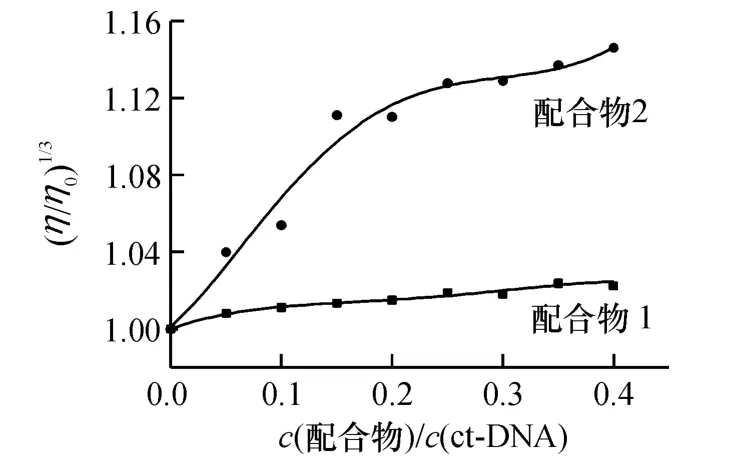
图4 DNA 的相对比黏度随配合物加入量的变化Fig.4 Effects of increasing amounts of complexes on the relative viscosity of DNA
2.3.4 配合物对pBR322 DNA 的断裂作用 通常pBR322 DNA 有3 种构型:Ⅰ型—超螺旋型(完整的pBR322 DNA);Ⅱ型—环形(1 条链上有一个切口);Ⅲ型—线型(在同一位置2 条链断裂).在电泳时,3种构型的迁移速率存在明显差别,迁移速率大小顺序为:Ⅰ型>III 型>Ⅱ型.在恒温37 ℃条件下,配合物1 和配合物2 切割质粒DNA 的琼脂糖凝胶电泳效果见图5.从图5 可见,虽然在还原剂VC存在下,CuCl2、AMB 和phen 对pBR322 DNA 均未显示出切割作用,但2 个配合物却均能将Ⅰ型pBR322 DNA切割成Ⅱ型,切割能力为配合物2>配合物1.
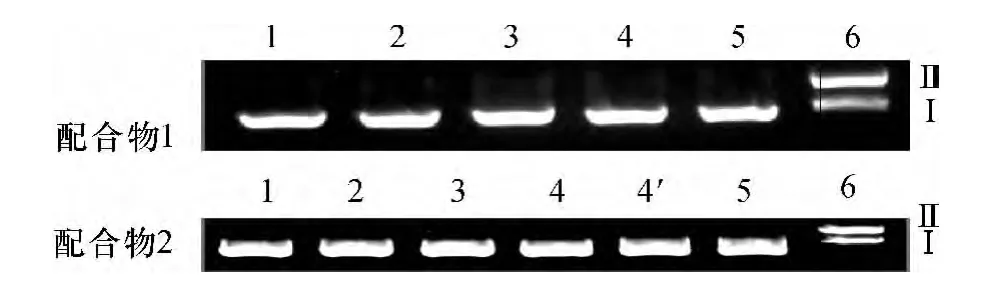
图5 配合物1 和配合物2 及配体切割pBR322 DNA 的凝胶电泳图(37 ℃)Fig.5 Agarose gel eletrophoresis for the cleavage of pBR322 DNA by the complex1,2 and the ligand at 37 ℃
因Cu2+具有氧化还原性,因此Cu 配合物切割DNA 大多涉及氧化机理[20].为进一步验证配合物是通过氧化机理切割DNA,在活性氧清除剂DMSO、TMP 或NaN3存在下,测试了配合物1 和配合物2 对pBR322 DNA 的切割作用(图6).

图6 活性氧清除剂存在下配合物1 和配合物2 切割pBR322 DNA 的凝胶电泳图Fig.6 Cleavage of pBR322 DNA by the complex 1 and 2 in the presence of active oxygen scavenging agent
切割机理试验说明,在还原剂VC存在下,配合物1 和配合物2 均能将Ⅰ型pBR322 DNA 切割成Ⅱ型,而在加入·OH 抑制剂DMSO 后,配合物1 和配合物2 对pBR322 DNA 的切割作用明显被抑制(图6泳道3);加入1O2抑制剂TMP 或NaN3后,切割作用基本没有变化,由此推测2 个配合物可能通过羟基自由基氧化机理切割pBR322 DNA.这与文献[8,18-19]结果一致.
3 结论
本文合成了Cu(Ⅱ)-AMB 二元配合物和AMBCu(Ⅱ)-phen 三元配合物,通过元素分析、IR、UV-Vis和摩尔电导率对2 个配合物进行了组成和结构表征,推测2 个配合物的分子式分别为:[Cu(AMB)2Cl]Cl·4H2O(配合物1)和[Cu(AMB)(phen)Cl]Cl·2H2O(配合物2).
光谱法和黏度法的研究结果表明:配合物1 和配合物2 分别以非插入方式和插入方式与ct-DNA结合,结合能力为配合物2>配合物1.
琼脂糖凝胶电泳试验说明,在VC作用下2 个配合物都可通过·OH 机理断裂pBR322 DNA.
配合物1 和配合物2 对大肠埃希菌、沙门杆菌、金黄色葡萄球菌和枯草杆菌的抑制作用高于AMB,配合物2 的MIC 与phen 相近,抑菌活性表现为配合物2>配合物1.2 个配合物的抑菌活性强弱次序与结合DNA 的强弱次序刚好一致,二者是否存在关联还需深入研究.
参考文献:
[1]宋宇飞,杨频.对DNA 具有识别和断裂功能的金属插入剂的研究[J].化学进展,2001,13(5):368-375.
[2]胡亚敏,王兴明,张欢.金属配合物与DNA 相互作用的研究进展[J].化学与生物工程,2007,24(8):1-4.
[3]LIU Hongke,SADLER P J.Metal complexes as DNA intercalators[J].Acc Chem Res,2011,44(5):349-359.
[4]曾文亮,徐文方,张玲.抗肿瘤药物DNA 小沟区结合剂的研究进展[J].中国药物化学杂志,2004,14(5):307-313.
[5]陈岚,魏宁宁,高洁,等.2-取代苯并咪唑类化合物的合成及其抑菌活性[J].农药学学报,2011,13(5):448-452.
[6]MALA N,PRAMENDRA K S,ASHOK K.Synthesis,structural characterization,biological activity and thermal study of triand diorganotin(IV)complexes of Schiff base derived from 2-aminomethylbenzimidazole[J].Appl Organomet Chem,2009,23(11):434-445.
[7]CUEVA I S,SICILIA A G,GONZÁLEZ J M,et al.New mixed-ligand copper(Ⅱ)complex as a model for the metal-binding role of 2-aminomethylbenzimidazole,a chelating anchor group used in ion-exchanger polymers:Synthesis,molecular and crystal structure and properties of(2-aminomethylbenzimidazole)(iminodiacetato)copper(Ⅱ),[Cu(IDA)(2AMBzImH)][J].React Funct Polym,1998,36:211-216.
[8]赵盼,吴海雷,王璐,等.2-氨甲基苯并咪唑-铜(Ⅱ)-羧酸配合物的合成、抗菌活性及与DNA 的作用[J].化学研究与应用,2011,23(11):1482-1488.
[9]JORDI G S,MARÍA J P,MERCè F B,et al.Crystal structure and DNA interaction of the facial-type rac-tris[2-(aminomethyl)benzimidazole]cobalt(Ⅲ)complex[J].Inorg Chem,2006,45(25):10031-10033.
[10]WU Hongyan,LI Hong,ZHU Baolin,et al.The synthesis and crystal structures of new 2-aminomethylbenzimidazole Zinc(Ⅱ)complexes exhibiting luminescence[J].Trans Met Chem,2008,33(1):9-15.
[11]HE Yi,KOU Huizhong,WANG Ruji,et al.Synthesis,crystal structures and properties of two copper(Ⅱ)2-aminomethyl benzimidazole complexes[J].Trans Met Chem,2003,28(4):464-467.
[12]CESCON L A,Day A R.Preparation of some benzimidazolylamino acids:Reactions of amino acids with o-phenylenediamines[J].Org Chem,1962,27(2):581 –586.
[13]SHI Huijie,CHEN Yu,GAO Feng,et al.Synthesis,DNA-binding and DNA-photo cleavage properties of ruthenium(II)mixed-polypyridyl complex[Ru(tbz)2(dppz)]2+[J].J Mol Struct,2008,892(1/2/3):485-489.
[14]GEARY W J.The use of conductivity measurements in organic solvents for the characterization of coordination compounds[J].Coord Chem Rev,1971,7(1):81-122.
[15]MA Huifang,ZENG Xirui,ZHOU Xiaohua,et al.Synthesis,characterization and SOD-like activity of a ternary copper(II)complex with 1,10-phenanthroline and L-arginine[J].J Coord Chem,2008,61(23):3829-3838.
[16]LONG E C,BARTON J K.On demonstrating DNA intercalation[J].Acc Chem Res,1990,23(9):271-273.
[17]WU Jianzhong,YE Baohui,WANG Lei,et al.Bis(2,2'-bipyridine)ruthenium(II)complexes with imidazo[4,5-f][1,10]phenanthroline or 2-phenylimidazo[4,5-f][1,10]phenanthroline[J].J Chem Soc Dalton Trans,1997(8):1395-1402.
[18]JOAQUÍN B,GLORIA A,MARTA G A,et al.Efficient DNA cleavage induced by copper(Ⅱ)complexes of hydrolysis derivatives of 2,4,6-tri(2-pyridyl)-1,3,5-triazine in the presence of reducing agents[J].Eur J Inorg Chem,2007,2007(6):822-834.
[19]卢艳梅,区志镔,刘海峰,等.三元TBZ/HPB-铜(Ⅱ)-L-蛋氨酸配合物的合成、表征、抑菌活性及与DNA 的作用[J].无机化学学报,2011,27(4):704-710.
[20]JIANG Qin,XIAO Nan,SHI Pengfei,et al.Design of artificial metallonucleases with oxidative mechanism[J].Coord Chem Rev,2007,251(15/16):1951-1972.
