羽衣甘蓝MADS–box基因BoaAGL6的克隆及表达分析
2014-07-02韩悦任洪杰翟笑雨徐启江
韩悦,任洪杰,翟笑雨,徐启江*
(1.林木遗传育种国家重点实验室,黑龙江 哈尔滨150040;2.东北林业大学生命科学学院,黑龙江 哈尔滨150040)
羽衣甘蓝MADS–box基因BoaAGL6的克隆及表达分析
韩悦1,2,任洪杰1,2,翟笑雨1,2,徐启江1,2*
(1.林木遗传育种国家重点实验室,黑龙江 哈尔滨150040;2.东北林业大学生命科学学院,黑龙江 哈尔滨150040)
以羽衣甘蓝(Brassica oleracea var. acephala)野生型及其在选育过程中发现的2种花瓣数量变化的突变体品种为试材,通过RACE方法克隆了AGL6基因的同源基因,命名为BoaAGL6,并用半定量RT–PCR和实时荧光定量PCR分析了BoaAGL6在3种不同花型的羽衣甘蓝各类花器官的表达模式。结果表明:克隆的BoaAGL6基因长999 bp(GenBank登录号为KC984301),开放阅读框长759 bp,编码252个氨基酸;系统发育分析表明,BoaAGL6基因属于AGL6–like进化系;半定量RT–PCR和实时定量RT–PCR 结果表明,BoaAGL6基因具有较宽泛的表达区域,在不同花型的花瓣中的表达有所区别,在多瓣花型的花瓣中高丰度表达,有别于在其他2种花型中的中等水平。说明该基因在调控羽衣甘蓝花器官特征属性及形成过程中发挥重要作用。
羽衣甘蓝;花发育;MADS–box基因;BoaAGL6基因
花发育MADS–box基因在植物的花分生组织、花器官和各种营养器官中均有不同形式的时空表达模式,有着各自不同的功能。系统发育分析表明,在12个Ⅱ型MADS–box基因亚家族中,AP1、SEP 和AGL6(AGAMOUS–like 6)由于存在较近的亲缘关系而构成 AP1/SEP/AGL6进化系[1–2],其中 AGL6 与SEP互为姊妹系;AGL6/SEP与AP1互为姊妹系[1]。AP1亚家族基因在发育的花分生组织和初始的花器官原基中表达。拟南芥基因组中存在 4个AP1–like基因:AP1、FRUITFULL(FUL)、AGL79和CAULIFLOWER (CAL),其中AP1、FUL和CAL在调控花分生组织属性方面存在功能冗余[3]。拟南芥SEP1/2/3/4基因,主要参与调控四轮花器官的特征属性和花分生组织的确定性[4–6]。然而,拟南芥AGL6基因的直系同源基因AGL6–like基因的功能迄今为止还不是十分明确[2]。但是,也有研究表明,在拟南芥35S:AGL6过表达株系和激活标签突变体中,AGL6能够激活开花时间关键因子FLOWERING LOCUS C(FLC)和FLOWERING LOCUS T(FT)[7];矮牵牛的PhAGL6和SEP–like基因在调控花瓣和花药发育方面存在功能冗余[8]。
已从裸子植物和所有主要被子植物中获得AGL6亚家族成员[9]。AGL6–like在花分生组织中的表达模式具有保守性[10]。但是也有研究表明,该类基因能在拟南芥及裸子植物的营养器官中表达[11],例如,拟南芥AGL6在茎生叶原基和花诱导形成的潜在苞叶区表达[12];PrMADS3在叶芽起始针叶原基的细胞群中表达,说明在被子植物起源之前,AGL6进化系具有调控营养发育的功能。随着研究的不断深入,AGL6–like基因的多样性功能不断被阐释。例如,水稻 MFO1具有调控花器官属性和花分生组织确定性功能,Mfol突变体小花的内稃和浆片发育不正常、花器官融合以及产生额外的花器官[13];玉米的ZAG3基因在花分生组织中表达,而在外稃和雄蕊中无表达,在花发育的后期,ZAG3在发育的浆片、内稃、心皮和内珠被中表达,缺失突变证实该基因同样具有调控花器官属性和花分生组织确定性的功能[14]。了解AGL6–like基因的原始功能及其多样性的分化功能,需要扩展研究的植物范围。
羽衣甘蓝(Brassica oleracea var. acephala)的花具有典型双子叶植物花的结构,由 4枚萼片、4枚花瓣、6枚雄蕊、1枚雌蕊构成。在新品种选育过程中,笔者获得了稳定遗传花瓣增多和花瓣减少突变体,其萼片、雄蕊、雌蕊发育正常,但花瓣数目增多或减少。本研究以羽衣甘蓝花芽为试材,利用cDNA 末端快速扩增(RACE)技术获得了1个与花发育相关的AGL6基因,通过半定量RT–PCR和实时定量RT–PCR分析了BoaAGL6基因的时空表达模式,以探讨 BoaAGL6基因在羽衣甘蓝花器官发育中的作用。
1 材料与方法
1.1 供试羽衣甘蓝
羽衣甘蓝自交系14号(花瓣数目正常,4枚)、自交系变异株羽衣甘蓝5号(多瓣,8枚以上)、自交系变异株羽衣甘蓝20号(少瓣,0~3枚)品系均由东北林业大学花卉生物工程研究所提供。羽衣甘蓝种植于温室内,常规栽培管理,2月中旬开始现蕾。供试3种材料的遗传背景相同,除花瓣数目有差异外,其他性状完全相同。
1.2 RNA 提取、MADS–box同源基因克隆
使用TRIzol(invitrogen)试剂提取羽衣甘蓝常规品种14号花芽的总RNA,用NanoDrop(NanoDrop technologies)分光光度计和琼脂糖凝胶检测总 RNA的质量和浓度。利用P19E(表1)、第一链cDNA反转录试剂盒(北京全式金生物技术有限公司)、以5 μg 总RNA为模板合成第一链cDNA。
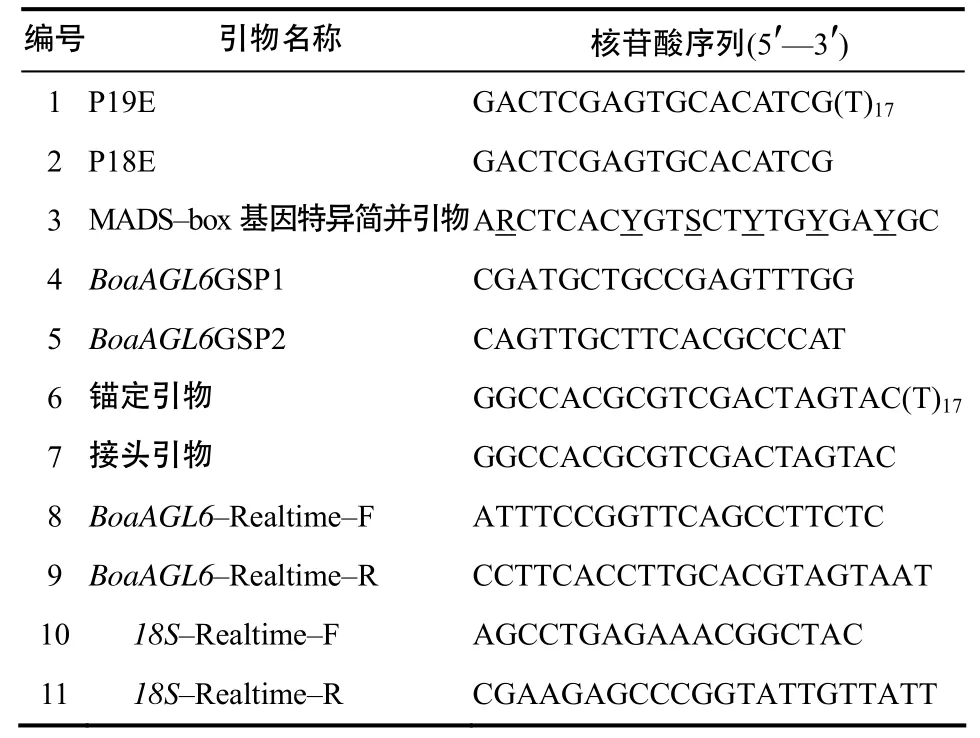
表1 羽衣甘蓝BoaAGL6基因克隆及表达分析用引物Table 1 List of primers used for cloning and expression analysis of BoaAGL6 from kale
利用 cDNA 末端快速扩增(rapid amplification of cDNA ends, RACE)法克隆3′–cDNA序列,根据GenBank中与羽衣甘蓝亲缘关系相近物种的MADS–box基因保守区的核苷酸序列设计MADS–box基因特异简并引物(表 1)。以第一链cDNA为模板,利用MADS–box基因特异简并引物、P18E引物(表1)、TransTaqTMHIFI DNA聚合酶(北京全式金生物技术有限公司)进行PCR 扩增。扩增条件为:94℃预变性5 min; 94 ℃ 变性30 s,54 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃ 终延伸 7 min。PCR产物用 PCR产物回收试剂盒(Genestar)回收后用T载体克隆,送北京六合华大基因科技股份有限公司测序。
根据获得的 3′–cDNA序列设计引物 BoaAG L6GSP1、BoaAGL6GSP2(表1),利用BoaAGL6GSP1和锚定引物以加 dA尾的 cDNA 为模板进行5′–RACE扩增。为保证克隆片段的特异性,再用巢式引物 BoaAGL6GSP2和接头引物进行第二次5′–RACE扩增,克隆5′–cDNA序列,PCR产物的回收纯化、克隆、测序同3′–RACE产物。
1.3 序列比对及系统发育分析
为明确本研究分离基因所属的MADS–box亚家族,将克隆的基因序列提交到GenBank数据库中,获得与克隆基因序列高度相似的同源基因,然后用 ClustalX1.83软件进行序列比对,用GeneDoc3.2软件进行手工调整,并且将核苷酸序列转换为氨基酸序列。用 MEGA6软件[15]的邻位相连法(Neighbor–joining,NJ)对氨基酸矩阵进行系统发育分析。NJ系统树分支的置信度采用重复抽样分析的方法,重复抽样的次数为1 000次,大于50%的bootstrap 标注在树图上。
1.4 基于半定量RT–PCR和 qRT–PCR的BoaAGL6基因表达分析
提取3种花型的萼片、第一轮花瓣、第二轮花瓣、雄蕊、心皮、子房的总RNA。以各类花器官的总RNA为模板,利用oligo(dT)引物反转录合成第一链cDNA。以cDNA为模板进行基因特异性PCR,以18S基因为内参。
半定量RT–PCR在PE–9700型PCR仪上进行,所用引物为 BoaAGL6–Realtime–F、BoaAGL6–Realtime–R(表1)。PCR反应程序:94 ℃预变性 5 min;25个循环(94 ℃ 预变性30 s,52 ℃退火30 s,72 ℃延伸30 s);72 ℃ 终延伸 7 min。用0.8%琼脂糖凝胶检测PCR产物。
用7500 fast 型实时荧光定量PCR仪和Power SYBR®Green PCR Master MiX试剂盒 (Applied Biosystems)以上述花器官的 cDNA为模板进行BoaAGL6基因的实时定量PCR分析;20 μL反应体系中包括8.4 稀释的第一链cDNA模板(1μg cDNA 加 420μL水稀释)、浓度为 10 μmol/L 的引才、物BoaAGL6–Realtime–F、BoaAGL6– Realtime–R各0.8 μL、Power SYBR®Green PCR Master MiX(2×)10 μL。反应程序如下:95 ℃预变性 2 min;随后40 个扩增循环(95 10 s℃ ,60 45 s)℃ 。以18S基因的转录表达水平为内参,采用2–ΔΔCT法[16]分析BoaAGL6基因的相对表达水平。每个样品设3个生物学重复,在同一批次内完成内参基因和目标基因的PCR反应。
2 结果与分析
2.1 羽衣甘蓝花器官特征基因 BoaAGL6的克隆及序列比对
3′–RACE得到的测序结果表明,该片段有效长度为 841 bp,其核苷酸序列与拟南芥(Arabidopsis thaliana)AGL6基因核苷酸序列具有87%的相似性,为AGAMOUS–like 6 (AGL6)基因,因而将从羽衣甘蓝中克隆的AGL6基因命名为BoaAGL6。
以 3′–RACE序列为基础设计引物进行 5′–RACE扩增,克隆后测序结果表明,该片段长度为405 bp,在5′端36 bp 处发现起始密码子。拼接测序结果,得到长度为999 bp的BoaAGL6基因cDNA序列。GenBank登录号为KC984301。其开放阅读框长759 bp,编码252个氨基酸,含有56个氨基酸的MADS结构域、33个氨基酸的I结构域、77个氨基酸的K结构域、86个氨基酸的C结构域(图1)。
与其他 MADS–box蛋白的多重氨基酸序列比对结果表明,BoaAGL6蛋白拥有典型的MIKC–type结构(图1),与VvMADS3(葡萄)、AtAGL6(拟南芥)、BoAGL6a(花椰菜)和BoAGL6b(花椰菜)等具有较高的序列相似性。在AGL6–like蛋白C–末端有2个高度保守的基序 AGL6–I motif和 AGL6–II motif[17](图2),与SEP I/II motifs高度相似,有潜在的转录激活活性[13]。

图1 羽衣甘蓝BoaAGL6 cDNA的核苷酸序列及其推导的氨基酸序列Fig. 1 Nucleotide and deduced amino acid sequences of BoaAGL6 cDNA from kale

图2 部分AGL6和SEP基因的氨基酸序列Fig. 2 Sequence alignment of amino acid sequences among several AGL6–like and SEP–like genes
2.2 BoaAGL6基因与其他MADS–box基因的系统发育关系
AGL6–like基因是MADS–box中重要的亚家族之一,据报道它与SEP和AP1亚家族亲缘关系较近[18]。为确定羽衣甘蓝 BoaAGL6基因的系统发育位置,从GenBank数据库中收集了71个AGL6 –like类、SEP–like类、AP1类亚家族MADS–box基因用于系统发育树的构建。对M、I、K、C区的氨基酸序列进行NJ分析而构建的系统发育树(图3)表明,相同目物种的AGL6同源蛋白具有较高的自展支持率,BoaAGL6被归入AGL6同源蛋白单元组,并与真双子叶植物拟南芥AGL6与AGL13(M55554、U20183)、花椰菜BoAGL6a与BoAGL6b(AJ508055 AJ508409)、鳞茎毛茛 RbAGL6(AY306184)、葡萄VvMADS3(AF373602)等聚为一支,属于 euAGL6进化系。
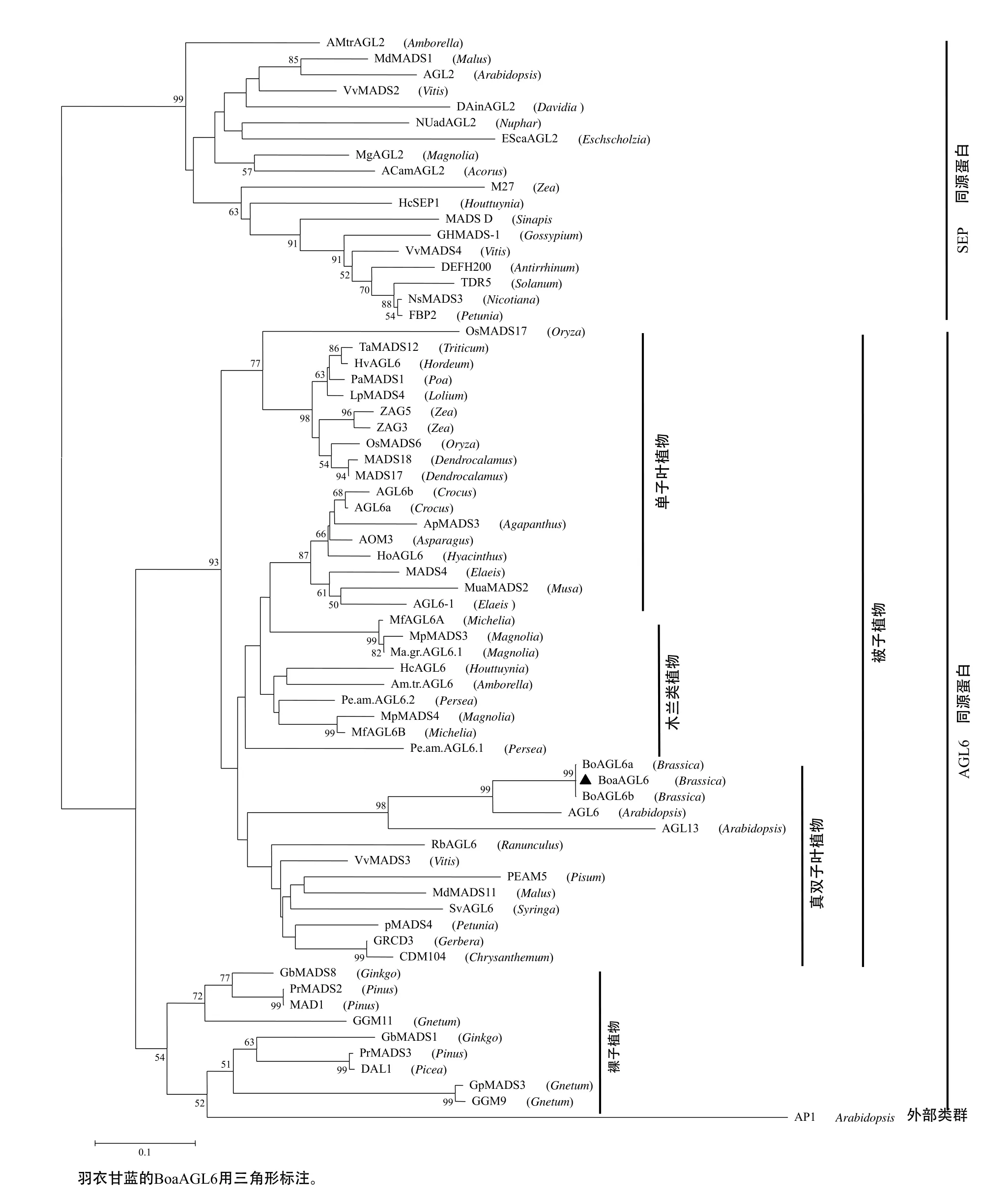
图3 以邻位相连构建的AGL6–like亚家族MADS–box蛋白的系统发育树Fig. 3 The phylogenetic tree of AGL6–like MADS–box proteins generated using the Neighbor–joining method
2.3 BoaAGL6基因在羽衣甘蓝各花器官中的表达模式
半定量RT–PCR和 qRT–PCR结果表明,羽衣甘蓝AGL6–like基因BoaAGL6 特异地在花器官中表达(图4)。3种花型中,在雄蕊、子房中高丰度表达,在萼片和雌蕊中表现为弱表达量。在自交系变异株羽衣甘蓝5号的第二轮花瓣中BoaAGL6的表达明显高于羽衣甘蓝自交系 14号和自交系变异株羽衣甘蓝20号。BoaAGL6蛋白的 C–末端具有该进化系典型性的AGL6–Ⅰ motif 和AGL6–Ⅱ motif。系统发育分析表

图4 羽衣甘蓝BoaAGL6基因的半定量RT–PCR结果Fig.4 Quantification of expression levels of the BoaAGL6 gene in deferent floral organs of kale as determined by gene-specific semi-quantitative RT–PCR
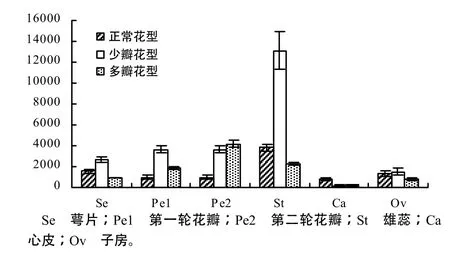
图5 羽衣甘蓝BoaAGL6基因的qRT–PCR分析结果Fig. 5 Quantification qRT–PCR analysis of the BoaAGL6 gene in kale
3 讨 论
1) BoaAGL6基因的归属。系统发育分析表明,MADS–box基因家族中的AGL6亚家族在其系统发育史中经历了5次基因复增事件。前2次基因复增事件分别发生在百合目和天门冬目产生之前;在木兰类植物分化期间发生第3次重增;第4次重增事件发生在核心真双子叶植物起始之前,产生了euAGL6和AGL6–like基因[2]。AGL6亚家族的系统发育史可以追溯到核心真双子叶植物起源之时,这表明核心真双子叶植物的AGL6祖先基因通过基因组复制而产生多个旁系同源基因,其中发挥转录因子功能的旁系同源基因被优先保存下来[1,19]。此外,MADS–box基因也可以通过多次独立的复制事件而产生旁系同源基因。在被子植物中,euAGL6进化系的数量远多于 AGL6–like进化系的数量[2,12]。羽衣甘蓝中只存在euAGL6基因即BoaAGL6基因。明,采用不同的外部类群(SOC1类和B类)和不同的计算方法(ML法和Mrbayes法)所得到的基因树的拓扑结构基本一致,E类和AGL6类为姊妹类群,而A类基因是这两类基因的姊妹类群。AGL6蛋白C末端的的2个motif和SEP类蛋白C末端的两个motif更为相近,SEP类和AGL6类蛋白在K3区拥有共同的PRODOM结构域(PD352768)。
2) BoaAGL6基因的表达模式。AGL6世系在花分生组织中的表达自被子植物多样化以来就是保守的[2]。本研究结果表明AGL6与SEP互为姊妹系[1]。BoaAGL6在所有的花器官中都表达,说明BoaAGL6基因参与了所有花器官的属性决定,与“ABCE”模型[20]中E功能基因的表达范围相符。在雄蕊与子房中表达最高,而在3种花瓣数量不同的花型中,在多瓣花的第二轮花瓣中,BoaAGL6的表达明显高于野生型和少瓣突变体,依照“ABCE”模型推测,花瓣变化的表型可能是与 A、B、E功能基因表达发生改变或是由于 C功能基因表达区域的变化有关。根据实验结果,可推测 BoaAGL6在一定程度上影响羽衣甘蓝突变体花瓣的变化。下一步需要克隆羽衣甘蓝其他 A、B、C、E基因,探讨其构成的分子网络在花瓣变化的羽衣甘蓝表型中的整体功能。
[1] Zahn L M,Kong H,Leebens–Mack J H,et al.Theevolution of SEPALLATA subfamily of MADS–box genes:A preangiosperm origin with multiple duplications throughout angiosperm history[J].Genetics,2005,169(4):2209–2223.
[2] Viaene T,Vekemans D,Becker A,et al.Expression divergence of the AGL6 MADS domain transcription factor lineage after a core eudicot duplication suggests functional diversification[J].BMC Plant Biology,2010,10(1):148.DOI: 10.1186/1471-2229-10-148.
[3] Ferrandiz D,Gu Q,Martienssen R,et al.Redundant regulation of meristem identity and plant architecture by FRUITFULL, APETALA1 and CAULIFLOWER[J]. Development,2000,127(4):725–734.
[4] Pelaz S,Ditta G S,Baumann E,et al.B and C floral organ identity functions require SEPALLATA MADS–box genes[J].Nature,2000,405(6783):200–203.
[5] Pelaz S,Gustafson Brown C,Kohalmi S E,et al. APETALA1 and SEPALLATA3 interact to promote flower development[J].Plant Journal,2001,26(4):385–394.
[6] Ditta G,Pinyopich A,Robles P,et al.The SEP4 gene of Arabidopsis thaliana functions in floral organ and meristem identity[J].Current Biology,2004,14(21):1935–1940.
[7] Yoo S K,Wu X,Lee J S,et al.AGAMOUS LIKE 6‐ is a floral promoter that negatively regulates the FLC/MAF clade genes and positively regulates FT in Arabidopsis[J].The Plant Journal,2011,65(1):62–76.
[8] Rijpkema A S,Zethof J,Gerates T,et al.The petunia AGL6 gene has a SEPALLATA–like function in floral patterning[J].Plant Journal,2009,60(1):1–9.
[9] Becker A,Theissen G.The major clades of MADS–box genes and their role in the development and evolution of flowering plants[J].Mol Phyl Evol,2003,29(3):464–489.
[10] Yoo M J,Soltis P S,Soltis D E.Expression of floral MADS–box genes in two divergent water lilies:Nymphaeales and Nelumbo[J].International Journal of Plant Sciences,2010,171(2):121–146.
[11] Reinheimer R,Kellogg E A.Evolution of AGL6–like MADS–box genes in grasses (Poaceae):Ovule expression is ancient and palea expression is new[J]. Plant Cell,2009,21(9):2591–2605.
[12] Schauer S E,Schlüter P M,Baskar R,et al.Intronic regulatory elements determine the divergent expression patterns of AGAMOUS-LIKE6 subfamily members in Arabidopsis[J].The Plant Journal,2009,59(6):987–1000.
[13] Ohmori S,Kimizu M,Sugita M,et al.MOSAIC FLORAL ORGANS1,an AGL6-like MADS-box gene regulates floral organ identity and meristem fate in rice[J].Plant Cell,2009,21(10):3008–3025.
[14] Thompson B E,Bartling L,Whipple C,et al. Beardedear encodes a MADS-box transcription factor critical for maize floral development[J].Plant Cell,2009,21(9):2578–2590.
[15] Tamura K,Stecher G,Peterson D,et al.MEGA6:Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725–2729.
[16] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2− ΔΔCTmethod[J].Methods,2013,25(4):402–408.
[17] Wang B G,Zhang Q,Wang L G,et al.The AGL6–like Gene CpAGL6,a potential regulator of floral time and organ identity in Wintersweet (Chimonanthus praecox)[J]. Journal of Plant Growth Regulation,2011,30(3):343–352.
[18] Kim S,Soltis P S,Soltis D E.AGL6-like MADS-box genes are sister to AGL2-like MADS-box genes[J]. Journal of Plant Biology,2013,56(5):315–325.
[19] De Bodt S,Maere S,Van de Peer Y.Genome duplication and the origin of angiosperms[J].Trends Ecol Evolut,2005,20(11):591–597.
[20] Litt A,Kramer E M.The ABC model and the diversification of floral organ identity[J].Seminars in cell and developmental biology,2010,21(1):129–137.
责任编辑:罗 维
英文编辑:罗 维
Cloning and expression analysis of MADS–box gene BoaAGL6 associated with floral development in kale (Brassica oleracea var. acephala)
HAN Yue1,2,REN Hong-jie1,2,ZHAI Xiao-yu1,2,XU Qi-jiang1,2*
(1.The State Key Laboratory of Tree Genetics and Breeding, Harbin 150040, China; 2.College of Life Sciences, Northeast Forestry University, Harbin 150040, China)
Wild type kales (Brassica oleracea var.acephala) and its two mutants which have different petals in number were used as material. One AGL6-homologue from conventional kale varieties denoted as BoaAGL6 was cloned using RACE (rapid amplification of cDNA ends), then expression pattern of BoaAGL6 in each floral organ was examined. The results showed that BoaAGL6 contains a 759 bp open reading frame that encodes a deduced protein with 252 amino acid residues. Phylogenetic analysis indicated that BoaAGL6 belongs to the AGL6-like subfamily. The result from multiple methods (semi-quantitative RT–PCR and quantitative real-time PCR) revealed that the pattern of the expression of BoAGL6 is broader than those of their counterparts in eudicots, with different expression levels in petals, which is high in mutants with the most petals. These results suggest that BoaAGL6 plays important roles in controlling floral organ identity and formation in kale.
kale (Brassica oleracea var.acephala); flower development; MADS–box genes; BoaAGL6 gene
S635.9
A
1007−1032(2014)05−0487−07
10.13331/j.cnki.jhau.2014.05.007
投稿网址:http://www.hunau.net/qks
2014–05–08
黑龙江省自然科学基金项目(C201016);哈尔滨市科技创新人才专项资金项目(2013RFLXJ015)
韩悦(1989—),女,吉林吉林人,硕士研究生,主要从事植物发育研究,hanyue9488@126.com;*通信作者,qijiangxu@126.com
